某院ST11型耐碳青霉烯酶高毒力肺炎克雷伯菌分子流行病学研究*
2021-01-26程瑞飞侯思南张春娇刘兆飞姜亚锋
程瑞飞,侯思南,张春娇,刘兆飞,姜亚锋
1.南京中医药大学连云港附属医院/江苏省连云港市中医院检验科,江苏连云港 222000;2.江苏省连云港市妇幼保健院医学遗传与产前诊断科,江苏连云港 222000
肺炎克雷伯菌是一种可对人产生较强致病性的条件致病菌,可通过多种途径感染人体。根据致病性和毒力,可将肺炎克雷伯菌分为2种:与多重耐药相关的经典型肺炎克雷伯菌(cKP)和高毒力肺炎克雷伯菌(HVKP)。随着碳青霉烯类抗菌药物的大量应用,cKP大量地转变为耐碳青霉烯酶肺炎克雷伯菌(CRKP)。CRKP的ST分型主要包括在亚洲尤其是中国流行的ST11型,以及在欧洲及北美地区流行的ST258型。HVKP的毒力显著高于cKP,可引起严重的社区获得性感染,常引起化脓性肝脓肿、严重肺炎、脑膜炎和坏死性筋膜炎等。HVKP引起的疾病通常是因其过度分泌荚膜多糖所致[1-2],感染对象主要为健康的年轻人群,主要ST分型包括ST23、ST65及ST86型等[3]。该菌对除了氨苄西林外的其他大部分抗菌药物均敏感。有研究报道了我国东南地区某医院携带blaKPC-2的耐碳青霉烯酶高毒力肺炎克雷伯菌(CR-HVKP)以ST11型克隆传播为主[4]。随着抗菌药物耐药性的加重,CR-HVKP分离株的报道越来越多[5]。鉴于ST11型CR-HVKP日趋严峻的形势,本文分析了连云港市中医院(以下简称该院)ST11型CR-HVKP的流行特点、耐药基因、毒力基因及毒力表型情况,并进行同源性分析,为耐药菌的监测和院内感染防控工作提供科学依据。
1 资料与方法
1.1一般资料 收集该院2017年1月至2019年6月临床分离的26株经过Vitek-2 Compact全自动微生物鉴定药敏分析仪鉴定的CRKP菌株,剔除同一患者重复分离的菌株,所有菌株实验前经质谱仪鉴定。
1.2仪器与试剂
1.2.1仪器 Vitek-2 Compact全自动微生物鉴定药敏分析仪、veriti 96孔PCR扩增仪(美国ABI公司)、2720型PCR扩增仪(美国ABI公司)、凝胶成像系统分析仪(美国BIO-RAD)、CHEF Mapper脉冲场电泳仪(美国BIO-RAD)、冷凝泵(美国BIO-RAD)、电泳仪(美国BIO-RAD)、质谱仪(德国Bruker)、水浴摇床、高速低温离心机、培养箱、水浴箱、微量加样枪、电子天平、超纯水机(摩尔)。
1.2.2试剂 美罗培南(MEM)药敏平板(自制)、MH琼脂平板、DNA标志物、PCR扩增试剂(Mix、Taq酶、dNTP Mix、Taq Buffer等)、引物(上海生工)、灭菌去离子水、琼脂糖凝胶(英国OXOID)、胰蛋白胨大豆肉汤(TSB,英国OXOID)、限制性内切酶XbaⅠ(BioLabs)、蛋白酶K、凝胶染色试剂Gelred(Biotium)等。
1.3方法
1.3.1碳青霉烯酶耐药表型检测 通过改良碳青霉烯酶灭活试验(mCIM)进行碳青霉烯酶耐药表型检测:用1.0 μL接种环取满环的过夜培养的纯实验菌株于2.0 mL TSB肉汤中混匀。每管放入1张含10.0 μg MEM的无菌纸片,于35 ℃培养箱孵育4 h。用10.0 μL接种环将MEM纸片从TSB肉汤中取出,轻轻挤去纸片上水分,将纸片贴在已涂布大肠埃希菌ATCC25922的MH平板上。倒置平板,35 ℃培养箱孵育18~24 h后量取抑菌圈直径。结果判断:抑菌圈直径为6~15 mm,或直径为16~18 mm的抑菌圈内有针尖状菌落时为阳性;抑菌圈直径为16~18 mm,或≥19 mm的抑菌圈内有针尖状菌落时为不确定;抑菌圈直径≥19 mm为阴性。同时进行EDTA-改良碳青霉烯酶灭活试验(eCIM):取已标识好的第2支含2.0 mL TSB的肉汤管,加入20.0 μL 0.5 mmol/L EDTA溶液,余下操作同mCIM。两种试验同时进行,将mCIM和eCIM试管中的MEM贴于同一个已涂布有大肠埃希菌ATCC25922的MH平板。结果判断:当菌株mCIM阳性时,mCIM和eCIM中MEM抑菌圈直径相差≥5 mm,eCIM结果为阳性;直径差≤4 mm,eCIM结果为阴性。
1.3.2碳青霉烯酶耐药基因检测 采用Vitek-2 Compact全自动微生物鉴定药敏分析仪进行菌株鉴定及药敏试验。采用单重PCR检测blaKPC、blaNDM、blaVIM、blaIMP、blaOXA-48等常见的碳青霉烯酶耐药基因,对扩增产物进行凝胶成像,观察有无目的条带。
1.3.3ST分型 采用多重PCR检测Khe、Kphp、pilv、pill、ST23、ST65、ST86等常见ST分型,并采用凝胶成像仪对PCR扩增产物进行显影成像。Khe是肺炎克雷伯菌体外溶血酵素基因,是鉴定肺炎克雷伯菌的金标准,可作为一种PCR质控方法用于评价DNA模板的种类和质量。根据文献[6]判断结果,含Khe基因、kphp基因、pill基因这3条目的基因条带为ST11型,含Khe基因、kphp基因、pill基因、Pilv基因这4条目的基因条带为ST258型。
1.3.4黏液表型检测 采用拉丝实验,用接种环接触培养基上的单个菌落,然后轻轻向上牵拉,观察有无黏液丝。如果有,且长度≥5 mm,实验结果即为阳性,判断该菌株的黏液表型为高黏液性菌株。
1.3.5荚膜血清型及毒力基因检测 采用多重PCR检测实验菌株最强毒力的血清型wzyK1、wzyK2,以及K位点wzyKL47、wzyKL64两个基因。采用另一多重PCR反应体系检测实验菌株pLVPK毒力质粒相关的rmpA、rmpA2、iroN、intA这4个毒力基因,分别对扩增产物进行凝胶成像并观察有无目的片段。
1.3.6毒力表型实验 取含有毒力基因的8株对数期实验菌株分别用生理盐水配制成104、105、106、107CFU/mL的悬液,分别用汉密尔顿注射器经大蜡螟后足注射10.0 μL悬液进行毒力表型实验。将注射后的虫体分别置于无菌平皿中72 h,每12小时记录1次大蜡螟是否死亡。同时用肺炎克雷伯菌标准菌株ATCC700603进行对照实验。若虫体僵硬、发黑、无活动度,则判断大蜡螟死亡。该实验重复3次,取3次实验的平均值。
1.3.7同源性分析 对含有毒力基因的8株实验菌株采用脉冲场凝胶电泳(PFGE)进行同源性分析:制备1%的低熔点胶,取200.0 μL细胞悬液缓冲液(CSB),加入20.0 μL蛋白酶K(20 mg/mL),56 ℃水浴箱放置3~5 min,取出后迅速加入已制备好的1%低熔点胶200.0 μL并迅速混匀,将其迅速加入模具中包埋细菌,记录模具每一孔对应的标本编号。加入一定的蛋白酶K和细胞裂解液(CLB),置于54 ℃水浴摇床,孵育2 h进行细菌裂解。分别使用50 ℃的ddH2O和TE溶液清洗胶块。将胶块用XbaⅠ进行酶切8~12 h;配制1%PFGE凝胶并加样待胶块固定。在脉冲场电泳18~19 h后,洗胶脱色后用凝胶成像仪成像并保存图片。用GelJ软件对结果图片进行同源性分析。判断标准:不同菌株之间PFGE带型相似度≥85%即为同一克隆;带型相似度≥70%即为同一群[7]。
1.4统计学处理 收集所有菌株的标本信息及实验结果,并采用SPSS17.0统计软件对实验结果进行统计,同源性分析采用GelJ软件进行分析,大蜡螟感染模型死亡率采用Excel2016进行统计。
2 结 果
2.1碳青霉烯酶耐药表型结果 检测出24株实验菌株mCIM为阳性,可以判断为产生碳青霉烯酶,其中3株eCIM阳性。
2.2药敏试验及耐药基因检测结果 所有实验菌株均表现为高水平耐药、多重耐药,具有耐碳青霉烯类抗菌药物的特点。单重PCR结果显示,blaKPC占73.1%(19/26),blaNDM占7.7%(2/26),blaIMP占3.8%(1/26),而blaVIM、blaOXA-48未检出,另有4株为阴性结果,可能不含碳青霉烯酶耐药基因或含有其他不常见的碳青霉烯酶耐药基因。22株携带碳青霉烯酶耐药基因的阳性菌株检测结果与相对应菌株mCIM结果一致。
2.3ST分型 所有实验菌株均检出肺炎克雷伯菌的标记基因Khe,其ST分型以ST11型为主,占73.1%(19/26),其次为ST65型,占15.4%(4/26)。ST23、ST86、ST258型未检出。见图1。
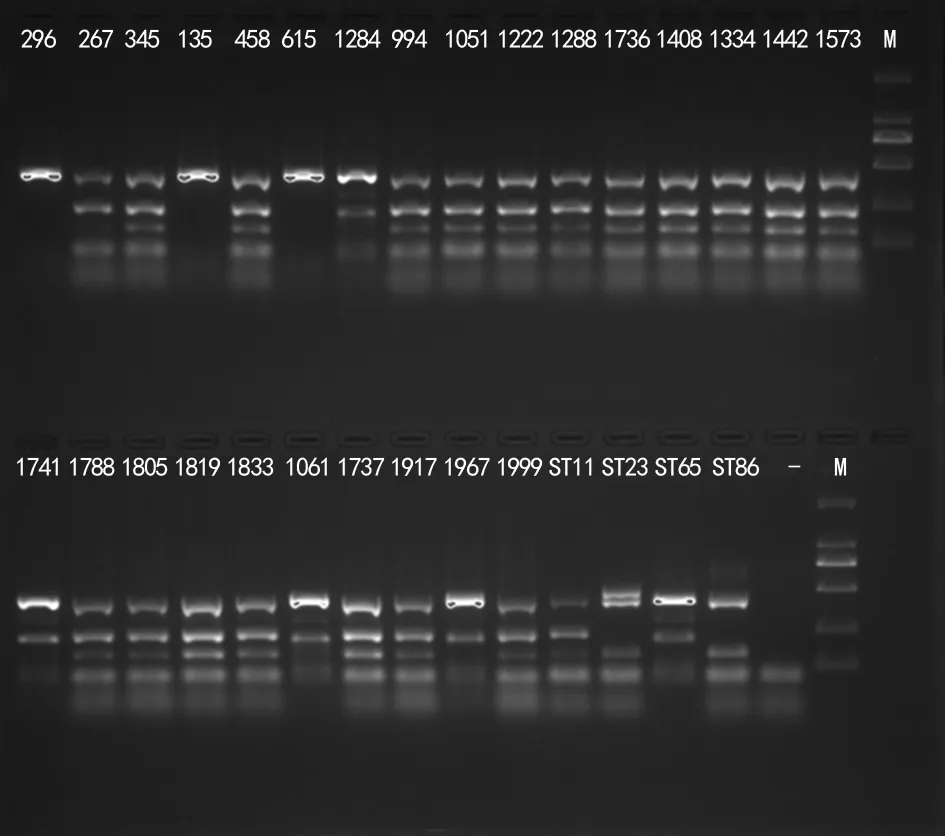
注:M为标志物;-为阴性对照;数字为菌株编号。
2.4黏液表型结果 1288号菌株和1334号菌株肉眼可见明显黏液,拉丝实验阳性,阳性率为7.69%。其他菌株拉丝实验阴性。
2.5荚膜血清型及毒力基因检测结果 615、1967号菌株荚膜血清型为wzyK1的占7.7%(2/26),wzyK2未检出。19株ST11型菌株中wzyKL47阳性率为15.8%(3/19),wzyKL64阳性率为84.2%(16/19)。4种毒力基因rmpA、rmpA2、iroN和iutA阳性率分别为30.8%(8/26)、30.8%(8/26)、7.7%(2/26)、38.5%(10/26),iutA阳性率较高(图2)。其中994号及1967号菌株携带iutA这一种毒力基因,其ST分型分别为ST11、ST65型。至少携带1种毒力基因的菌株共10株,其中8株为ST11型,由康复科患者分离出的菌株占87.5%(7/8),其中有87.5%(7/8)荚膜合成位点分型为KL64。
2.6毒力实验结果 3次实验中,大蜡螟在注射菌悬液水平为104、105CFU/mL时,72 h死亡率分别为37.5%、62.5%,注射水平为106、107CFU/mL时,24 h死亡率均为100.0%;而3次实验中肺炎克雷伯菌标准菌株(对照组)72 h均未死亡,见图3。大蜡螟感染模型结果显示,8株携带毒力基因的实验菌株均具有高毒力表型,可判断为CR-HVKP。
8株CR-HVKP菌株均为ST11型,所有携带毒力基因的菌株均携带blaKPC基因,其荚膜血清型为非K1、K2的其他分型,2株拉丝实验阳性。菌株的科室分布以康复科为主,痰液标本和尿液标本各占50%,感染患者的平均年龄为(64.5±19.4)岁,男女各占50%。见表1。
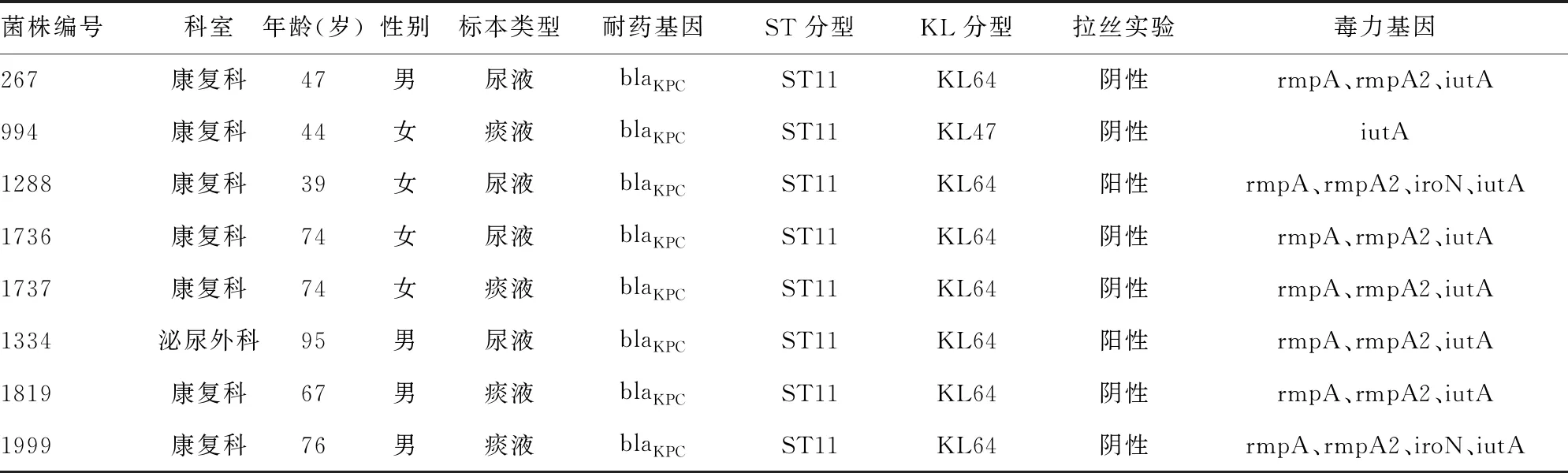
表1 高毒力的ST11型CR-HVKP菌株临床信息统计
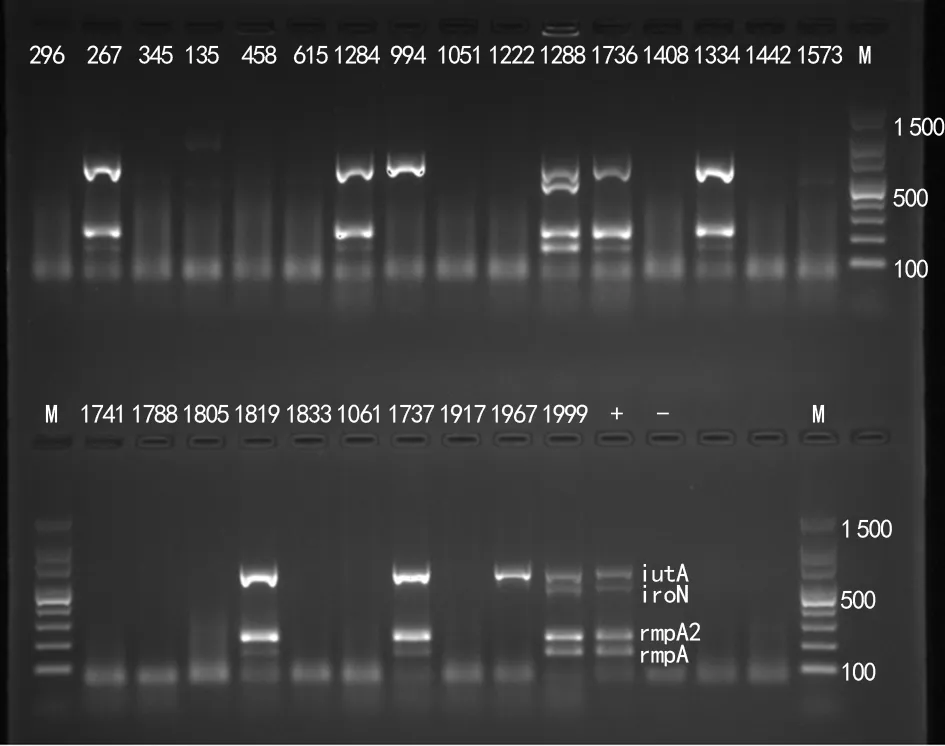
注:M为标志物;-为阴性对照;+为阳性对照;数字为菌株编号。
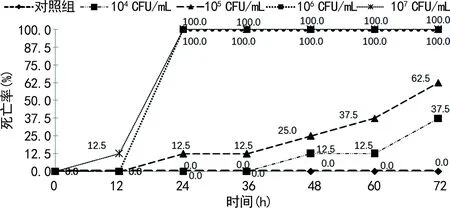
图3 大蜡螟感染模型死亡情况
2.7同源性分析结果 通过GelJ软件对PFGE结果进行分析,8株CR-HVKP可分为3群,其中1737号和1819号菌株带型相似度高于85%,可能存在同一克隆株的散在传播。见图4。
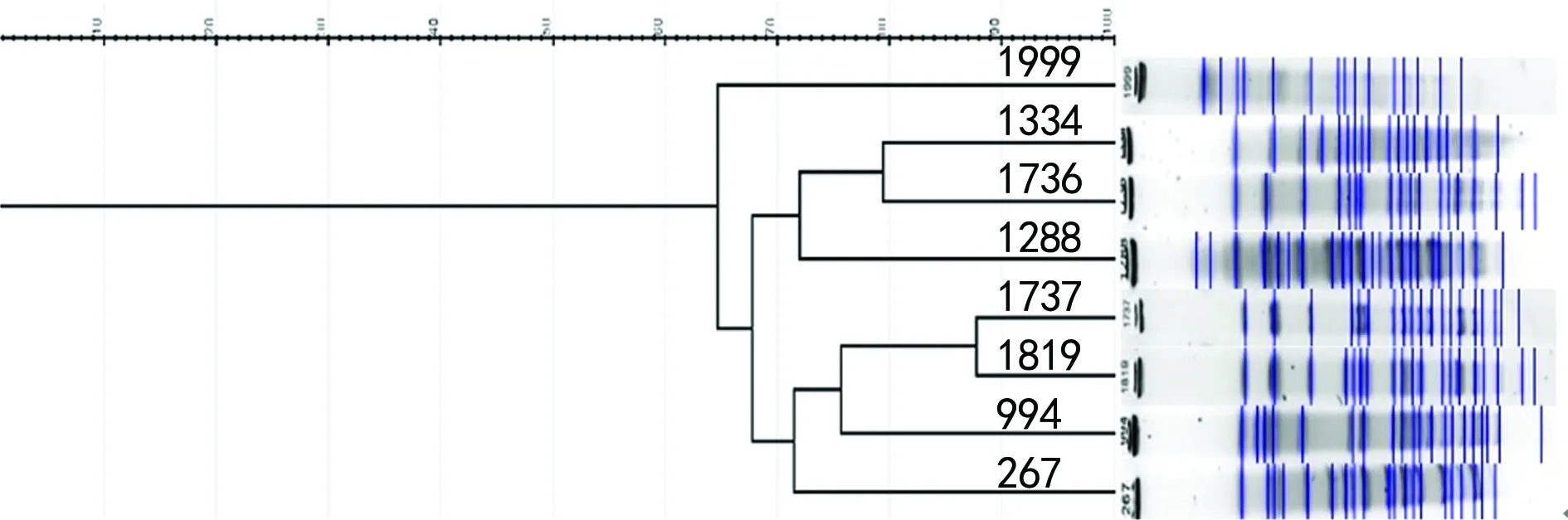
图4 8株CR-HVKP菌株的同源性分析
3 讨 论
CRKP主要的耐药机制是产碳青霉烯酶[8],mCIM是美国临床实验室标准化协会于2017年推荐的一种具有较高灵敏度和特异度的检测碳青霉烯酶表型的新方法[9-10]。eCIM与mCIM联合使用可以区分产金属酶和丝氨酸碳青霉烯酶的肠杆菌科细菌。mCIM可以单独进行实验,但eCIM必须同时和mCIM联合进行实验。本次实验中检测出mCIM阳性的菌株有24例,其中有22株携带碳青霉烯酶耐药基因,以blaKPC为主,另外2株可能携带其他的碳青霉烯酶耐药基因。
1986年一种可形成长度>5 mm黏液丝并导致社区获得性肝脓肿的肺炎克雷伯菌被报道出来。这种具有高黏液的肺炎克雷伯菌被认为是HVKP[11],是一种具有高侵袭性、可引起获得性肝脓肿的肺炎克雷伯菌[1],其引起肝脓肿的主要荚膜血清型为K1、K2。拉丝实验被认为是鉴定HVKP的标准方法。目前对于HVKP的定义,仍未达成共识。肺炎克雷伯菌的高黏液表型与高毒力表型存在较大的重叠,但近年来已发现有些菌株拉丝实验阴性却引起健康人群侵袭性感染[12];一项研究也发现了具有高黏液表型却无毒力表达的克雷伯菌株[13]。最近的研究发现,pLVPK毒力质粒所携带的毒力相关基因rmpA、rmpA2、iutA、iucABCD和iroBCDN是导致高毒力表型的主要原因[14-15]。本文结合分子生物学筛选出携带毒力基因的菌株,通过大蜡螟感染模型证实其具有高毒力表型,将携带相关毒力基因、具有毒力表型的肺炎克雷伯菌定义为HVKP。HVKP的毒力与荚膜多糖(K抗原)、脂多糖(O抗原)、铁载体系统、菌毛(如1型和3型菌毛)、非菌毛黏附蛋白及其他的毒力基因有关[16-17]。
有研究认为肺炎克雷伯菌的高耐药性与高毒力性不会重叠出现[18],然而近年来CR-HVKP菌株在世界范围内,特别是在我国被越来越多地检出[19-20]。CR-HVKP是由于经典的CRKP获得了pLVPK毒力质粒[4]或HVKP获得了碳青霉烯酶的编码质粒[21]而产生的。目前CR-HVKP在亚洲特别是我国最流行的ST分型是ST11型。
本研究通过多重PCR同时扩增了wzyK1、wzyK2、wzyKL47和wzyKL64。肺炎克雷伯菌传统的荚膜血清型至少有78种,与HVKP相关的有K1、K2、K5、K16、K20、K54、K57等,其中最常见和最致命的荚膜血清型是K1和K2[11]。KL是基于肺炎克雷伯菌全基因组数据的荚膜合成位点的一个新的命名方法,KL47和KL64是ST11型菌株的2个最普遍的荚膜合成位点,也是我国目前分离的ST11型最常见的KL分型。通过对质粒图谱进化树的分析,发现KL47和KL64属于两个分支,所携带的质粒谱不同。KL47 rmpA几乎全部定位于210 Kb质粒上,pLVPK类似的毒力质粒之间发生重组的频率更高,而对于KL64,rmpA定位于大小相同的约210 Kb的质粒上,携带KL64的pLVPK质粒的毒力高于携带KL47的pLVPK质粒。本研究检测的8株ST11型CR-HVKP的KL分型以KL64为主(87.5%),这与文献[4]报道的5株携带毒力质粒的ST11型肺炎克雷伯菌全部为局部单克隆传播的KL47不相同,表明该院ST11型CR-HVKP并非单克隆传播,同时也说明了该院分离出的实验菌株的毒力比文献[4]报道的菌株毒力更强。目前的研究表明,ST11型CR-HVKP的KL分型更多的是KL47[22]。
本课题采用3种多重PCR用于ST11型CR-HVKP的快速检测:第1体系用于检测CRKP和HVKP常见的ST型,包括ST11、ST258、ST23、ST86和ST65型等。第2体系鉴别与ST23、ST65、ST86型相关荚膜血清型K1、K2以及与ST11相关的KL47和KL64等。第3体系用于检测毒力质粒pLVPK 相关的rmpA、rmpA2、iroN、intA 4种毒力基因。
通过对该院ST11型CR-HVKP进行分子流行病学分析,发现该院的CR-HVKP菌株87.5%来源于康复科。一方面,康复科患者大多来自连云港地区各大医院,需长期住院康复治疗,而长时间住院是耐药的独立危险因素;另一方面,共用康复设备,可能存在院内感染的风险。需要加强对CR-HVKP检出科室的院内感染防控,减少CR-HVKP在患者之间的传播,科学合理用药。本研究的不足之处为没有进一步验证pLVPK毒力质粒的存在,可能存在一些pLVPK质粒携带的其他的毒力基因或毒力基因以外的毒力机制造成HVKP的高毒力。
综上所述,该院检出ST11型CR-HVKP 8株,以KL64为主,康复科检出率最高,可能存在克隆株的散在传播,需加强对康复科院内感染的防控。
