干扰lncRNA FLVCR1-AS1表达通过靶向调控miR-381-3p抑制前列腺癌细胞的增殖、迁移和侵袭
2021-01-26石曦雯罗卫民
石曦雯 金 贺 罗卫民
(广州市中西医结合医院病理科,广州 510800)
前列腺癌是发生于前列腺的上皮性恶性肿瘤,其主要治疗方法有手术、放化疗、内分泌治疗等,但晚期患者无法治愈,随着分子生物学的发展,靶向基因治疗成为恶性肿瘤治疗的新方法[1]。研究发现长链非编码RNA(long non-coding RNA,lncRNA)与前列腺癌形成、进展和转移密切相关,异常表达的lncRNA可通过表观遗传、转录及转录后调控等影响前列腺癌的生物学行为[2]。猫白血病病毒C亚类受体反义RNA1(feline leukemia virus subgroup C receptor antisense RNA1,FLVCR1-AS1)是一种lncRNA,在胆管癌组织和细胞系中高表达,抑制FLVCR1-AS1表达可抑制胆管癌细胞增殖、迁移和侵袭[3]。沉默FLVCR1-AS1通过抑制Wnt/β-catenin信号通路抑制肺癌细胞增殖、迁移和侵袭[4]。微小RNA(microRNA,miRNA)在细胞生物学过程中发挥重要作用,调控前列腺癌发生与发展[5]。研究报道伊卡利汀可通过调节miR-381-3p及其靶基因UBE2C表达对前列腺癌起抑制作用[6]。miR-381-3p在口腔鳞状细胞癌组织和细胞中低表达,过表达miR-381-3p可抑制细胞增殖,促进细胞凋亡[7]。但lncRNA FLVCR1-AS1在前列腺癌细胞中的表达及其对前列腺癌细胞增殖、迁移和侵袭的影响及机制是否与miR-381-3p相关目前尚未阐明。本文研究FLVCR1-AS1和miR-381-3p对前列腺癌细胞增殖、迁移和侵袭的影响及FLVCR1-AS1是否通过miR-381-3p影响细胞增殖、迁移和侵袭,为前列腺癌细胞早期诊断和治疗提供新思路、新方法和新靶点。
1 材料与方法
1.1材料 正常前列腺上皮细胞株 RWPE-1和前列腺癌细胞株DU145、LNCaP、22Rv1购自北京北纳创联公司;RPMI1640培养基、胎牛血清购自美国Sigma公司;胰蛋白酶购自美国Gibco公司;RNA提取试剂盒、荧光定量试剂盒、LipofectamineTM2000转染试剂、MTT试剂盒购自美国Invitrogen公司;BCA试剂盒、SDS-PAGE试剂盒购自上海碧云天公司;Transwell小室、Matrigel胶购自美国Bio-Rad公司;抗体均购自美国Abcam公司;双荧光素酶报告基因检测试剂盒购自翊圣生物公司;载体质粒均购自上海伯易生物科技有限公司;荧光倒置显微镜购自日本Olympus公司;Thermo FC酶标仪购自美国Thermo公司。
1.2方法
1.2.1细胞培养 正常前列腺上皮细胞株RWPE-1和前列腺癌细胞株DU145、LNCaP、22Rv1用含10%胎牛血清的RPMI1640培养基于37℃、5% CO2下培养,1 d/次换液,待细胞融和至约80%时,加入胰蛋白酶消化传代。
1.2.2细胞处理与分组 取对数生长期细胞DU145,将si-NC、si-FLVCR1-AS1、miR-NC、miR-381-3p、pcDNA、pcDNA-FLVCR1-AS1分别转染至DU145细胞,分别记为si-NC组、si-FLVCR1-AS1组、miR-NC组、miR-381-3p组、pcDNA组、pcDNA-FLVCR1-AS1组;将si-FLVCR1-AS1质粒分别与anti-miR-NC、anti-miR-381-3p共转染至DU145细胞,分别记为si-FLVCR1-AS1+anti-miR-NC组、si-FLVCR1-AS1+anti-miR-381-3p组。具体转染步骤按照Lipofecta-mineTM2000试剂盒说明书进行。
1.2.3RT-qPCR检测miR-381-3p和FLVCR1-AS1表达 提取总RNA,反转录为cDNA,按照荧光定量试剂盒说明书进行PCR检测,miR-381-3p和FLVCR1-AS1分别以U6和GAPDH为内参,各样品设3个重复,循环条件为95℃ 10 min,95℃ 30 s,60℃ 30 s;72℃ 30 s,共40个循环;60℃延长5 min。相对表达量采用2-ΔΔCt法计算。miR-381-3p F:5′-TACTTAAAGCGAGGTTGCCCTT-3′,R:5′-GGCAAG-CTCTCTGTGAGTA-3′;U6 F:5′-CTCGCTTCGGCAG-CACA-3′,R:5′-AACGCTTCACGAATTTGCGT-3′;FL-VCR1-AS1 F:5′-AGGGTTCTTGGGTCTACTTCAG-3′,R:5′-TGAGGACTTGCACTCTCTAACG-3′;GAPDH F:5′-CCCCATACACAGTGTTAGCC-3′,R:5′-GAGTGATTTTCCCGTCC-3′。
1.2.4Western blot检测CyclinD1、p21、p27、MMP-2、MMP-9、MMP-14蛋白表达 各组细胞培养48 h后提取总蛋白,BCA试剂盒检测蛋白浓度。将蛋白样品进行SDS-PAGE电泳后转至PVDF膜,5%脱脂奶粉室温封闭1 h,加入一抗4℃孵育过夜,TBST洗涤3次;加入二抗室温孵育90 min,TBST洗涤3次,ECL发光法染色,ChemiDoc XRS+系统成像,Quantity One凝胶分析软件处理,检测各组蛋白条带吸光度,蛋白相对表达水平=目的条带吸光度/GAPDH条带吸光度。各蛋白样品设3个重复。
1.2.5MTT检测细胞活性 各组细胞培养24、48、72 h时,每孔加入5 mg/ml MTT溶液20 μl,37℃培养4 h;1 000 r/min离心10 min,弃培养液,每孔加150 μl DMSO振荡10 min,使结晶物充分溶解。酶标仪检测490 nm处吸光度。细胞活性(%)=(OD实验组-OD空白组)×100%。实验重复3次,每次设3个复孔。
1.2.6Transwell检测细胞迁移和侵袭 无血清培养基重悬细胞,调整细胞浓度为2×104个/ml。迁移实验:取200 μl细胞悬液接种于Transwell小室上室,下室加入500 μl含10%胎牛血清的RPMI1640培养液,37℃培养48 h,去除培养液后用棉签擦去上层细胞,4%多聚甲醛固定30 min,0.1%结晶紫染色10 min,显微镜观察并拍照,结晶紫染色细胞数即为迁移细胞数。侵袭实验:将Matrigel胶与培养液以1∶4 混匀后平铺于Transwell小室上室,室温下干燥凝固后,按迁移实验步骤操作,显微镜下观察结晶紫染色细胞数即为侵袭细胞数。
1.2.7荧光素酶报告实验检测FLVCR1-AS1对miR-381-3p的靶向调控 构建FLVCR1-AS1的3′UTR野生型和突变型荧光素酶表达载体WT-FLVCR1-AS1和MUT-FLVCR1-AS1,用LipofectamineTM2000将WT-FLVCR1-AS1和MUT-FLVCR1-AS1分别与miR-NC和miR-381-3p共转染至DU145细胞,按照说明书进行检测。结果以荧光素酶活性和Renilla活性比值进行统计学分析,重复3次。

2 结果
2.1lncRNA FLVCR1-AS1和miR-381-3p在前列腺癌细胞和正常前列腺上皮细胞中的表达 与正常前列腺上皮细胞RWPE-1相比,前列腺癌细胞DU145、LNCaP、22Rv1中FLVCR1-AS1表达显著升高,miR-381-3p表达显著降低(P<0.05,表1)。提示在前列腺癌细胞中FLVCR1-AS1呈高表达,miR-381-3p呈低表达。

表1 FLVCR1-AS1和miR-381-3p在前列腺癌细胞和正常前列腺上皮细胞中的表达Tab.1 Expressions of FLVCR1-AS1 and miR-381-3p in prostate cancer cells and normal prostate epithelial
2.2干扰FLVCR1-AS1表达对前列腺癌DU145细胞增殖的影响 与si-NC组(1.02±0.09)相比,si-FLVCR1-AS1组DU145细胞中FLVCR-AS1表达(0.43±0.04)降低(P<0.05),细胞活性、CyclinD1表达降低,p21、p27表达升高(P<0.05,表2、图1)。提示干扰FLVCR1-AS1表达可抑制前列腺癌DU145细胞增殖。
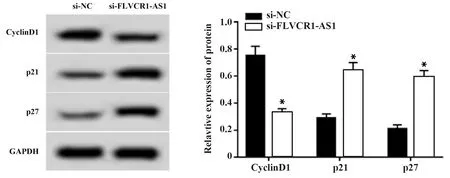
图1 干扰FLVCR1-AS1表达对前列腺癌DU145细胞增殖相关蛋白表达的影响Fig.1 Interfering with expression of FLVCR1-AS1 on expressions of proliferation-related proteins in pros-tate cancer DU145 cellsNote:Compared with si-NC group,*.P<0.05.

表2 干扰FLVCR1-AS1表达对前列腺癌DU145细胞增殖的影响Tab.2 Effect of interference with FLVCR1-AS1 expression on proliferation of prostate cancer DU145
2.3干扰FLVCR1-AS1表达对前列腺癌DU145细胞迁移、侵袭的影响 与si-NC组相比,si-FLVCR1-AS1组DU145细胞迁移和侵袭数显著减少,MMP-2、MMP-9、MMP-14表达显著降低(P<0.05,图2、3)。提示干扰FLVCR1-AS1表达可抑制前列腺癌DU145细胞迁移和侵袭。
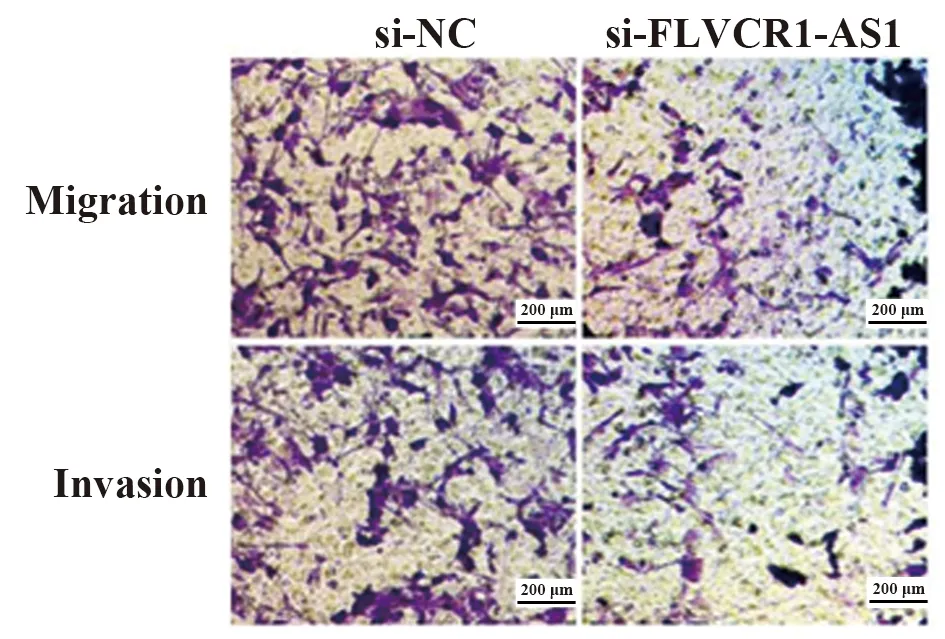
图2 干扰FLVCR1-AS1表达对前列腺癌DU145细胞迁移、侵袭的影响(×200) Fig.2 Effect of interference with FLVCR1-AS1 expre-ssion on migration and invasion of prostate cancer DU145 cells(×200)
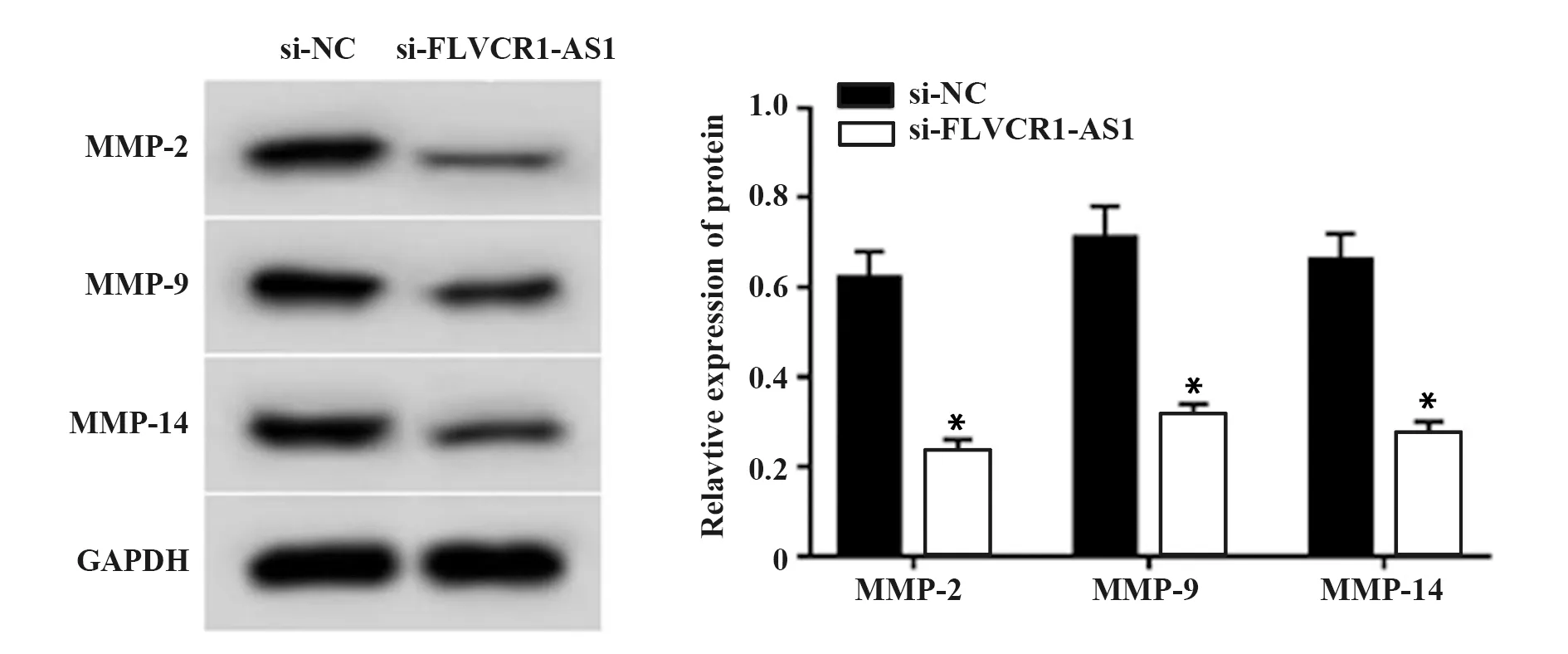
图3 干扰FLVCR1-AS1表达对前列腺癌DU145细胞迁移、侵袭相关蛋白表达的影响Fig.3 Interfering with expression of FLVCR1-AS1 on expressions of migrative and invasive related proteins in prostate cancer DU145 cellsNote:Compared with si-NC group,*.P<0.05.
2.4miR-381-3p过表达对前列腺癌DU145细胞增殖、迁移侵袭的影响 与miR-NC组(0.99±0.09)相比,miR-381-3p组DU145细胞miR-381-3p表达(2.48±0.25)显著升高(P<0.05),细胞活性显著降低,迁移和侵袭细胞数显著减少,CyclinD1、MMP-2、MMP-9表达显著降低,p21表达水平显著升高(P<0.05,表3、图4、5)。提示miR-381-3p过表达可抑制前列腺癌DU145细胞增殖、迁移和侵袭。
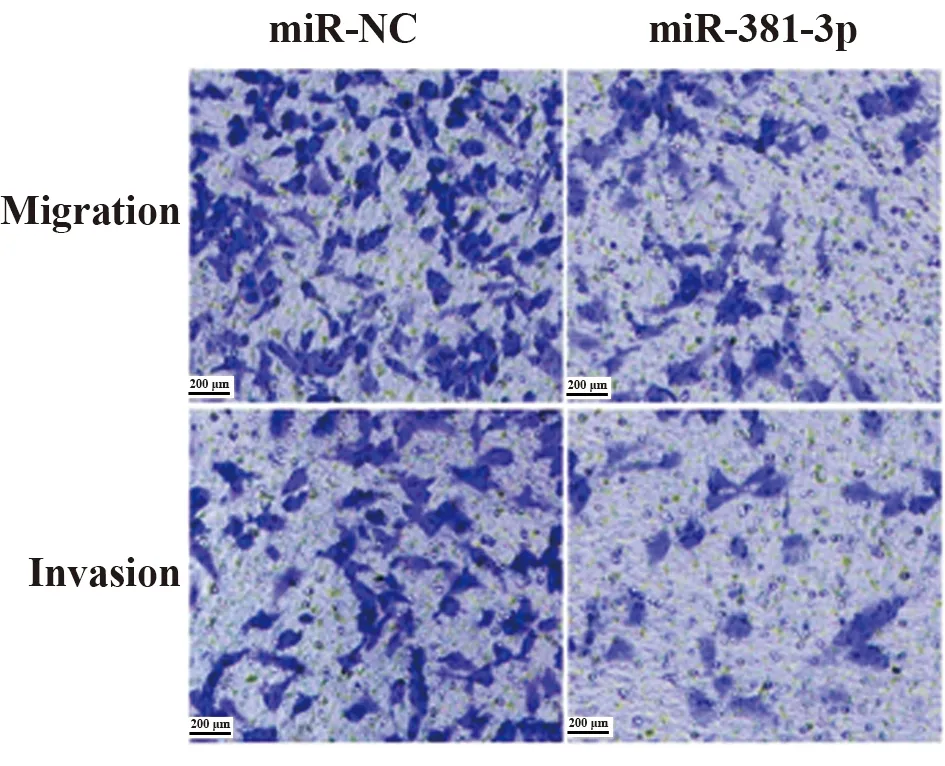
图4 miR-381-3p过表达对前列腺癌DU145细胞迁移、侵袭的影响Fig.4 Effect of miR-381-3p overexpression on migration and invasion of prostate cancer DU145 cells

图5 miR-381-3p过表达对前列腺癌DU145细胞增殖、迁移侵袭相关蛋白表达的影响Fig.5 Effect of miR-381-3p overexpression on expressions of proliferation,migration and invasion related proteins in prostate cancer DU145 cellsNote:Compared with si-NC group,*.P<0.05.
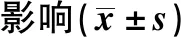
表3 miR-381-3p过表达对前列腺癌DU145细胞增殖的Tab.3 Effect of miR-381-3p overexpression on prolif-eration of prostate cancer DU145
2.5lncRNA FLVCR1-AS1靶向调控miR-381-3p表达 Targetscan软件预测显示FLVCR1-AS1与miR-381-3p存在结合位点(图6)。荧光素酶报告实验结果显示,与miR-NC组(1.02±0.09)、(1.00±0.08)相比,miR-381-3p组转染WT-FLVCR1-AS1的DU145细胞荧光素酶活性(0.38±0.04)显著降低(P<0.05),而转染MUT-FLVCR1-AS1的DU145细胞荧光素酶活性(0.99±0.09)差异无统计学意义(P>0.05)。RT-qPCR检测结果显示,与pcDNA组(1.01±0.09)相比,pcDNA-FLVCR1-AS1组miR-381-3p表达(0.41±0.04)显著降低,与si-NC组(1.00±0.09)相比,si-FLVCR1-AS1组miR-381-3p表达(2.53±0.25)显著升高(P<0.05)。提示FLVCR1-AS1可靶向调控miR-381-3p表达。

图6 FLVCR1-AS1序列中存在与miR-381-3p互补的核苷酸序列Fig.6 Sequence of FLVCR1-AS1 contains a nucleotide sequence complementary to miR-381-3p
2.6抑制miR-381-3p表达可逆转干扰FLVCR1-AS1表达对前列腺癌DU145细胞增殖、迁移侵袭的作用 与si-NC组(1.01±0.09)相比,si-FLVCR1-AS1组DU145细胞miR-381-3p表达(2.56±0.25)显著升高,细胞活性显著降低,迁移和侵袭细胞数显著减少,CyclinD1、MMP-2、MMP-9表达显著降低,p21表达显著升高(P<0.05);与si-FLVCR1-AS1+anti-miR-NC组(2.59±0.26)相比,si-FLVCR1-AS1+anti-miR-381-3p组DU145细胞miR-381-3p表达(1.63±0.16)显著降低,细胞活性显著升高,迁移和侵袭细胞数显著增加,CyclinD1、MMP-2、MMP-9表达显著升高,p21表达显著降低(P<0.05,表4、5,图7、8)。提示抑制miR-381-3p表达逆转了干扰FLVCR1-AS1表达对前列腺癌DU145细胞增殖、迁移和侵袭的抑制作用。
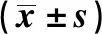
表4 抑制miR-381-3p表达对干扰FLVCR1-AS1表达对前列腺癌DU145细胞增殖的影响Tab.4 Effect of inhibition miR-381-3p expression on interference with FLVCR1-AS1 expression on proliferation of prostate cancer DU145

图7 抑制miR-381-3p表达对干扰FLVCR1-AS1表达对前列腺癌DU145细胞迁移、侵袭的影响Fig.7 Inhibition of miR-381-3p expression interference with FLVCR1-AS1 expression on migration and invasion of prostate cancer DU145 cellsNote:Compared with si-NC group,*.P<0.05;compared with si-FLVCR1-AS1+anti-miR-NC group,#.P<0.05.

表5 抑制miR-381-3p表达逆转干扰FLVCR1-AS1表达对前列腺癌DU145细胞增殖、迁移侵袭相关蛋白表达的作用Tab.5 Inhibition of miR-381-3p expression reversed effect of interference with FLVCR1-AS1 expression on proliferation,migration and invasion-associated protein expressions in prostate cancer DU145

图8 抑制miR-381-3p表达对干扰FLVCR1-AS1表达对前列腺癌DU145细胞增殖、迁移侵袭相关蛋白表达的影响Fig.8 Effect of inhibition of miR-381-3p expression on interference with FLVCR1-AS1 expression on proliferation,migration and invasion-associated protein expressions in prostate cancer DU145 cellsNote:1.si-NC;2.si-FLVCR1-AS1;3.si-FLVCR1-AS1+anti-miR-NC;4.si-FLVCR1-AS1+anti-miR-381-3p.
3 讨论
近年我国前列腺癌发病率逐渐上升,前列腺癌病情隐匿,发现时多已发生转移。前列腺癌的分子靶向治疗已取得重大进展,阐明前列腺癌的发生发展机制有助于前列腺癌治疗[8]。大量研究表明lncRNA参与调控多种癌症的发生发展过程。敲低lncRNA FLVCR1-AS1表达可通过miR-513/YAP1通路抑制卵巢癌细胞增殖、迁移、侵袭和上皮间质转化过程[9]。FLVCR1-AS1通过miR-155促进胃癌细胞增殖和侵袭,说明FLVCR1-AS1具有抑癌作用[10]。本研究结果显示,FLVCR1-AS1在前列腺癌细胞中呈高表达,干扰FLVCR1-AS1表达后CyclinD1表达显著降低,p21、p27表达显著升高,MMP-2、MMP-9、MMP-14表达显著降低,细胞活性和迁移、侵袭细胞数显著降低。CyclinD1是细胞周期中正向调节因子,p21和p27是细胞周期素依赖性激酶的抑制因子,与细胞增殖相关[11,12]。基质金属蛋白酶(matrix metalloproteinase,MMP)家族成员MMP-2、MMP-9、MMP-14与肿瘤侵袭、转移相关[13]。本研究结果说明干扰FLVCR1-AS1表达可抑制前列腺癌细胞增殖、迁移和侵袭。FLVCR1-AS1可作为前列腺癌分子治疗的新靶点和诊断、预后新的生物标志物。
研究报道miR-381-3p在乳头状甲状腺癌组织和细胞中表达下调,上调其表达可抑制甲状腺癌细胞增殖、迁移和侵袭[14]。过表达miR-381-3p通过下调FGF7抑制宫颈癌细胞增殖、迁移和侵袭,诱导细胞周期阻滞和凋亡[15]。本研究结果显示,前列腺癌细胞中miR-381-3p呈低表达,过表达miR-381-3p可降低细胞活性和迁移、侵袭细胞数,降低CyclinD1、MMP-2、MMP-9表达,提高p21表达。说明过表达miR-381-3p可抑制前列腺癌细胞增殖、迁移和侵袭。表明miR-381-3p在前列腺癌中起抑制作用。本研究还发现,FLVCR1-AS1靶向调控miR-381-3p表达,抑制miR-381-3p表达可逆转干扰FLVCR1-AS1表达对前列腺癌DU145细胞增殖、迁移、侵袭的抑制作用。说明FLVCR1-AS1可能通过调控miR-381-3p表达影响前列腺癌细胞增殖、迁移和侵袭。
综上所述,干扰FLVCR1-AS1表达可通过上调miR-381-3p表达抑制前列腺癌细胞增殖、迁移、侵袭,FLVCR1-AS1和miR-381-3p均参与前列腺癌进展,可通过调控其表达控制前列腺癌的恶性进展,为前列腺癌的诊断、治疗和预后改善提供新的分子生物标志物和治疗靶点。
