微小RNA对肿瘤微环境T细胞免疫调节作用研究的新进展
2021-01-26杨秋玲刘朝奇汪玉玲张丽轩李志英
杨秋玲 刘朝奇 汪玉玲 张丽轩 李志英
(三峡大学附属仁和医院妇产科,宜昌 443000)
根据GLOBOCAN数据库估计,2018年全球新增癌症病例约为1 810万例,因癌症死亡人数约为960万[1]。众所周知,现今社会的医疗水平并不能对中晚期癌症患者有很好的治疗效果,并可能令癌细胞对放化疗药物产生耐药性。因此,对肿瘤相关机制的研究尤为重要。随着人们对微小RNA(microRNA,miRNA)及其靶基因网络的发现和认识,miRNAs被认为是癌症进展过程中的重要参与者,其参与了癌细胞凋亡、细胞周期进展及侵袭转移等。T细胞来源于多功能骨髓干细胞,在分化成熟后成为具有免疫活性的T细胞,是肿瘤细胞免疫应答过程中的关键角色。近期研究表明,miRNAs参与调控肿瘤微环境中的免疫调控反应,其异常表达可影响T细胞的分化、发育及效应功能,导致免疫细胞的病理损伤,从而达到驱动肿瘤发生发展的目的[2,3]。本文主要从T细胞亚群即调节/抑制T细胞(regulatory/suppressor T cells,Tregs)、辅助T细胞(helper T cell,Th)及细胞毒性T细胞(cytotoxic T cell)等3个方面介绍了miRNA对肿瘤微环境中T细胞的免疫调节作用。
1 miRNA
miRNA是一种内源性的,约由18~22个核苷酸构成的小分子RNA。大多数miRNA的基因位于非编码区域,其可从自身的启动子中独立转录。成熟的miRNA通过碱基互补配对的方式识别靶mRNA,并有效地抑制转录翻译或降解靶mRNA。在大多数情况下,miRNA与靶mRNA之间发生不完全互补配对,转录翻译抑制被驱动,这意味着单个miRNA能够识别数十甚至数百种不同的mRNA转录物。而当miRNA以高度互补性与靶mRNA结合配对,mRNA就会在RISC复合物的参与诱导下被降解,从而达到负调节基因表达的目的。因此,miRNAs主要通过两种方式来抑制基因的表达:转录翻译抑制和对mRNA的降解。据了解,在miRBase登记预测的miRNA超过1 000种,已通过实验验证的人类miRNA超过500个,约占所表达基因的3%,而这一小部分miRNAs却可以调节至少30%的人类蛋白质编码基因,约60%的哺乳动物蛋白质编码基因至少由一种miRNA调节[4,5]。因此,miRNA在参与肿瘤免疫,特别是在T细胞介导的肿瘤免疫应答过程中的作用不容忽视。
2 miRNA对肿瘤微环境T细胞的免疫调节作用
2.1miRNA与Tregs Tregs是一类免疫抑制性T细胞亚群,主要通过抑制或下调效应T细胞的诱导和增殖来抑制其他免疫细胞的免疫反应,在维持机体自身耐受和免疫稳态过程中扮演重要角色。肿瘤微环境中渗透了大量肿瘤浸润性淋巴细胞,Tregs似乎可以被优先贩运到肿瘤微环境,分泌多种免疫抑制性细胞因子,并抑制其他类型免疫细胞对肿瘤发生免疫作用,从而参与到由肿瘤抗原引起的免疫应答过程。
目前,有数个miRNA已经被证明可以通过调节肿瘤微环境Tregs功能调控抗肿瘤免疫机制,从而达到减缓或终止肿瘤发展的目的。Li等[6]运用miR-28模拟物或抑制剂转染黑色素瘤小鼠脾分离的T细胞,发现miR-28模拟物可以减少Foxp3+PD1+和Foxp3+TIM3+Tregs,并导致IL-2、TNF-α分泌增多。因此,miR-28可以调节Tregs的产生或分化,并进一步恢复黑色素瘤中耗尽T细胞的细胞因子分泌功能。miR-138被发现在胶质瘤中通过靶向PD-1/PD-L1免疫检查点抑制Tregs功能。报道称,miR-138在体内优先调节免疫系统,特别是通过与PD-1和CTLA-4相互作用以抑制肿瘤浸润性Foxp3+Tregs,进而减轻肿瘤微环境中免疫抑制细胞的抑制作用[7]。此外,在小鼠乳腺癌模型中,miR-21与miR-126可能参与调节Tregs的诱导作用和效应功能,并赋予CD8+T细胞有效的抗肿瘤作用[8,9]。不同的是,miR-21的沉默通过PTEN/AKT途径减少CCR6+Tregs体内外增殖,而沉默miR-126则通过上调PI3K/Akt信号途径降低Tregs中Foxp3的表达,最终削弱了Tregs的诱导作用和抑制活性。放射治疗是癌症治疗的重要方法,主要通过对癌细胞DNA产生不可逆损伤达到治疗目的。近期研究表明,放射治疗可通过上调miR-545抑制Lewis肺癌中CCL-2对CD4+CD25+Tregs的特异性募集,沉默 miR-545可以逆转Lewis肺癌的放射敏感性[10]。
以上研究表明,Tregs在肿瘤微环境中显示出增强的肿瘤浸润和积聚能力,并与肿瘤预后不良及患者存活率显著相关。作为免疫抑制性肿瘤微环境的重要贡献者,肿瘤相关Tregs与miRNA构成的免疫调控网络可能揭示了肿瘤免疫治疗新兴分子靶点,为未来肿瘤治疗提供新思路。
2.2miRNA与Th细胞 Th细胞是一种细胞表面主要表达CD4糖蛋白的T细胞亚群,主要通过其细胞表面的抗原接收器识别MHCⅡ类分子,并进一步与TCR相互作用而被激活。活化的Th细胞主要分为3种,包括Th1、Th2和Th17细胞。在肿瘤微环境中,Th细胞可以通过识别癌细胞表面肿瘤抗原而区分癌细胞与自身细胞的不同,进而指挥机体对抗癌细胞入侵,并向其他类型免疫细胞发送免疫信号,从而调控或辅助其他淋巴细胞发挥效应功能。据了解,miRNA是肿瘤微环境中Th细胞抗肿瘤免疫功能的重要调节因子,一方面其干扰了Th细胞极化;另一方面其在调节Th细胞的细胞因子(如IFN-γ、TNF-β)分泌的同时,进一步将免疫信号呈递给杀伤性细胞,驱动抗肿瘤免疫应答,减缓肿瘤进展速度。
Ye等[11]报道称,miR-24-3p、miR-891a、miR-106a-5p、miR-20a-5p和miR-1908可被癌细胞衍生外泌体转移至T细胞,并通过下调MAPK途径抑制Th1和Th17细胞的分化而损害T细胞功能,影响IL-1β、IL-6、IL-10、IFN-γ、IL-2、IL-17等细胞因子的分泌,降低抗肿瘤作用。另一项研究也表明,miR-24-3p可抑制T细胞增殖及Th1和Th17细胞的分化,并通过抑制FGF11表达以调节ERK和STAT蛋白磷酸化,导致癌细胞发生免疫逃逸[12]。Jiang等[13]研究发现,miR-17-92簇,特别是miR-17和miR-19b参与调节黑色素瘤T细胞亚群的分化。实验表明,miR-17-92簇在肿瘤微环境Th1细胞中过表达,其通过促进增殖、减少活化诱导的死亡、增强IFN-γ分泌及抑制Tregs分化来控制Th1细胞的免疫反应。Wan等[14]通过基因芯片和qPCR技术检测了136例非小细胞肺癌患者组织,发现miR-142-5p在肺癌组织中表达上调,肿瘤微环境中CD4+T细胞水平降低,下调该miRNA表达可通过PTEN途径降低PD-L1、PI3K和p-Akt蛋白表达水平,增加CCL17、CCL12及IFN-γ分泌到肿瘤微环境中,进而影响非小细胞肺癌中CD4+T细胞的癌症效应。除此之外,过表达miR-142-5p还可阻断PD-1/PD-L1信号途径,导致肿瘤微环境中PD-1+T细胞减少,CD4+、CD8+T细胞增多,细胞因子IFN-γ、TNF-α分泌增加,IL-10减少,癌细胞增殖减缓[15]。Zarogoulidis等[16]研究发现miR-155在转移性肺癌组织中表达水平显著低于邻近正常组织,晚期转移阶段肺癌组织中CD4+T细胞数量显著低于早期阶段,使用自噬抑制剂氯喹和卡铂处理离体培养组织,发现联合用药组的miR-155表达增强;利用miR-155转染离体肺癌组织,发现联合用药组的CD4+及Foxp3+T细胞数量显著增加。因此,自噬阻断通过调节miR-155促进肿瘤微环境中淋巴细胞浸润增加肺癌对卡铂的敏感性,miR-155在此过程中则扮演了新型免疫系统激活剂的角色。Colangelo[17]等利用剂米托蒽醌和奥沙利铂暴露结直肠癌细胞,发现高表达miR-27a可通过相同的未折叠蛋白反应途径阻碍化学治疗诱导的癌细胞免疫原性死亡,离体实验还发现高表达miR-27a可抑制树突状细胞成熟,增加特异性细胞因子IL-4、IL-6、IL-8分泌,减少CD4+T细胞增殖及IFN-γ分泌。这些实验结果表明,miR-27a在结直肠癌中具有一定的抗肿瘤免疫效应。miR-141是在乳腺癌中参与下调CD4+T细胞免疫功能的miRNA之一,其机制可能涉及下调miR-141促进了靶基因MAP4K4蛋白表达,COX-2、PGE2、TNF-α表达降低,IL-10表达增加,且LDH、caspase-3及caspase-9活性降低,CD4+T细胞抗癌作用减弱,癌细胞得以存活并进一步增殖[18]。
总之,miRNA是Th细胞介导的抗肿瘤免疫应答网络中的关键调控基因,其不仅可以通过调节一系列下游靶基因的表达活化Th细胞,还可以通过多种生物过程对Th细胞进行重新编程,并刺激诱导其他直接参与免疫反应的免疫细胞,有针对性地、特异性地调节肿瘤免疫应答,从而避免癌细胞发生免疫逃逸。
2.3miRNA与细胞毒性T细胞 细胞毒性T细胞是一类细胞表面主要表达CD8跨膜糖蛋白的免疫细胞,可以识别并结合被感染的细胞,通过颗粒酶、穿孔素及肿瘤坏死因子等途径杀伤靶细胞,因而也被称为杀手T细胞。据了解,CD8+T细胞是肿瘤发展最初的关键制动因素,同时也与肿瘤发展进程及预后息息相关。
miRNA分析研究鉴定了多种miRNA在肿瘤微环境CD8+T细胞活化过程中异常表达,例如miR-200、miR-195/-16家族、miR-424(322)等。有报道指出,miRNA-200在非小细胞肺癌中表达下调,miR-200/ZEB1轴通过调节PD-L1表达降低肿瘤微环境CD8+T细胞丰度抑制其杀伤活性,促进癌细胞增殖转移[19]。Tao等[20]将前列腺癌细胞与T细胞共培养发现在高表达miR-195/-16的细胞中,辐射诱导的PD-1+/CD8+T细胞凋亡被阻断,提示miR-195/-16在前列腺癌中通过阻断PD-1/PD-L1途径调节肿瘤微环境中的细胞因子分泌及CD8+T细胞丰度,逆转放疗诱导的免疫抗性。此外,miR-424(322)被发现与T细胞介导的卵巢癌细胞耐药有关,其在卵巢癌中阻断PD-L1免疫检查点,通过调节T细胞的细胞因子分泌及IFN-γ+/CD8+T细胞丰度来增强化疗疗效[21]。miR-491也是调节CD8+T细胞增殖凋亡的miRNA之一。研究者们在结直肠癌CD8+T细胞中发现上调的miR-491,并鉴定了CDK4、TCF-1和Bcl-xL为miR-491靶标,过表达miR-491可抑制T细胞增殖,促进其凋亡,且CD8+T细胞中IFN-γ分泌减少,抗肿瘤能力降低[22]。因此,miR-491在肿瘤微环境中充当了T细胞功能负调节剂,有利于肿瘤免疫逃逸。TGF-β是肿瘤发生免疫逃逸的重要介质,阻断其表达可逆转肿瘤免疫耐受状态。Lin等[23]发现TGF-β在肿瘤微环境中阻断CD8+T细胞毒性的主要机制之一是miR-23a表达升高,抑制CD8+T细胞中miR-23a表达可减轻TGF-β介导的免疫功能抑制状态。研究表明,miR-23a可与其靶标BLIMP-1的3′-UTR结合,抑制多个关键CD8+T细胞效应分子和转录调节因子T-bet表达,导致CD8+T细胞抗肿瘤反应迟钝,对癌细胞杀伤活性降低,肿瘤进展速度加快。因此,在基于T细胞的抗肿瘤免疫疗法中,miRNA及其相关基因的表达不仅在一定程度上改善了癌细胞耐药问题,还可以调节CD8+T细胞杀伤活性,解除肿瘤微环境免疫耐受状态,延缓肿瘤进展过程。
3 小结与展望
综上所述,miRNAs参与调节肿瘤微环境中T细胞生物学途径的多个方面,包括免疫检查点、肿瘤抑制因子和信号通路等(表1)。不可否认的是,miRNAs已经成为调节T细胞存活、发育、分化和效应功能的关键调控因子。近年来,基于T细胞的抗肿瘤免疫疗法已经受到越来越多的关注,而随着研究者们对miRNAs介导的T细胞免疫调控网络研究的不断深入,miRNAs 已经成为抗肿瘤免疫的新型调节剂,在未来亦可能成为癌症免疫治疗的潜在分子靶点。因此,可以将基于T细胞的抗肿瘤免疫疗法与miRNAs的组合认为是用于癌症治疗的具有前景且稳健的策略。但如何将其有效地整合并应用于临床是目前亟待解决的关键问题。
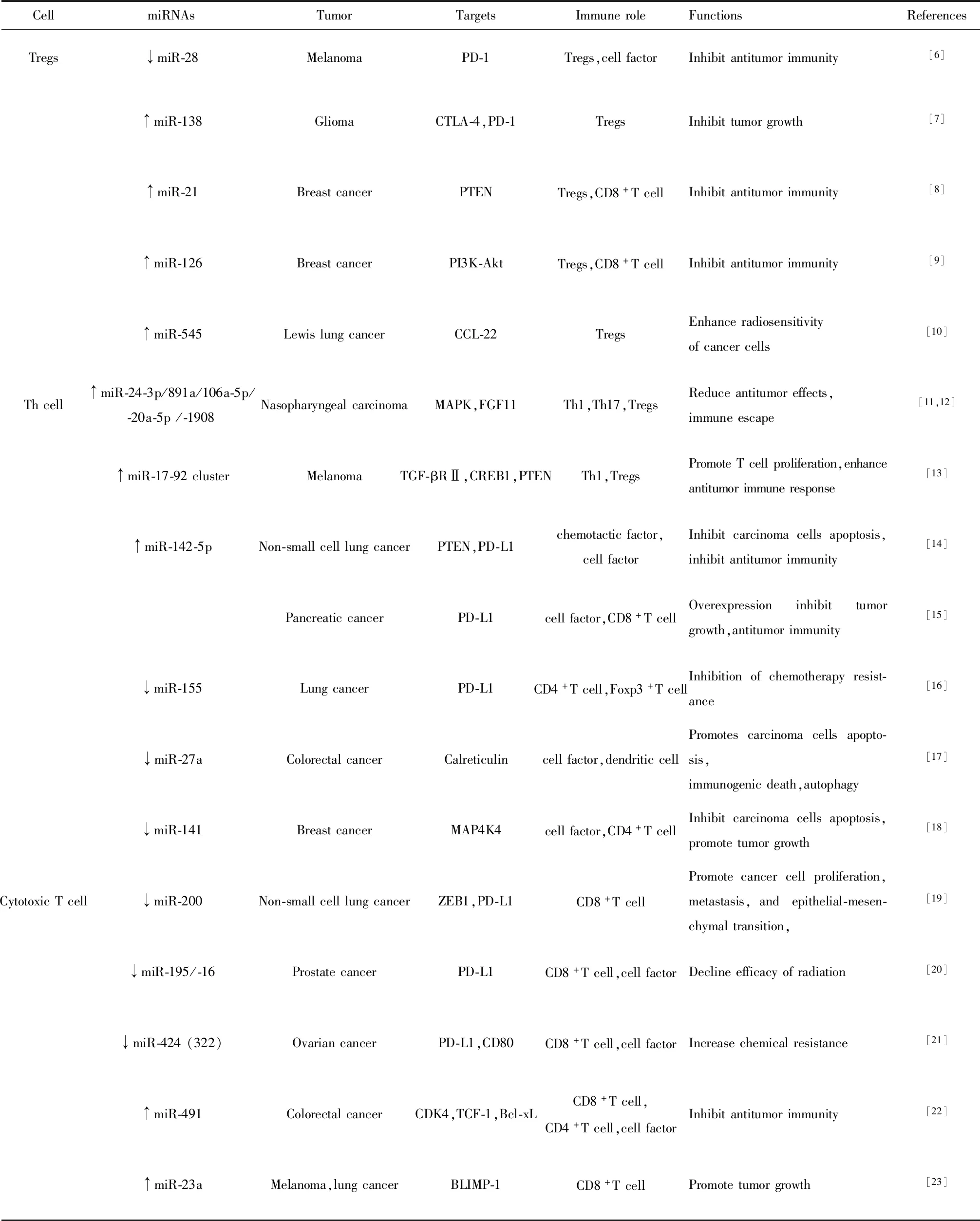
表1 肿瘤微环境中T细胞免疫相关miRNAsTab.1 T cell immune-related miRNAs in tumor microenvironment
