上调miR-145对Th9细胞分化及相关因子表达的影响①
2021-01-26黄尤艺张湘莲姜海行覃山羽
韦 茜 黄尤艺 张湘莲 姜海行 覃山羽
(广西医科大学第一附属医院消化内科,南宁 530021)
恶性腹腔积液(malignant ascites,MA)是由多种因素共同作用的结果,常见于卵巢癌、肝癌、胃癌等疾病的晚期阶段,目前其形成机制尚不完全清楚。除了肿瘤细胞外,MA中还含有大量的免疫细胞,如淋巴细胞(主要是CD4+淋巴细胞)、巨噬细胞、粒细胞等,发生MA时,它们被有选择性地募集到腹腔,进而发挥生物学作用[1,2]。Th9细胞是CD4+辅助性T 细胞亚群,可由转录生长因子β(transforming growth factor β,TGF-β)和IL-4在体外刺激诱导初始CD4+T 细胞获得,主要分泌IL-9 和IL-10,具有免疫调节、促炎、抗肿瘤等效应[3,4]。本课题组前期研究显示Th9细胞在MA的发展过程中发挥重要作用,而anti-IL-9处理可以延长小鼠MA 模型的中位生存期[5,6]。
微小RNA145(miR-145)是微小RNA家族的一员,miR-145在多种癌症中普遍下调,其通过靶向多种癌基因调控细胞周期、增殖、凋亡和侵袭等[7]。研究显示卵巢癌患者MA中的miR-145 表达下调[8]。此外,Lam等[9]研究显示在卵巢癌小鼠模型中,激活miR-145可抑制卵巢肿瘤的生长和转移,从而减少MA产生。Wang等[10]研究显示在实验性重症肌无力大鼠模型中,过表达miR-145可抑制Th17 细胞的分化。目前miR-145 的研究多集中在肿瘤细胞,但对MA 免疫微环境中的miR-145 与Th9 细胞之间的关系及其作用机制鲜有报道。因此,本研究重点探讨上调miR-145对Th9细胞及相关因子表达的影响。
1 材料与方法
1.1材料 C57BL/6小鼠(6~8周,雌性),体质量18~22 g,SPF级,由广西医科大学实验动物中心提供,动物许可证号:SYXK(桂)2014-0002。RPMI1640细胞培养基,胎牛血清(美国Gibco);青链霉素(北京索莱宝);Recombinant Human TGF-β1,Recombinant Mouse IL-4(美国R&D);EasySepTMMouse Naïve CD4+T Cell Isolation Kit(加拿大StemCell);Stain Buffer(FBS),Fixation/Permeabilization Solution Kit,anti-Mouse CD3e,anti-Mouse CD28,AlexaFluor647标记anti-Mouse IL-9抗体,PerCP-Cyanine5.5标记anti-Mouse CD4抗体,Leukocyte Activation Cocktail,流式细胞仪FACSCantoⅡ(美国BD);TransIT-TKO转染试剂(美国Mirus);miRNeasy Micro Kit(德国QIAGEN);miRNA逆转录试剂盒,miRNA qPCR Kit(北京天根生化科技);mRNA逆转录试剂盒(日本TaKaRa);TRIzol Reagent,mRNA RT-PCR试剂盒(美国Thermo Fisher);小鼠IL-9 ELISA 检测试剂盒(武汉华美生物工程);miR-145-5p mimic,miR-145-5p mimic Negative Control (韩国 Bioneer)。
1.2方法
1.2.1脾脏单细胞悬液制备及初始CD4+T细胞的分选 参考Pham[11]的方法,颈椎脱臼法处死小鼠,无菌环境中解剖小鼠,分离脾脏置于盛有预冷的5 ml RPMI1640完全培养基的培养皿中,用1 ml注射器尾部研磨脾脏,用吸管轻轻反复吹散细胞,将组织研磨液用200目尼龙网过滤,以1 500 r/min离心5 min 弃上清,用1 ml红细胞裂解液重悬裂解红细胞,1 min后立即加入20 ml培养基终止反应,1 500 r/min 离心5 min,弃上清,沉淀用PBS溶液重悬,细胞计数,再离心留细胞沉淀。用含2%胎牛血清的PBS重悬形成1×108个/ml浓度的细胞悬液。按试剂盒说明书进行细胞免疫磁珠分选。分选后的细胞用流式细胞术检测CD4+T细胞的纯度。
1.2.2Th9细胞的体外诱导分化 参考Humblin等[12]的方法,将初始CD4+T细胞种植于预先包被anti-CD3(2 μg/ml)的96孔板中,加入anti-CD28(2 μg/ml)、IL-4 (20 ng/ml) 和TGF-β(2 ng/ml)诱导为Th9细胞,对照组Th0细胞不加IL-4、TGF-β,各组细胞在含有10%胎牛血清的RPMI1640完全培养基中置于37℃、5%CO2条件下培养3 d。72 h后收集细胞,用流式细胞术、RT-PCR进行分析。
1.2.3细胞体外转染 取初始CD4+T细胞随机设置为实验组、对照组和空白组,按1×105个/孔细胞接种于96孔板。实验组和对照组细胞内分别转染miR-145 mimic、miR-145 mimic NC,空白组不转染。基因转染步骤按TransIT-TKO转染试剂说明书进行,转染后24 h收集各组细胞应用RT-PCR检测miR-145表达水平。
1.2.4流式细胞术检测CD4+T细胞纯度及Th9细胞诱导比例 加入Leukocyte Activation Cocktail (2 μl/ml)刺激细胞,37℃、5%CO2培养4~6 h后收集细胞并计数,按1×105个/管分装至流式管中,1 500 r/min离心5 min,PBS洗1遍,离心后弃上清,用100 μl PBS重悬细胞,加入PerCP-Cyanine5.5 标记CD4抗体,4℃避光染色20 min,PBS洗1遍,1 500 r/min离心5 min,弃上清,加入Fixation/Permeabilization固定/破膜液250 μl,室温固定30 min,加入2 ml Perm/Wash液洗1遍,1 500 r/min离心5 min弃上清,以50 μl Perm/Wash液重悬细胞,加入AlexaFluor647标记IL-9抗体,室温避光染色30 min,Perm/Wash洗1遍,1 500 r/min离心5 min弃上清,用200 μl PBS重悬后用流式细胞仪检测。
1.2.5ELISA检测Th9细胞上清液IL-9的分泌水平 转染后的细胞诱导分化3 d,收集细胞培养上清液,检测IL-9的分泌。按照试剂盒说明操作,加入配好的标准品和样品,37℃温育2 h,倒掉液体,加生物素标记抗体混匀,37℃温育1 h,洗3次,加辣根过氧化物酶标记的亲和素工作液,37℃温育1 h,洗5次,加TMB底物,37℃温育15~30 min,加终止液终止反应,5 min内读板,450 nm波长检测吸光度。
1.2.6RT-PCR 检测细胞miR-145、NFATc1 mRNA、IL-9 mRNA及Smad3 mRNA表达水平 细胞转染24 h后收集各组细胞,按miRNeasy Micro Kit说明书提取细胞miRNA,并按miRcute Plus miRNA First-Strand cDNA Kit说明书进行逆转录合成,反应条件:42℃ 60 min、95℃ 3 min(1个循环)。按照miRcute Plus miRNA qPCR Kit说明书进行实时荧光定量RT-PCR检测,扩增条件:95℃ 15 min(1个循环),94℃ 20 s、64℃ 30 s、72℃ 34 s(5个循环),94℃ 20 s、60℃ 34 s(43个循环)。以U6为内参照基因,采用2-ΔΔCt计算miR-145的相对表达量,miR-145及U6特异性引物均由生工公司设计合成,miR-145上游引物序列为5′-ACGGTCCAGTTTTCCCAGGAATCCCT-3′。于转染后24 h收集细胞检测NFATc1 mRNA,于转染并诱导3 d后收集细胞检测IL-9 mRNA及Smad3 mRNA,按TRIzol试剂操作说明书提取细胞总RNA。按照PrimeScriptTMRT reagent Kit with gDNA Eraser说明书进行逆转录,反应条件:37℃ 15 min、85℃ 5 s(1个循环)。按照PowerUpTMSYBRTMGreen Master Mix说明书进行实时荧光定量RT-PCR检测。扩增条件:UDG酶激活95℃ 2 min(1个循环),预变性95℃ 2 min (1个循环),95℃ 15 s、60℃ 1 min (40个循环)。以GAPDH为内参照基因,采用2-ΔΔCt计算mRNA的相对表达量,引物序列见表1。

2 结果
2.1Th9细胞诱导分化比例 分选后的细胞用流式细胞术检测比例为(91.4±2.7)%,获得高纯度的初始CD4+T细胞。按Th9、Th0细胞诱导条件培养72 h后,分别检测两组的细胞标志物,结果显示,Th9组CD4+IL-9+细胞比例高于对照Th0组[(10.9±2.0)% vs (2.22±0.2)%,P<0.05], 差异有统计学意义,Th9细胞诱导成功,见图1。
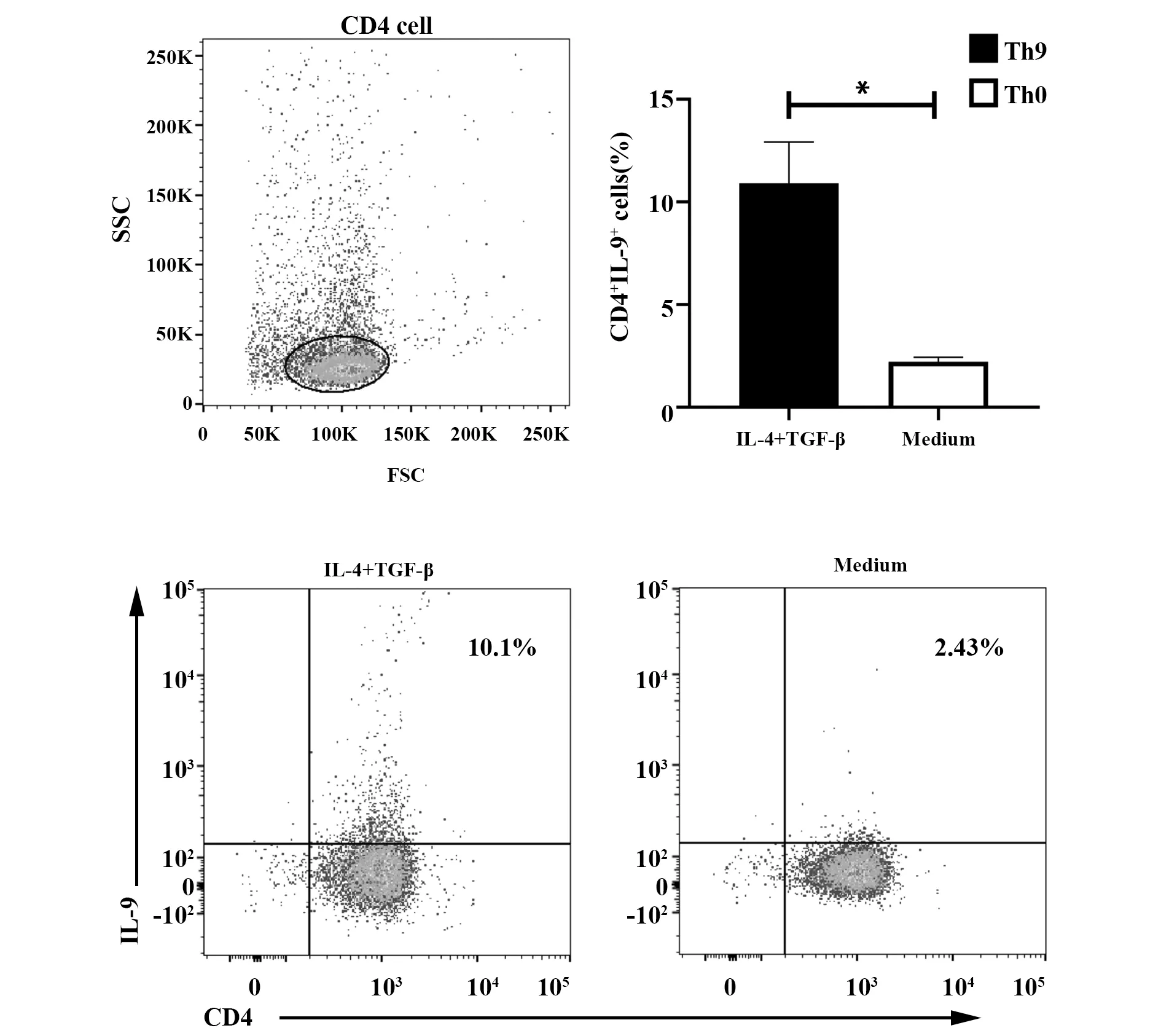
图1 CD4+细胞纯度及Th9细胞诱导流式分析Fig.1 Flow cytometry analysis of CD4+ cell purity and Th9 cellsNote:Naive CD4+T cell were differentiation under a Th9 cell-inducing conditions for 3 d,and then CD4+T cells were first gated on FSC and SSC to remove debris and conjugates,Th9 cells were defined as CD4+IL-9+ subpopulations by flow cytometry.Compared with Th0 group,*.P<0.05.
2.2细胞转染后miR-145的表达情况 转染24 h后分别提取各组细胞miRNA,并逆转录得到相应cDNA,以其作为模板对miR-145进行扩增。结果显示,与转染miR-145 mimic NC组和对照组相比,转染miR-145 mimic组细胞miR-145表达水平均显著增高,差异具有统计学意义(P<0.01),见图2。
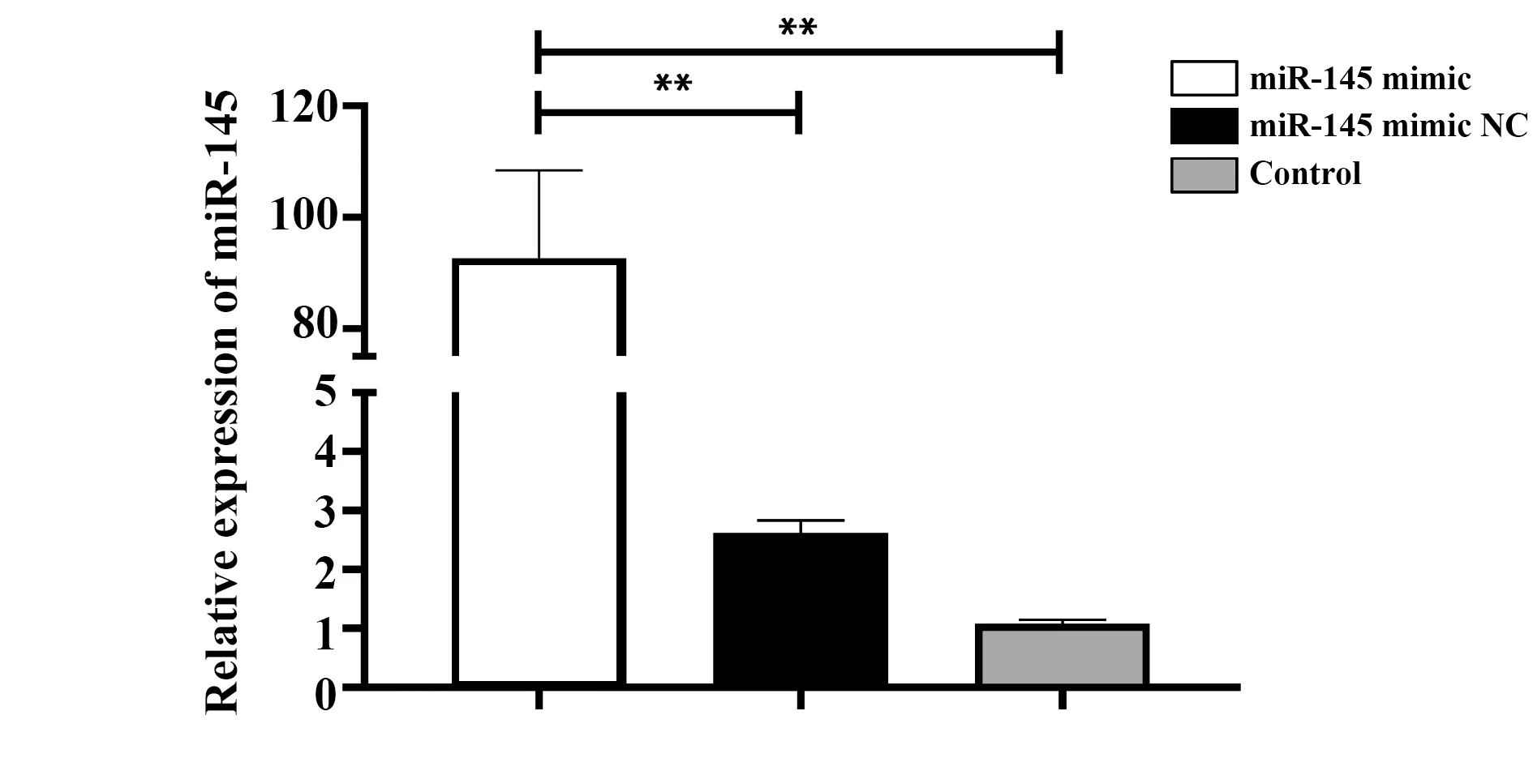
图2 RT-PCR分析转染后miR-145的表达Fig.2 RT-PCR analysis of miR-145 expression after transfectionNote:Naive CD4+T cells were transfected with miR-145 mimic or miR-145 mimic NC,RT-PCR analysis of miR-145 expression after 24 h,**.P<0.01.
2.3miR-145可抑制Th9细胞标志物的表达 细胞转染后诱导分化72 h, 检测各组细胞标记物CD4+
IL-9+,实验结果显示CD4+IL-9+细胞的比例为:miR-145 mimic组(3.24±1.66)%、miR-145 NC组 (7.84±1.92)%、对照组(8.58±2.36)%。结果显示转染miR-145 mimic组的细胞CD4+IL-9+表达较转染miR-145 mimic NC组和对照组均降低,差异具有统计学意义(P<0.05),见图3。

图3 流式细胞术分析转染后诱导的Th9细胞Fig.3 Flow cytometry analysis of Th9 cells after transfectionNote:Naive CD4+T cells were transfected with miR-145 mimic or miR-145 mimic NC,and then polarised under Th9 conditions 3 d,analysed by flow cytometry,*.P<0.05.
2.4miR-145可抑制CD4+T细胞NFATc1的mRNA表达 转染24 h后分别检测miR-145 mimic组、miR-145 mimic NC组细胞NFATc1 mRNA表达,结果显示,与转染miR-145 mimic NC的细胞相比,转染miR-145 mimic细胞的NFATc1 mRNA表达水平降低(t=-4.932,P<0.01),差异具有统计学意义,见图4A。

图4 miR-145对Th9细胞分泌IL-9及IL-9 mRNA和Smad3 mRNA表达的影响Fig.4 Effects of miR-145 on expression of IL-9,IL-9 mRNA and Smad3 mRNA in Th9Note:A.RT-PCR analysis of NFATc1 mRNA expression after transfection,**.P<0.01;B.The supernatant was collected and the IL-9 secretion was detected with ELISA,**.P<0.01;C.RT-PCR analysis of IL-9 mRNA and Smad3 mRNA expression,ns.P>0.05,*.P<0.05,**.P<0.01.
2.5miR-145可抑制Th9细胞IL-9的分泌 细胞转染24 h后,刺激诱导分化为Th9细胞,3 d后收集细胞上清分别检测各组细胞IL-9泌水平,结果显示:转染miR-145 mimic组(107.1±9.6)pg/ml,转染miR-145 mimic NC组(173.8±9.9)pg/ml,对照组(185.0±5.1)pg/ml。结果显示组间整体比较差异有统计学意义(F=73.2,P<0.01),多重比较显示:转染miR-145 mimic组的细胞IL-9表达水平比转染miR-145 mimic NC组和对照组均显著减少(P<0.01),差异具有统计学意义,见图4B。
2.6miR-145可抑制Th9细胞IL-9的mRNA表达 各组转染后的细胞刺激诱导72 h,分别检测IL-9、Smad3的mRNA 表达水平,结果显示,组间整体比较差异均有统计学意义(IL-9:F=11.428,P<0.01;Smad3:F=6.033,P<0.05)。与转染miR-145 mimic NC组和对照组相比,转染miR-145 mimic组的IL-9的mRNA表达水平降低(P<0.05);与对照组相比,转染miR-145 mimic组的Smad3的mRNA表达水平下降(P<0.05),差异均具有统计学意义。而与转染miR-145 mimic NC组相比,转染miR-145 mimic组细胞的Smad3的mRNA 表达降低(P>0.05),差异无统计学意义。实验结果证实上调miR-145可抑制Th9的IL-9的mRNA表达,见图4C。
3 讨论
Th9细胞是新近被发现和确认的CD4+细胞的一个亚群,其可由Th2细胞在TGF-β刺激下获得,也可在体外由小鼠初始CD4+T细胞在TGF-β和IL-4共同刺激下诱导产生,主要分泌IL-9效应因子,能够激发炎症反应,参与多种免疫性疾病的病理生理过程[3,13]。在本研究中,从小鼠脾脏细胞分选初始CD4+T细胞后经诱导分化培养,CD4+IL-9+细胞比例较未诱导细胞明显增高,与Wang等[14]结果基本一致。
Th9细胞分化涉及多种转录因子调控,编码细胞因子IL-9 的基因是Il9,调控Il9 基因转录的调节因子包括PU.1、IRF1、IRF4、STAT5、STAT6、NFAT、GATA-1、GATA3、Smads、Etv5、Notch 以及NF-κB、AP-1等[15]。Jash等[16]研究显示T 细胞受体活化激活了核因子NFAT 和NF-κB,促进其核定位和Il9 基因的表达,协同促进Th9 细胞分化。NFATc1是NFAT家族的一员,Peng等[17]研究发现NFATc1调控T和B细胞的活化与分化,NFATc1缺失则导致淋巴细胞增殖受损,淋巴细胞的分化也受到抑制。此外,在Th9调控中,Smad3是TGF-β受体的下游信号,TGF-β/Smad信号途径可以激活IL-9的表达,Smad2、3 和4 缺失时,明显抑制Th9 细胞分化[18]。这些结果都提示NFATc1、Smad3在Th9细胞的分化机制中起重要作用。
MicroRNAs是一种内源性的小型(18~25个核苷酸)非编码RNA,通过抑制翻译或降低mRNA的稳定性在转录后水平调控基因表达。miR-145在多种癌症中普遍下调,通过靶向多种癌基因调控细胞周期、增殖、凋亡和侵袭等多种细胞过程[7]。Wang等[10]证实了过表达的miR-145可降低CD4+T细胞中NFATc1蛋白表达水平,从而影响Th17细胞表达。本研究同样观察到过表达miR-145可抑制CD4+T细胞中NFATc1的mRNA水平,同时Th9细胞的分化和细胞因子分泌也受到了抑制,因此推测miR-145通过抑制CD4+T细胞的NFATc1从而影响Th9细胞分化。同时,本研究观察到过表达miR-145可影响Th9细胞Smad3的mRNA表达。Megiorni等[19]结果表明Smad3是 miR-145的潜在靶基因,miR-145可负调控Smad3的表达。Liu等[20]发现在HK-2 细胞中miR-145 可抑制TGF-β依赖的Smad 信号通路活性。因此,miR-145是否通过影响TGF-β/Smad信号通路而影响Th9细胞分化尚不清楚,今后将进一步研究miR-145影响 Th9分化的具体机制。
综上所述,本研究显示上调miR-145可抑制Th9细胞分化和IL-9分泌水平。
