氟西汀对抑郁症模型小鼠Treg细胞的影响①
2021-01-26马博乙吴玉婷张博文曹雅明
马博乙 张 静 吴玉婷 张博文 曹雅明 李 成
(中国医科大学免疫学教研室,沈阳 110000)
抑郁症是临床上常见的精神障碍性疾病之一,其发病率高,流行病学统计显示抑郁症在我国发病率高达5%。抑郁症具体的发病机制仍然不是非常明确。最近,关于抑郁症与免疫之间的相关研究有了突飞猛进的发展。有人提出抑郁症可能是由细胞因子分泌引起的免疫系统改变,并且已经在抑郁患者中观察到T辅助(Th)细胞和相关细胞因子的变化,例如血浆中IFN-γ增加,CD4/CD8比率增加和淋巴细胞对有丝分裂原的增殖反应降低等[1]。此外在抑郁症患者中发现Th1/Th2细胞因子的比例更加偏向Th1细胞因子;血浆IFN-γ/IL-4比例(Th1/Th2比率)水平均较高[2]。然而,也有研究表明,抑郁症患者和对照组之间的外周血淋巴细胞和T淋巴细胞亚群的数量没有差异[3]。因此,CD4+T细胞在抑郁症中的确切表现和作用还有待研究。
目前临床上用于治疗单相抑郁症的药物主要为选择性五羟色胺再摄取抑制剂(selective serotonin reuptake inhibitor,SSRIs),代表药物是氟西汀。相关研究表明,氟西汀可减少丝裂原诱导的T淋巴细胞增殖[4]。另外,在正常小鼠中用氟西汀治疗4周后,发生T细胞介导的免疫增强[5]。所以T细胞在抑郁症发展中的作用以及T细胞和其亚群的状态仍有待确定。本实验通过目前已被广泛接受的慢性不可预知温和应激(chronic unpredictable mild stress,CUMS)法制备小鼠抑郁症模型,并选用氟西汀治疗,探讨氟西汀对抑郁症小鼠T细胞亚群及相关细胞因子的影响,为治疗抑郁症拓展新的思路。
1 材料与方法
1.1材料
1.1.1实验动物 健康雄性C57BL/6J小鼠,SPF级,8周龄,体质量20~24 g,购自沈阳艾科赛斯生物科技有限公司。
1.1.2试剂和仪器 氟西汀(Sigma公司);FoxP3等抗体(Bioss公司);酶标仪,流式细胞仪(Thermo公司);免疫组化试剂盒(UltraSensitive S-P超敏试剂盒)、DAB显色试剂盒(迈新生物技术有限公司)。
1.2方法
1.2.1CUMS抑郁模型建立 本实验采用CUMS建立抑郁模型[6,7]。将空笼17 h、斜笼45° 17 h、湿笼17 h、食物剥夺14 h、夜间光照12 h、热水游泳5 min、饮水剥夺16 h、夹尾5 min共8种刺激随机安排到28 d内,每日2种,同种刺激不连续出现,使小鼠不能预料刺激的发生。对照组正常饲养,未给予刺激。
1.2.2实验分组及给药方法 实验前适应性喂养1周,室内温湿度恒定,通风良好,自由进食。正常饲养,未给予刺激的小鼠为A组(每组6只):对照组。正常小鼠给予氟西汀注射(6只)为B组。CUMS建模结束后,将CUMS组小鼠分为2组(每组6只)分别为C组:CUMS模型组;D组:CUMS模型+氟西汀组。CUMS建模28 d后,A组和C组:给予生理盐水0.5 ml/d腹腔注射;B组和D组:每天给予氟西汀10 mg/kg溶于0.5 ml生理盐水中腹腔注射,治疗持续3周。
1.2.3行为学评价 建模开始前和建模结束后分别进行小鼠的行为学测定。①体质量测量:于8∶00进行小鼠体质量测量。②摄食实验:早上9∶00添加食物约20 g,次日9∶00称食物余量,同时称动物体质量,计算24 h摄食比[摄食比=(食物总量一食物余量)/体质量×100%]。③糖水偏好测试实验:该实验是用来检测抑郁模型中快感缺失的指标,快感缺乏是抑郁症患者的核心症状之一[8]。具体操作为:首先进行糖水适应的训练,前24 h每个鼠笼放置两瓶1%蔗糖水,24 h后将其中的一瓶换为纯水。适应之后进行测试:每笼各放置 1% 蔗糖溶液和纯水各一瓶,小鼠自由取水,禁食。12 h后测量剩余液体体积,记录蔗糖水、纯水及总液体消耗,计算糖水偏好。糖水偏好百分比(%)=糖水消耗量/液体总消耗量×100%。
1.2.4样品采集 给药结束后,每组取3只小鼠取眼球血,室温自然凝固60 min,2 000 r/min离心20 min,仔细收集上清,-20℃保存备用。每组再取3只小鼠用3%水合氯醛腹腔注射麻醉,暴露心脏,以等渗生理盐水经左心室灌注冲洗后,用4%多聚甲醛溶液灌注,结束后取脾脏,置于4%多聚甲醛溶液中备用。
1.2.5流式细胞术 检测脾组织中调节T细胞(regulatory cells,Treg)的活化作用,选取脾细胞1×107个放入含有50 ng/ml PMA和1 mmol/L ionomycin的24孔板在5% CO2,37℃条件下刺激6 h,并加入Golgi stop reagent(2 μmol/L)用以封闭细胞因子的分泌。Tregs细胞标记选取(CD4+CD25+Foxp+Treg细胞),细胞培养之后,取所有脾细胞先进行FITC-anti-CD4和PerCP-anti-CD25细胞膜表面染色,在固定和透膜后用APC-anti-Foxp3抗体进行细胞内染色,其固定及透膜方法如上所述。染色结束细胞PBS洗涤后重悬4℃保存,待流式细胞仪检测。所有染色细胞用FACSCalibur流式细胞仪进行分析,各组均设抗体单标记及阴性对照,细胞检测数为1×105个。用FlowJo软件进行数据分析。
1.2.6免疫组化 取固定结束的脾脏组织制作蜡块及切片(厚度5 μm),常规脱蜡脱水,免疫组化染色采用UltraSensitive S-P超敏试剂盒,DAB显色,脱水封片。数据处理采用Image-Pro-Plus 6.0分别计数阳性细胞比例。

2 结果
2.1行为学评价 应激前(实验第0天)CUMS组小鼠体质量、摄食比、糖水偏好与对照组均无明显差异(P>0.05),应激后CUMS组的体质量、摄食比、糖水偏好均明显低于未进行应激实验的对照组(第28天),差异具有统计学意义(P<0.05),说明CUMS抑郁建模成功,如表1。
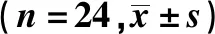
表1 实验第0天及第28天对照组与CUMS建模组小鼠体质量、摄食比、糖水偏好测定Tab.1 Body weight,food consumption ratio and sucrose preference stress in control group and CUMS model group were measured at 0 day and 28
2.2CUMS模型组及氟西汀治疗组脾脏形态学改变 脾组织HE染色发现CUMS组脾组织结构发生明显改变脾脏白髓萎缩,脾索结构不清晰,脾小梁断裂,如图1。

图1 HE染色Fig.1 HE stainingNote:*.White pulp.
2.3免疫组织化学技术检测Treg细胞亚群变化 免疫组化结果显示,CUMS模型组Foxp3阳性率明显高于CUMS+氟西汀治疗组和对照组(P<0.05);CUMS+氟西汀治疗组Foxp3阳性率略高于对照组;正常鼠给予氟西汀治疗后Foxp3阳性率比对照组明显增加(P<0.05),如图2、表2。

表2 脾脏免疫组化Foxp3阳性率细胞百分比Tab.2 Percentage of positive cells positive for Foxp3 in

图2 CUMS抑郁症模型组、氟西汀治疗组及对照组Foxp3免疫组化染色Fig.2 CUMS depression model,fluoxetine-treated group and control group Foxp3 immunohistoche-mical stainingNote:A.Control+fluoxetine-treated;B.Control group;C.CUMS+fluoxetine-treated group;D.CUMS group.
2.4流式细胞术检测检测Treg细胞数量 流式细胞术实验结果显示,CUMS组小鼠与对照组相比Treg细胞占CD4+T细胞百分比无显著差异(P>0.05);而CUMS+氟西汀治疗组明显低于对照组,差异具有统计学意义(P<0.05),如表3及图3。
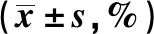
表3 脾脏中Treg细胞数量占CD4+T细胞百分比Tab.3 Number of Treg cells in the spleen accounts for percentage of CD4+T
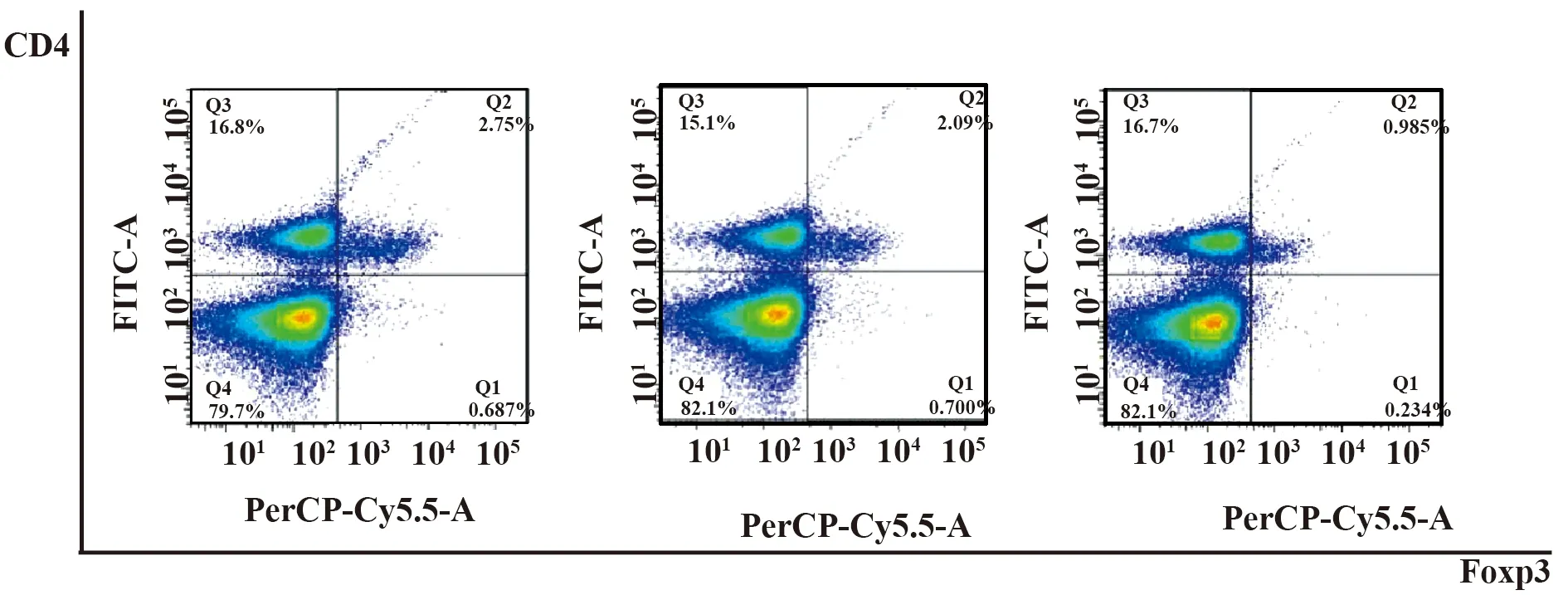
图3 CUMS抑郁症模型组及氟西汀治疗组 Treg细胞亚群的改变Fig.3 Changes of subpopulation of Treg cells in CUMS depression model group and fluoxetine-treated group
3 讨论
T细胞是体内发挥免疫功能的关键免疫细胞,根据其表面分子表达不同,可以分为CD4+T细胞和CD8+T细胞,其中CD4+T细胞主要发挥辅助和调节功能,故也称为辅助性T细胞,可分为不同的亚群,如Th1、Th2、Th17 和Treg等。之前有研究表明,轻度的应激会激活Th2细胞,相反,长期反复的刺激压力会激活Th1细胞[9]。近年来,Th17和Treg细胞之间的平衡受到了越来越多的关注。Th17细胞可以促进小鼠的自身免疫,并且与人类炎症性疾病的发病机制有关,而Tregs控制由正常菌群引发的免疫反应和炎症[10]。有研究表明,在CUMS诱导的抑郁症模型小鼠体内Th17及Treg细胞亚群发生改变,但该研究没有继续研究CUMS小鼠使用抗抑郁药物后的T细胞亚群的变化[11]。Tregs,也称为抑制性T细胞(CD4+CD25+Foxp3+Tregs),可抑制过度的免疫应答并介导免疫耐受。
在本实验中,使用CUMS法诱导抑郁症的小鼠模型并使用氟西汀对其进行治疗,小鼠的体重及糖水偏好实验证实CUMS法诱导抑郁症模型有效。氟西汀治疗小鼠与正常小鼠行为学评价发现,治疗小鼠的糖水偏好没有差异即快感消失症状有改善。
HE染色观察脾脏形态发现CUMS组小鼠脾脏结构发生明显改变,白髓萎缩,脾索结构不清晰,脾小梁断裂。猜测免疫器官正常形态和功能的改变是造成重度抑郁症患者免疫力下降的重要原因。免疫组化结果显示:CUMS+氟西汀治疗组和对照组Foxp3阳性率均明显低于CUMS模型组;正常鼠给予氟西汀治疗后Foxp3阳性率比对照组明显增加,猜测抑郁症发生过程中小鼠免疫应答处于抑制状态,可以解释情绪低落时人疾病易感性增强,而在氟西汀治疗后这种抑制状态被打破。流式细胞术发现,CUMS组小鼠与对照鼠相比Treg细胞占CD4+T细胞百分比无显著差异(P>0.05);而CUMS+氟西汀治疗组明显低于对照组,差异具有统计学意义(P<0.05),文献报道,在CUMS的后期阶段,CD3+CD8-IL-17+的Th17细胞的比例显著降低[12]。同时,在Treg特异性转录因子Foxp3 mRNA的检测中发现其表达含量升高,尤其在第14天发生了显著增加。提示Tregs可能是参与抑郁症免疫抑制的关键细胞类型。但在该文献中,CUMS第21天时抑郁症模型组与对照组Treg细胞百分比与对照组无明显差异,提示Treg细胞在抑郁症模型组发挥功能具有时间限制性。结合本实验的结果,表明 Treg细胞除了受时间限制外,也很大程度上受到氟西汀治疗的影响。此外,还发现给予正常小鼠氟西汀后小鼠脾脏中的Treg细胞明显增加,可能是由于Foxp3不仅仅表达在Treg细胞中造成阳性率有增高,还可能氟西汀增强免疫后小鼠体内CD4+免疫细胞总数有明显增加所致[13,14]。
综上所述,在小鼠CUMS抑郁模型中,行为学的改变可能与Treg细胞的比例失调相关。这些发现为Treg细胞在抑郁症中的作用提供了新角度,并且为抑郁症的治疗提供了新靶点。研究T细胞亚群与神经因子之间的关系将有助于理解免疫细胞在抑郁症中发挥的作用。
