表面活性剂与多孔介质复配对甲烷水合物生成的影响
2021-01-23马贵阳黄仙智
王 平,马贵阳,黄仙智
(辽宁石油化工大学 石油天然气工程学院,辽宁 抚顺 113001)
天然气水合物是气体分子和水分子在低温高压条件下通过范德华力和氢键的作用而形成的类冰的、非化学计量的笼形化合物[1]。 水合物可燃烧,外观又类雪状,亦可称为“可燃冰”。 气体主要成分为甲烷(CH4),当甲烷纯度超过99%时,也可称为甲烷水合物[2]。
水合物主要分布于深海沉积层或陆域永冻土中, 采用多孔介质更能真实地模拟自然环境中水合物的生成情况。 多孔介质的加入不仅会给水合物提供更多的成核位点, 还会将生成水合物时所放的热及时导出,提高传热过程。 表面活性剂的加入,会降低溶液的表面张力,增强气-液两相传质过程,促进水合物的生成。 目前,众多学者对表面活性剂促进甲烷水合物作出大量研究, 但对表面活性剂与多孔介质复配体系促进甲烷水合物鲜有报道[2]。为此,本工作研究在300 mg/L十二烷基硫酸钠(SDS)与1200 mg/L烷基多糖苷(APG1214)的复配溶液中加入不同粒径的氧化铝、磁沙(Fe3O4)和二氧化硅颗粒下甲烷水合物生成的情况,为日后类似研究提供参考。
1 实验部分
1.1 实验材料
实验所用材料如表1所示。
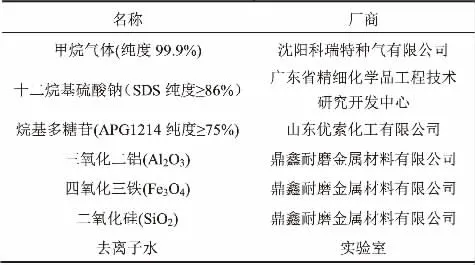
表1 实验所用材料
1.2 实验装置及方法
本实验采用KDSD-Ⅱ型水合物动力学实验装置,本装置有进气系统、反应釜装置、温压控制系统、数据采集系统,流程简图如图1所示。 天然气水合物的生成在如图所示的高压反应釜中进行,材质为不锈钢,有效容积为350 mL,最高承受压力可达25 MPa,工作温度范围-10~90 ℃。 反应釜温度由水浴控制,误差为0.1 ℃。 水浴温度由两个Pt100/φ3 mm铂电阻传感器测量,误差为0.2 ℃;实验压力由平衡釜控制,压力传感器测量,误差为0.01 MPa。

图1 KDSD-Ⅱ型水合物动力学实验装置
本实验操作方法如下:
(1)采用去离子水反复冲洗反应釜并进行擦拭、干燥,再利用氮气反复吹扫,排出多余空气与杂质避免影响实验数据,再将反应釜抽成真空,放入水浴中,检查其气密性。
(2)分别称取30 mL的不同粒径(40 目、80 目、150 目) 的Al2O3、Fe3O4、SiO2颗粒并将其放入反应釜中。
(3)打开进液阀,将已配制好70 mL的SDS与APG1214复配溶液注入到反应釜中。
(4)当水浴温度降至2 ℃时,将反应釜置于恒温水浴内,然后打开进气阀通入甲烷气体,当压力达6 MPa时停止。 利用数据采集系统记录反应釜内压力的变化,当反应釜压力在120 min内保持不变或有微小变化时,停止实验和记录数据并观察实验现象。
1.3 数据处理
通常以一定条件下的储气密度或含气率(Vg/Vw)来表示天然气水合物的储气能力,其公式如下:
(1)气体消耗量计算公式[3]:
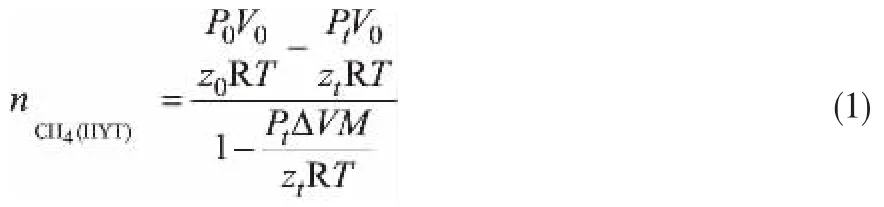
式中,P0和Pt分别为初始时刻压强和在t时刻压强,Pa;V0为实验初始气体体积,m3;Tt=275.15 K为实验温度,全程保持不变;Z0和Zt分别为实验初始和在时刻的气体压缩因子,通过Soave-Redlich-Kwong方程迭代求得天然气的压缩因子,R为气体常数,8.314 J/(mol·K);M为水合数,6.1。
(2)储气密度计算公式[3]:
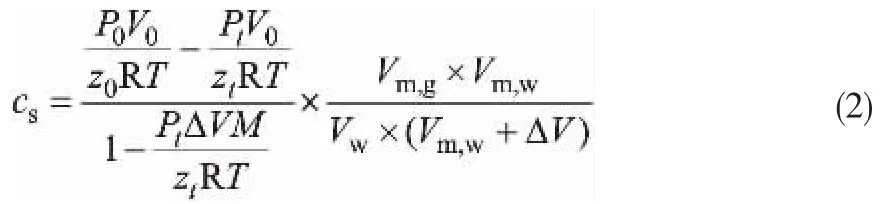
式中,Vm,g和Vm,w分别表示为气体和水的摩尔体积,m3/mol;Vw为水的体积m3;△V表示水合物与水的摩尔体积差,m3/mol。
2 结果与讨论
2.1 不同多孔介质对水合物生成的影响
孙志高等[4]在研究SDS溶液对甲烷水合物储气特性时,发现SDS溶液临界胶束浓度为300 mg/L,王海秀等[5]研究表明APG溶液在1200 mg/L时对天然气水合物促进效果最强。 因此,本实验选择此两种浓度的溶液复配。 图2(a)和图2(b)分别是不同粒径氧化铝颗粒中生成水合物压降曲线和储气密度曲线。 由图可知,40 目的Al2O3在近70 min时反应近似停止,压降变化并不大,剩余压力为5 MPa,储气密度仅为43.5。 80目和150 目的Al2O3对水合物的作用近似相同,反应时间为600 min时,剩余压力分别为3.25和3.20 MPa, 储气密度为103.3和105。 因此可得出:Al2O3颗粒粒径越小(即目数越大),对天然气水合物的促进效果越强,储气能力也增加。 这是因为Al2O3颗粒本身就是一种多孔材料,其内部和表面存在大量细孔,对天然气和表面活性剂溶液有很大吸附作用,并且粒径越小,吸附能力越强。 这也可得出,在Al2O3颗粒中生成水合物的气体消耗来自两方面,一是甲烷气体往笼形结构中的填充;另一种是Al2O3颗粒对气体的吸附。 所以,采用多孔材料提高甲烷水合物的储气量是一个良好方法[6]。
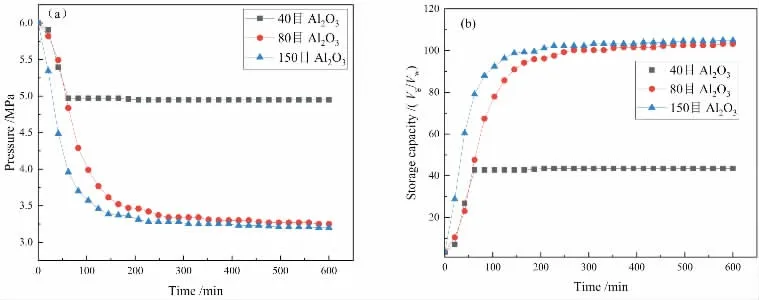
图2 不同粒径氧化铝颗粒中生成水合物压降曲线(a)和储气密度曲线(b)
图3(a)和图3(b)分别是不同粒径Fe3O4颗粒中生成水合物压降曲线和储气密度曲线。 由图3可知40目Fe3O4颗粒在75 min时反应停止, 剩余压力为4.58 MPa,储气密度为57.0。 80目Fe3O4颗粒和150 目Fe3O4颗粒压降曲线近似重合, 反应时间为600 min时, 剩余压力分别为3.25和3.22 MPa, 储气密度为103.3和104.3。 由此可得:随着粒径的减小,Fe3O4颗粒对天然气水合物的储气密度增大。 虽然三种粒径的颗粒都不溶于水, 但在溶液中均会产生水解、极化和水合等反应,使其表面带有电荷[7],而且粒径越小,产生的电荷也越多,对甲烷气体和表面活性分子的吸附能力也越强,越能促进水合物的生成。

图3 不同粒径四氧化三铁颗粒中生成水合物压降曲线(a)和储气密度曲线(b)

图4 不同粒径二氧化硅颗粒中生成水合物压降曲线(a)和储气密度曲线(b)
图4(a)和图4(b)分别为不同粒径二氧化硅颗粒中生成水合物压降曲线和储气密度曲线。 由图可知,粒径为80 目时对水合物促进效果最好,储气密度最大达到104.3。 可见虽然40 目颗粒的储气密度与80 目时近似相等, 但诱导时间增长了200 min。150 目颗粒时,曲线斜率变化小,压降变化不明显,在200 min时结束反应,剩余压力和储气密度分别为5.02 MPa和40.9。 分析其原因:40 目时考虑“固封”现象的存在,导致生成量和储气密度的降低。 80 目和150 目时对水合物都起到了促进作用, 是因为二氧化硅颗粒表面含有羟基[8],与水分子结合易形成氢键,能够加速水合物笼形结构的产生,从而促进水合物的生成。
综合上述图像分析可知, 只有在采用SiO2颗粒时出现了诱导时间,根据前文提到的氧化铝颗粒为多孔材料, 对气体和表面活性剂溶液存在吸附作用,会加速甲烷在溶液中的溶解,大大缩短诱导时间。 四氧化三铁颗粒因本身具有磁性,进而形成磁场,在磁场作用下会显著缩短诱导时间[9]。 而二氧化硅为实心颗粒,表面不具有微孔,因此,对气体不具有吸附性, 不会改变气体的溶解度和诱导时间。Kashchiev等[10]认为,在液相表面张力一定时,生成水合物所做的功与接触基质表面润湿角成正比。 本实验选用的三种颗粒均具有良好的亲水性,亲水性越强,润湿角越小,水合物成核所做的功越小,因而会促进水合物的生成。
不同实验条件下水合物储气密度如表2所示。可以看出加入多孔介质后与只使用表面活性剂时的储气密度相差不大。 分析其原因:由于本实验选用的多孔介质粒径单位为目级,对应微米级,其密度大于水且不溶,因此在反应釜静置一段时间后就会沉入底部,这样随着水合物的逐渐生成,会在表面活性剂溶液与多孔介质界面生成一层致密的水合物膜,造成了“固封”现象,气体进不到底层的多孔介质内,因此就大大减少了可供水合物成核的位点,导致生成量和储气密度降低。

表2 不同实验条件下水合物的储气密度
2.2 多孔介质与表面活性剂复配体系中水合物生成机理分析
图5为氧化铝、四氧化三铁、二氧化硅颗粒中生成水合物的具体形态,为了方便清理,在反应釜中加入PET杯。 可见水合物和多孔介质层有明显的分层,剔除水合物后,发现多孔介质层中只有微量水合物,这就验证了“固封”现象的存在。 但分层的位置各不相同,由于实验初始,投入多孔介质体积都相同,考虑为拆卸反应釜时释放剩余压强时导致的多孔介质体积的膨胀现象。 可见其都贴壁生成,一方面是因为反应釜都置于水浴中,PET杯壁面温度较低,温度越低,越有利于水合物的生成。 另一方面,Feklistov[11]认为是表面活性剂使液相的表面张力降低, 会阻止已生成的水合物聚结在气液界面上。 况且此时液相表面张力低于PET杯壁的表面张力,因此生成的水合物不会向内聚集,而是向周围的壁面聚集,因此产生贴壁现象。

图5 多孔介质内水合物生成形态
在表面活性剂溶液中,液相的表面分子受到横向力和纵向力,其横向力为周围其他液体分子与之间的范德华力,其合力为零[12]。 在纵向,表面分子受液相和气相分子的吸引力,方向相反,显然液相的吸引力要大于气相的吸引力,因两侧受力不平衡导致表面张力的产生。 由于表面张力的存在,使甲烷气体在溶液中溶解度较小,这是水合物不能快速生成的主因。
SDS是带有亲水基团和亲油基团的阴离子表面活性剂,可发生电离,电离出Na+和带有负电的活性基团。 溶液中加入SDS后,亲水基与溶液接触,受到水分子向下的吸引力,但由于亲水基极性弱于水分子, 使得这种吸引力远远小于液相分子间的吸引力。 亲油基与甲烷气体接触,受到气体分子向上的吸引力, 此吸引力要大于甲烷气体对纯水的引力,是由于亲油基的相对体积较大,与甲烷气体接触更充分。 总的来说,向下的引力减弱,向上的引力上升,改变了气液两相受力不平衡的现象,降低了溶液的表面张力。 随着表面张力的下降,气相和液相之间的传质过程得到增强, 促进了水合物的生长。与此同时,亲油基会黏附甲烷气体分子,这些分子通过布朗运动进入液相,也增大了甲烷气体在溶液中的溶解度,为水合物生成创造有利条件。 APG溶液为非离子表面活性剂,在溶液中不会电离,但是会在固—液界面发生吸附现象[13],这也是水合物贴壁生成的原因之一。 SDS与APG有良好的配伍性,因此复配时,混合溶液的表面活性会提高,临界胶束浓度及表面张力会降低[14]。 况且复配溶液的最低表面张力比单一组分的还要低[15]。 因此表现为全面增效作用,促进水合物的生成。 多孔介质的加入为水合物的生成提供更多的成核位点及异相成核的条件, 异相成核使天然气在溶液中更容易达到过饱和,缩短了诱导时间,提高了水合物的生成速率。
3 结论
本实验研究了在300 mg/L SDS 与1200 mg/L APG复配溶液中加入不同粒径多孔介质对天然气水合物的影响,并分析其机理,得出以下结论:
(1)在复配溶液中加入Al2O3或Fe3O4颗粒,粒径为150目时, 储气密度达到最大。 Al2O3颗粒粒径越小,对气体的吸附能力越强,会促进水合物形成以及提高水合物储气密度。Fe3O4颗粒本身具有一定磁性,由于磁场的原因,缩短了其诱导时间,外加颗粒孔隙产生的毛细力作用导致水合物贴壁生成。 80目的SiO2颗粒为最佳粒径,储气密度可达104.3,本实验三种颗粒只有SiO2颗粒出现诱导时间, 因其为实心颗粒,不会对甲烷气体有吸附作用,并不会改变甲烷的溶解度。
(2)加入多孔介质后,由于“固封”的影响导致对水合物的储气密度影响不大。 但多孔介质的加入提供了更多的成核位点以及异相成核的条件,使气体在溶液中更容易达到过饱和,缩短水合物的诱导时间,提升水合物生成速率,促进水合物的生成。
符号说明
cs-储气密度,Vg/Vw;M-水合数,6.1;n-甲烷气体消耗量,mol;P-压力,MPa;R-气体常数,8.314 J/(mol·K);T-温度,K;Vm,g-气体摩尔体积,m3/mol;Vm,w-水摩尔体积,m3/mol; Vw-水的体积,m3;ΔV-水与水合物的摩尔体积差,m3/mol;z-压缩因子。
