阻塞性睡眠呼吸暂停低通气综合征患者血清miR-223、IL-18水平变化及临床意义
2021-01-22高东艳刘维英董娜
高东艳 ,刘维英 ,董娜
1 兰州大学第一临床医学院,兰州730000;2 兰州大学第一医院
阻塞性睡眠呼吸暂停低通气综合征(OSAHS)是一种慢性缺氧性疾病,其主要由上呼吸道反复阻塞引发患者夜间间断性缺氧和(或)睡眠呼吸暂停,导致患者精神萎靡、头痛及注意力不集中,严重影响患者的神经系统功能,还增加血流动力学和心血管疾病的风险,已成为当前重大的公共卫生问题[1]。OSAHS 患者睡眠呼吸障碍—反复缺氧的过程与缺血—再灌注损伤类似,启动过程中引发氧化应激反应,并释放白细胞介素、肿瘤坏死因子等炎性介质加速病情进展[2]。血液中微小 RNA-223(miR-223)含量丰富,有研究证实其可降低循环血液中单核细胞、巨噬细胞的活性,进而抑制炎性因子的释放[3]。白细胞介素18(IL-18)是机体炎性介质之一,其可诱导淋巴细胞、巨噬细胞等炎性细胞释放干扰素及肿瘤坏死因子,进而加重炎性损伤[4]。OSAHS 的发生、进展与炎性反应密切相关,miR-223、IL-18 可能参与其中,但具体机制尚不清楚。因此,本研究观察了 OSAHS 患者血清 miR-223、IL-18 水平变化,并探讨其临床意义,以期为疾病的诊疗提供帮助。
1 资料与方法
1.1 临床资料 选取 2018 年 11 月—2019 年 12 月于我院就诊的OSAHS 患者80 例作为研究对象(OSAHS组)。纳入标准:OSAHS的诊断符合中华医学会呼吸病学分会睡眠呼吸障碍组制定的《阻塞性睡眠呼吸暂停低通气综合征诊治指南》中的相关标准[5];年龄≥18 周岁;临床资料完整,自愿进入本研究。排除标准:近7天内有急性呼吸系统感染病史;先天性肺发育不良;其他类型睡眠障碍性疾病;既往有耳鼻喉手术或气道正压治疗史;严重的心、肺、肝、肾等重要器官功能障碍;恶性肿瘤、凝血功能障碍及免疫系统疾病。另选取同期门诊体检的健康者46例作为对照组(CON 组)。本研究已获得我院伦理委员会批准,所有研究对象签署知情同意书。
1.2 相关资料收集 收集并记录入组对象的基本资料,包括年龄、性别、BMI。使用Alice LE多导睡眠检测仪(维康公司,美国)对所有入组对象进行睡眠监测(夜间21:00 至次日7:00),由专业睡眠呼吸科医师对监测结果进行计算读取,包括:睡眠呼吸暂停低通气指数(AHI)、夜间最低氧饱和度(LSpO2)、氧饱和度低于90%时间占睡眠时间百分比(Ts90%)。根据AHI 对OSAHS 患者进行病情程度分级,AHI≤10次/小时为轻度、10
1.3 血清miR-223、IL-18 检测 采集OSAHS 组入院当日、CON 组体检当日空腹静脉血10 mL,以3 000 r/min 离心 15 min(离心半径 14.5 cm),置于-80 ℃冷藏器中备用。①严格按照检测试剂盒操作说明,使用双抗体酶联免疫吸附法检测血清中的IL-18,检测试剂盒购于BIM 公司(美国)。②使用荧光定量聚合酶链反应检测血清中的miR-223。按照总miRNA 快速提取试剂盒操作说明提取总miRNA;按照逆转录反应体系操作说明,进行逆转录反应,反应条件:16 ℃ 30 min、42 ℃ 30 min、85 ℃ 5 min、4 ℃保存;按照扩增说明进行逆转录产物扩增,反应条件:95 ℃ 10 min,95 ℃ 15 s、60 ℃ 60 s 进行40个循环,实验重复3次。逆转录试剂盒购于TaKaRa公司(日本),引物由生工生物工程(上海)股份有限公司提供,miR-223 引物上游序列:5"-CAGAAAGCCCAATTC⁃CATCT-3"、下 游 序 列 :5"-GGGCAAATGGATAC⁃CATCC-3"。以 U6RNA 为内参,以 2-ΔΔCt法计算 miR-223 的相对表达量。③使用AU-5800 全自动生化检测仪(贝克库尔曼特公司,美国)检测其他生化指标:HDL、TG、LDL、TC。
1.4 统计学方法 采用SPSS23.0 统计软件。计量资料符合正态分布使用±s表示,两组比较使用独立样本t检验,多组比较使用单因素方差分析,进一步比较采用LSD-t检验;计数资料组间比较采用χ2检验。采用Logistic 回归分析血清miR-223、IL-18 水平与OSAHS 的关系,使用受试者工作特征(ROC)曲线评估血清miR-223、IL-18水平诊断OSAHS的价值。P<0.05为差异有统计学意义。
2 结果
2.1 两组睡眠监测通气及血生化等指标比较 OSAHS组男49例、女31例,年龄31~58(45.33±10.29)岁;CON组男30例、女16例,年龄32~60(43.64±9.27)岁;两组年龄、性别比较差异均无统计学意义。OSAHS组BMI、AHI、Ts90%高于CON组,而LSpO2低于CON组(P均<0.05),详见表1。
表1 两组睡眠监测通气及血生化等指标比较(±s)
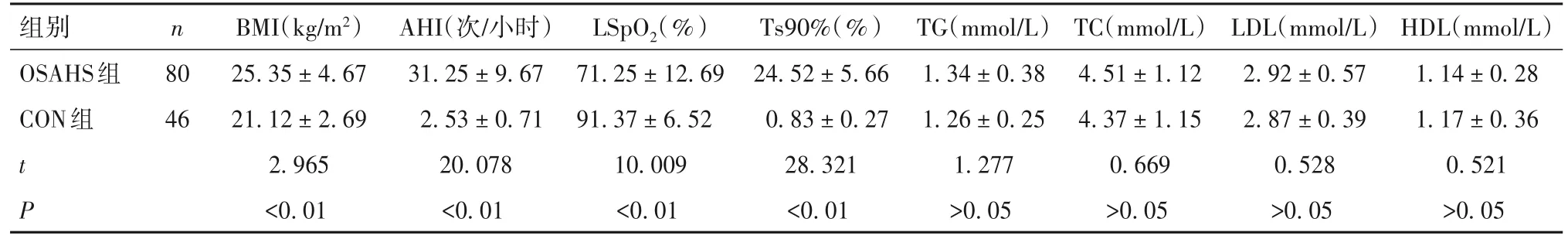
表1 两组睡眠监测通气及血生化等指标比较(±s)
组别OSAHS组CON组t P n 80 46 BMI(kg/m2)25.35±4.67 21.12±2.69 2.965<0.01 AHI(次/小时)31.25±9.67 2.53±0.71 20.078<0.01 LSpO2(%)71.25±12.69 91.37±6.52 10.009<0.01 Ts90%(%)24.52±5.66 0.83±0.27 28.321<0.01 TG(mmol/L)1.34±0.38 1.26±0.25 1.277>0.05 TC(mmol/L)4.51±1.12 4.37±1.15 0.669>0.05 LDL(mmol/L)2.92±0.57 2.87±0.39 0.528>0.05 HDL(mmol/L)1.14±0.28 1.17±0.36 0.521>0.05
2.2 两组血清miR-223、IL-18 水平比较 OSAHS组患者血清IL-18水平高于CON组,而miR-223水平低于CON组(P均<0.05),见表2。
表2 两组血清miR-223、IL-18水平比较(±s)

表2 两组血清miR-223、IL-18水平比较(±s)
组别OSAHS组CON组t P n 80 46 miR-223相对表达量0.54±0.16 1.51±0.43 18.151<0.01 IL-18(pg/mL)61.81±15.52 47.52±10.62 5.539<0.01
2.3 不同病情程度OSAHS 患者血清miR-223、IL-18 水平比较 OSAHS 患者病情程度为轻度23 例、中度41 例、重度16 例。随着OSAHS 患者病情程度的加重,血清IL-18 水平逐渐升高,miR-223 水平逐渐降低(P均<0.05),详见表3。
2.4 血清miR-223、IL-18水平与OSAHS的关系多因素 Logistic 回归分析显示,IL-18(OR=1.853)、AHI(OR=1.828)、BMI(OR=1.719)是 OSAHS 的危险因素,miR-223(OR=0.569)是OSAHS 的保护因素(P均<0.05),详见表4。
2.5 血 清 miR-223、IL-18 水 平 诊断 OSAHS 的 价值 miR-223、IL-18 诊断 OSAHS 的 ROC 曲线下面积(AUC)分别为 0.801、0.767,二者联合诊断的AUC 为 0.861,高于 miR-223(Z=3.893,P<0.001)、IL-18(Z=4.052,P<0.001)任一单项指标,详见表5及图1。

表4 血清miR-223、IL-18水平与OSAHS的关系
表3 不同病情程度OSAHS患者血清miR-223、IL-18水平比较(±s)

表3 不同病情程度OSAHS患者血清miR-223、IL-18水平比较(±s)
注:与轻度相比,aP<0.05;与中度相比,bP<0.05。
病情程度轻度中度重度F P n 23 41 16 miR-223相对表达量0.78±0.25 0.51±0.17a 0.26±0.08ab 112.298<0.01 IL-18(pg/mL)56.29±11.54 61.47±12.43a 70.59±14.51ab 18.521<0.01

表5 血清miR-223、IL-18水平诊断OSAHS的价值
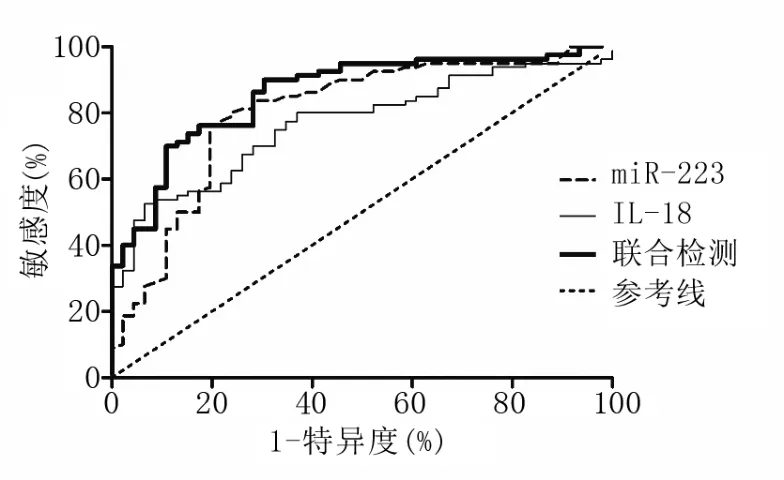
图1 miR-223、IL-18水平诊断OSAHS的ROC曲线
3 讨论
OSAHS 患者长期慢性间断性缺氧,易引发机体交感神经系统过度激活、胸腔压力改变等,不仅导致患者的生活质量下降,还会引发机体代谢紊乱,增加高血压、心竭、脑卒中等心脑血管疾病的发病风险,严重威胁患者的生命健康[6],因此其早期防治是临床的工作重心。本研究发现OSAHS 患者的BMI、AHI、Ts90%升高,LSpO2降低,提示患者夜间气道阻塞风险较高、缺氧严重,且可能与肥胖相关,进一步分析发现BMI、AHI是OSAHS发病的危险因素,这也与既往的研究[7-8]相符。肥胖患者体内脂肪沉积较多,呼吸道管壁结构较厚,通气受阻的风险增高[7]。AHI反映患者夜间气道受阻程度,其值越大,患者病情越严重。临床中对于肥胖患者,应积极进行夜间睡眠监测并有效干预,以防疾病的发生进展。目前,OSAHS 的早期预测缺乏有效的生物学指标,且发病机制尚不明确,鉴于其发病与炎症反应密切相关,现阶段炎症相关生物学指标是研究热点。
miRNA 是一类高度保守的内源性非编码RNA小分子,长18~22个核苷酸,其可通过与非编码区域的miRNA 调节元件结合,抑制靶mRNA 的翻译进而调控基因的转录,参与肿瘤、免疫炎症、心脑血管等疾病的发生[9]。miR-223 是 miRNA 成员之一,位于性染色体的q12基因组中,其可调节单核细胞、巨噬细胞的活性,进而调控炎性因子的释放,参与机体的免疫炎症反应[10]。冯梅等[11]研究发现,脓毒症患者血浆中的miR-223 是脓毒症诊断的有效生物学指标之一;郝晓炜等[12]研究证实,克罗恩病患者血清miR-223 的相对表达量与炎症反应状态密切相关;李琳等[13]观察到 OSAHS 患者外周血 miR-223 表达下降,且对患者病情程度具有较高的诊断价值;这些研究都提示miR-223 参与了机体多种炎性反应过程。miR-223 与机体免疫系统—炎症反应及感染关系密切,一项基础研究[14]发现,给予脂多糖刺激后的鼠巨核细胞中miR-223 表达受到明显抑制,此抑制作用削弱了STAT3 介导的促炎作用。NLRP3 是miR-223 的靶基因之一,其可促进炎性小体IL-1b 的释放。有研究[15]显示,EB 病毒中的 miR-223 可与NLRP3 碳端非编码区结合,导致炎性小体的产生。炎性小体是细胞应激反应的传感器之一,其可促进细胞对应激的过度反应,加速组织损伤及炎性反应。miR-223 通过抑制NLRP3 活性,进而降低炎性小体的产生,发挥机体应激及炎症反应的变阻器作用[16]。据此,笔者推测 miR-223 通过抑制 STAT3、NLRP3 信号通路活性,参与OSAHS、脓毒症等炎性疾病的发生、进展。
IL-18是近年来新发现的一种细胞因子,其主要由单核细胞和巨噬细胞分泌,是一种具有多向效应性的促炎因子[17]。IL-18 主要与其受体 IL-18R 相结合发挥生物学作用。中性粒细胞表面含有丰富的IL-18R,其与IL-18 结合后形态发生改变,进而被激活并定向游走至反应部位,释放蛋白水解酶、氧化代谢产物、花生四烯酸衍生物等一类列炎性物质,加重机体局部炎性反应,在发挥杀菌的同时,也损伤了正常细胞[18]。此外,IL-18 对嗜酸性粒细胞、嗜碱性粒细胞及淋巴细胞具有一定的趋化激活作用,进而导致组织高反应性。IL-18 还可通过诱导AP-1、NF-κB及其他转录基因表达,进而促进IL-6、IL-8 等炎性因子的释放,加重组织损伤[19]。近年来,IL-18 与动脉粥样硬化、OSAHS 等疾病的研究较多,但具体影响机制尚未阐明,本研究推测IL-18主要通过促进机体各类炎性因子的表达参与其中。
本研究结果显示,OSAHS 患者血清miR-223 水平降低,IL-18 水平升高,且二者皆随患者病情严重程度的波动而相应降低或升高,说明二者皆可较好反映患者病情进展,进一步分析发现OSAHS 的发生与miR-223 水平的降低和IL-18 的升高有关,这也与既往的研究相呼应[13,18]。OSAHS 患者血清 miR-223水平降低,可能是其抑制STAT3、NLRP3信号通路活性,削弱机体炎性反应,发生消耗性降低所致;而IL-18 水平越高,气道炎性反应越重,OSAHS 的发病风险也越高。此外,miR-223、IL-18 诊断 OSAHS 的AUC 分别为 0.801、0.767,二者联合诊断的 AUC 为0.861,高于任一单项指标,这也进一步证实miR-223和IL-18均可作为诊断OSAHS的可靠指标,二者联合检测有利于患者的早期诊断,可指导临床采取有效干预措施延缓疾病进展。
综上所述,OSAHS 患者血清IL-18 水平升高,miR-223 水平降低,且二者可较好地反映患者病情,联合检测可为疾病的早期识别提供帮助。
