微波与超声处理对花青素-多酚固态与液态体系色泽的影响
2021-01-20毕金峰郭崇婷朱凤妹吴昕烨
徐 烨,李 旋,毕金峰,*,郭崇婷,3,朱凤妹,吴昕烨
(1.河北科技师范学院食品科技学院,河北 秦皇岛 066004;2.中国农业科学院农产品加工研究所,农业农村部农产品加工综合性重点实验室,北京 100193;3.沈阳农业大学食品学院,辽宁 沈阳 110866)
随着天然色素安全性高、呈色自然等特性的凸显,其市场需求量大幅度增加。天然植物色素不但具有良好的呈色特性,而且具有抗氧化、抑制炎性反应等活性,可以发挥保健、防病等功效[1]。植物中的天然色素主要有脂溶性色素与水溶性色素两类[2];脂溶性色素主要包括叶绿素、叶黄素与胡萝卜素等,水溶性色素主要包括花色苷类(又称花青素),具有典型的C6-C3-C6碳骨架结构,含有A、B两个苯甲酰环和含氧六元杂环[3]。自然界中游离态的花青素极少,一般以糖苷形式存在,且其中3位糖苷取代最为常见[3]。自然界已知有22 类花青素,而在食品中常出现的有矢车菊色素、天竺葵色素、飞燕草色素、芍药色素、锦葵色素和牵牛花色素6 类[4],其大部分对光、热、氧、金属离子等敏感,稳定性差,且在不同条件下含量组成存在显著差别,易降解为无色或者褐色的产物[5-6]。与此同时,花青素对pH值变化十分敏感,色调会随之发生变化[7]。
目前提高花青素体系稳定性的研究涉及共色作用、复合作用、载体包埋等方面。花青素的共色作用指溶液中的花青素与无色或颜色很浅的化合物形成分子间缔合作用,从而使花青素呈色加深、并且稳定的现象[8]。花青素与这些化合物的缔合体被称作共色素,这些化合物主要包括黄酮、酚酸、氨基酸、有机酸、生物碱、单宁等,甚至可以是花青素本身。共色作用存在多种机制,包括分子内或分子间相互缔合作用以及自缔合作用[9-10]。研究表明,采用不同物理方法处理(如超声波、微波和超高压等)可有效改变花青素与多酚的相互作用,显著提升其呈色稳定性[11-13]。
目前已有学者初步开展了特定条件下天然花青素共色作用机制及其稳定性的研究[14],但不同物理场处理条件下共色体系的表观色泽、光谱特性以及花青素含量变化等层面的研究还存在空白,并且液态和固态体系中花青素的呈色及其稳定性差异鲜见报道。本实验在前期研究的基础上,选择桑葚中的花青素提取物(主要花青素成分为矢车菊素-3-O-葡萄糖苷)和白桃多酚提取物调制形成的固态与液态体系分别进行微波和超声波处理,测定其表观色泽、光谱特性及呈色物质花青素含量的变化,研究多酚和花青素的共色作用在超声波和微波处理中对花青素-多酚共色体系稳定性的影响,为提升不同状态体系中花青素稳定性及稳定天然色素的进一步开发利用提供依据,同时也为白桃与桑葚复合再造型食品呈色特性提供一定的理论参考。
1 材料与方法
1.1 材料与试剂
白桃(品种‘美脆’)采购于北京平谷,采收时间为2019年6月,采收时为六、七成熟,挑选大小及颜色均一、表面无损伤、无病虫害的果实,采收后立即进行清洗,切半去核,液氮速冻后贮藏于-40 ℃冷库备用。桑葚(品种‘沙泥’)采购于北京平谷,采收时间为2019年6月,采收时挑选大小及颜色均一、表面无损伤、无病虫害的桑葚果实,采收后立即运回实验室贮藏于4 ℃冷库备用。
绿原酸、新绿原酸、儿茶素、矢车菊素-3-O-葡萄糖苷等标准品 上海源叶生物科技有限公司;福林-酚试剂美国Sigma公司;盐酸、乙酸钠、磷酸氢二钠、氯化钾、柠檬酸钠、无水乙醇、甲醇、无水碳酸钠、蔗糖(均为分析纯) 国药集团化学试剂有限公司;纤维素粉上海阿拉丁生化科技股份有限公司;甲醇、乙腈、乙酸(均为色谱级) 美国Thermo Fisher科技公司。
1.2 仪器与设备
DH9-9023A电热恒温鼓风干燥箱 上海精宏实验设备有限公司;PHS-3C pH计 上海精密科学仪器有限公司;RE52AA旋转蒸发器 上海亚荣生化仪器厂;UV-1800紫外-可见分光光度计 日本岛津公司;3K15冷冻离心机 美国Sigma公司;1525高效液相色谱仪 美国Waters公司;SB25-12DTN超声波清洗器 宁波新芝生物科技股份有限公司;超滤离心管 德国Merck-Millipore公司;真空冷冻干燥机 湖南四环有限公司;EM-GF668微波炉 合肥荣事达三洋电器股份有限公司;DT 400数控超声波反应器 北京弘祥隆生物技术股份有限公司;Color Quest XT分光测色仪 美国Hunterlab公司;Digieye 2.7电子眼 英国Verivide公司。
1.3 方法
1.3.1 样品处理
1.3.1.1 溶液的制备
白桃多酚溶液制备:将冷冻贮藏的鲜桃样品用料理机破碎成粉状,分别称取5 g鲜桃冻粉3 份,加入20 mL体积分数80%甲醇溶液,采用超声辅助提取,功率40 kHz、时间30 min(温度控制在40 ℃以下);重复提取3 次,合并所得提取液,4 ℃、9 800 r/min离心10 min,取上清液,旋转蒸发至干,用纯甲醇定容至50 mL,即得桃多酚提取液[15]。采用Folin-Ciocalteu法[16]测定其总酚含量,总酚含量以每升提取液中含有绿原酸的质量计(5.335 g/L)。于-40 ℃冻藏保存。
桑葚花青素溶液制备:取60 g桑葚冻干果粉3 份,分别加入360 mL酸化乙醇(体积分数0.3%盐酸-乙醇溶液),20 kHz超声30 min,4 ℃、4 900 r/min离心40 min,收集上清液。重复提取两次,合并上清液,旋蒸定容至500 mL,即得花青素提取液[17]。利用pH示差法[18-19]测定其总花青素含量,总花青素含量以每升提取液中含有矢车菊素-3-O-葡萄糖苷的质量计(8.560 g/L)。于-40 ℃避光冻藏保存。
磷酸氢二钠-柠檬酸缓冲液(pH 3.0):将4.11 mL 0.2 mol/L Na2HPO4与15.89 mL 0.1 mol/L柠檬酸混合制得pH 3.0的磷酸氢二钠-柠檬酸缓冲液。
花青素-多酚共色素溶液:参考Belén等[20]的方法作适当修改,取白桃多酚提取液(多酚质量浓度5.335 g/L,换算后浓度为0.015 mol/L)和桑葚花青素提取液(花青素质量浓度8.560 g/L,换算后浓度为0.019 mol/L)按照多酚与花青素物质的量比40∶1[21]混匀,并用磷酸氢二钠-柠檬酸缓冲液(pH 3.0)调节pH值至3.0。
1.3.1.2 超声及微波处理
固态样品和液态样品置于超声波反应器内,设定操作参数:频率40 kHz,时间分别为30、60、90、120、150、180 min。
固态样品和液态样品置于微波炉内,设定操作参数为:时间30 s,功率分别为30、90、180、270、360 W。
1.3.2 固态模拟体系建立
将制备的桑葚花青素与白桃多酚溶液按物质的量比40∶1混合均匀。将脱脂棉与纤维素粉以质量比1∶3混合,加入固态模拟体系总质量15%的蔗糖,按照固液比1∶10与花青素-多酚溶液混合并冻干(置于固定模具中预冻12 h后进行真空冷冻干燥处理[20]),制备成模拟体系用以分析多酚-花青素在固态体系中呈色状态及稳定性[22]。
1.3.3 花青素-多酚液态与固态体系色泽测定
利用Color Quest XT台式投射型分光测色仪测定样品溶液L*、a*、b*值;固态样品平铺在标准白板上,去除背景色干扰,用Digieye 2.7电子眼测定固态样品L*、a*、b*值。其中L*值表示亮度,其范围为0(黑)~100(白),a*值表示红绿度,+a*表示红色,b*值表示黄蓝度,+b*表示黄色[23]。每个样品测定9 次,计算平均值和标准偏差。
1.3.4 花青素-多酚液态与固态体系呈色组分的光谱特征
液态体系经微波和超声波处理后,取2 mL,超纯水稀释定容至10 mL混匀,取稀释样品2 mL于1 cm石英比色皿,置于紫外-可见分光光度计进行光谱扫描,波长范围为200~800 nm,固态体系经微波和超声波处理后,溶解于10 mL超纯水,于4 ℃、9 800 r/min离心10 min,取上清液,用超纯水稀释200 倍,紫外-可见分光光度计进行光谱扫描,波长范围为200~800 nm,绘制特征吸收光谱[24]。
1.3.5 酚类含量及组成成分分析
总酚含量的测定:含量测定参照Folin-Ciocalteu法[16],取绿原酸标准品0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8 mL至带盖离心管中,分别加入2.0、1.9、1.8、1.7、1.6、1.5、1.4、1.3、1.2 mL去离子水,摇匀;再加入1.0 mL体积分数10%福林-酚试剂,摇匀;加入2.0 mL质量分数4% Na2CO3溶液,用去离子水定容至10 mL,充分混匀后在35 ℃下水浴避光静置30 min,在765 nm波长处测定吸光度,以绿原酸为标准品绘制标准曲线,结果表示为每克干样品中所含绿原酸质量(mg/g)。
单酚含量的测定:参考Oliveira等[25]的方法并略作修改。取1.3.1.1节中多酚提取液过0.45 μm水系滤膜作为待测液。TC-C18色谱柱(4.6 mm×250 mm,5 μm)、柱温30 ℃、流速1 mL/min、进样量10 μL。洗脱程序调整为:A相为体积分数2%乙酸溶液,B相为甲醇(0 min,V(A)∶V(B)=95∶5;20 min,V(A)∶V(B)=75∶25;40 min,V(A)∶V(B)=60∶40;45 min,V(A)∶V(B)=75∶25;50 min,V(A)∶V(B)=95∶5;55 min,V(A)∶V(B)=95∶5)。采用外标法计算样品中单酚(绿原酸、新绿原酸、儿茶素、原儿茶酸)含量,结果表示为每毫升样品中所含单酚质量(mg/mL)。
总花青素含量的测定:参照pH示差法[18-19],取1.3.1.1节中花青素提取液,用pH 1.0 KCl-HCl缓冲溶液(V(KCl)∶V(HCl)=25∶67)和pH 4.5 NaAC-HAC缓冲液(18 g NaAC与9.8 mL HAC溶于1 L蒸馏水中制得)分别进行适当的稀释,平衡后在520 nm波长处测定吸光度,用700 nm波长处的吸光度校正模糊度[19,26]。总花青素含量以每升样品中含有矢车菊素-3-O-葡萄糖苷的质量表示,按下式计算。

式中:ΔA=(A520nm-A700nm)pH1.0-(A520nm-A700nm)pH4.5;Mw为摩尔质量(449.2 g/mol);DF为稀释倍数;b为矢车菊素-3-O-葡萄糖苷的摩尔吸光系数(26 900 L/(mol·cm))。
1.4 数据统计与分析
每组实验均重复3 次,数据以平均值±标准差表示。采用SPSS 21.0软件进行数据的方差分析,通过Duncan's法进行多重比较,P<0.05表示差异显著。采用SIMCA软件进行主成分分析(principal components analysis,PCA-X)和偏最小二乘判别分析(partial least squares discrimination analysis,PLS-DA),采用Origin 8.0与Excel软件绘图。
2 结果与分析
2.1 不同处理方式对花青素-多酚固态与液态体系的影响
2.1.1 不同功率微波处理对花青素-多酚固态和液态体系色泽的影响


图1 不同微波功率对花青素-多酚固态与液态体系色泽的影响Fig.1 Effect of microwave power on the color of anthocyanin-polyphenol solid and liquid systems
不同微波功率(30、90、180、270、360 W)处理的固态和液态花青素-多酚体系色泽差异如图1所示。经微波处理后花青素-多酚体系的L*值在固态体系中30 W后显著提高,在液态体系中90 W后显著升高;随着微波功率增大,花青素-多酚体系的L*值在固态与液态体系中均呈现先升高后降低的趋势,说明微波处理对花青素-多酚固态和液态体系L*值有提高作用,而功率不同对固态和液态花青素-多酚共色素L*值的影响有显著差异。经微波处理后花青素-多酚体系的a*值在固态和液态体系中均无显著变化,说明微波处理对固态和液态花青素-多酚体系的a*值无明显影响。经微波180~360 W处理后花青素-多酚共色素的b*值在固态体系中较30、90 W处理显著升高,在液态体系中180 W显著降低后升高,随着微波功率增加,固态和液态花青素-多酚体系的b*值均会降低并最终保持稳定,说明微波处理对花青素-多酚固态和液态体系b*值有降低作用,而不同功率对固态和液态花青素-多酚共色素b*值的影响有一定差异。综上所述,微波处理花青素-多酚固态体系L*值升高,b*值降低,a*值无明显变化,说明亮度增加、黄度降低,而实际体系表观色泽如图1D所示,经微波处理后固态体系颜色变浅,可能是在实际表观色泽中亮度固然增加,但黄度的降低对表观色泽的影响程度更大[20],使在固态体系中体现出颜色变浅这一现象,即在固态体系中表观色泽变浅。液态体系中微波功率在90 W以内时,共色体系的色差值没有显著改变,说明该频率微波处理引起的超高频电磁波使相邻分子间出现摩擦和碰撞,对改变液态体系中花青素-多酚所形成共色素的呈色稳定性有显著影响[27]。
2.1.2 不同时间超声处理对花青素-多酚固态和液态体系色泽的影响

图2 不同超声时间对固态与液态花青素-多酚体系色泽变化的影响Fig.2 Effect of ultrasonic treatment time on the color of solid and liquid anthocyanin-polyphenol systems
频率为40 kHz超声处理不同时间(30、60、90、120、150、180 min)的固态和液态花青素-多酚体系色泽差异如图2所示。经超声处理后花青素-多酚体系的L*值在固态体系中显著提高,随着超声时间的延长,花青素-多酚固态体系的L*值无显著变化,趋于稳定;在液态体系中超声90 min后显著升高随后下降然后再升高。经超声处理后花青素-多酚固态体系的a*值无显著变化,说明超声处理时间对固态花青素-多酚体系的a*值无明显影响。经超声处理后花青素-多酚固态体系的b*值显著降低,液态体系b*值在超声120 min时显著升高。综上所述,超声处理花青素-多酚固态体系L*值升高,b*值降低,a*值无变化,而实际体系表观色泽如图2D所示,经超声处理后固态体系颜色变浅,可能是在实际表观色泽中明度增加、黄度降低共同作用使在固态体系体现出颜色变浅这一现象[20]。在液态体系中超声90 min以上时,共色体系的L*值升高,a*值降低,b*值先升高后降低,说明超声处理引起的空化效应产生的巨大能量对液态体系中的花青素-多酚所形成的共色素的呈色稳定性有明显影响[28]。
2.2 不同处理方式对花青素-多酚体系吸收光谱的影响
2.2.1 不同功率微波处理对花青素-多酚固态与液态体系吸收光谱的影响
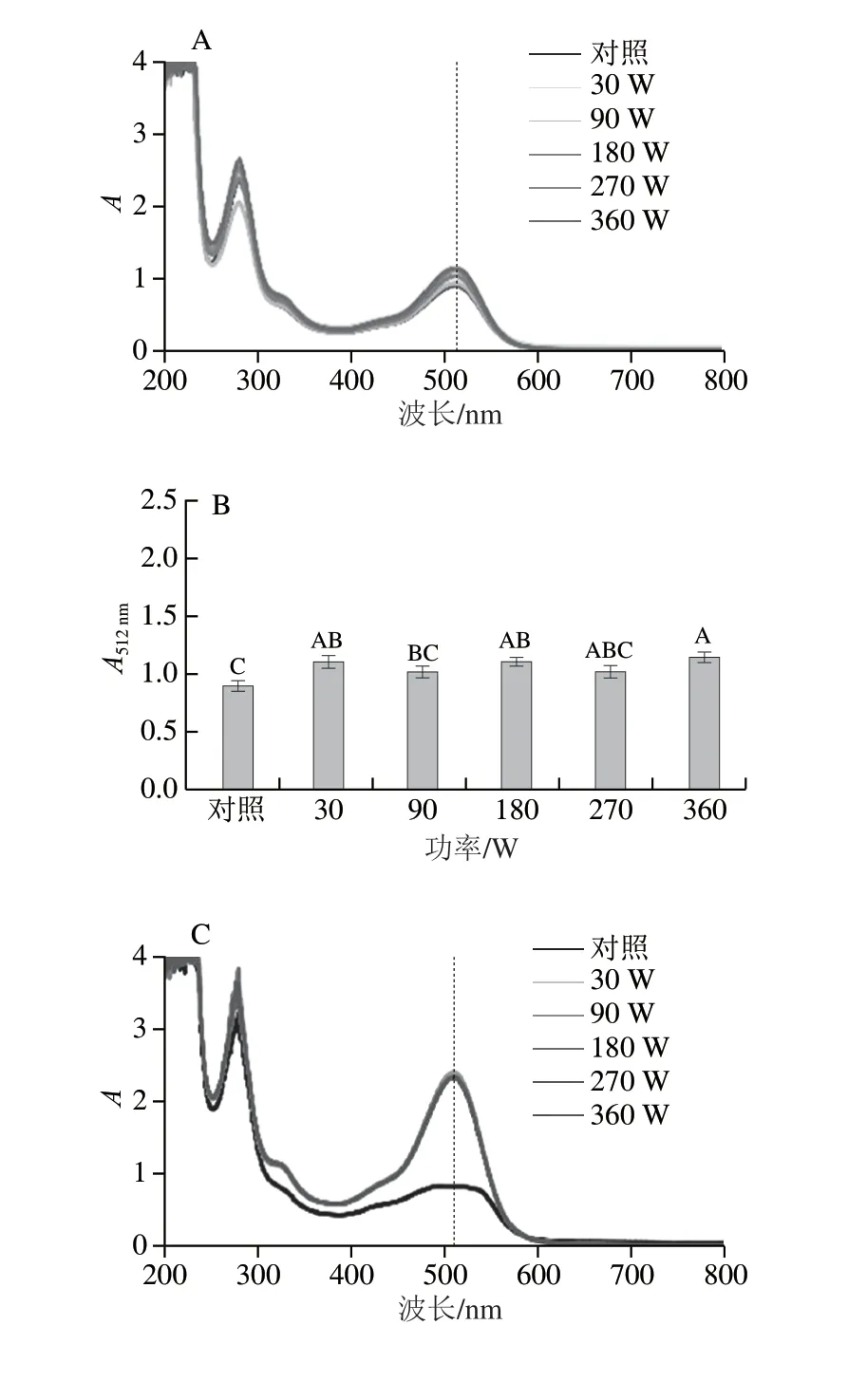
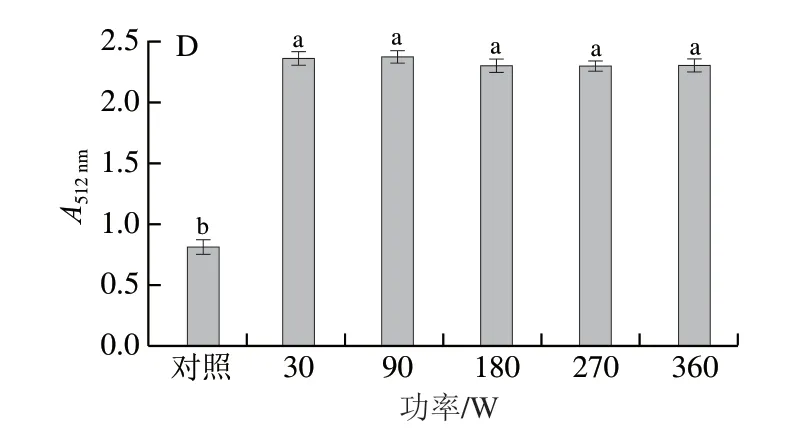
图3 不同微波功率对花青素-多酚固态与液态体系紫外-可见吸收光谱及其在最大波长处吸光度的影响Fig.3 Effect of microwave power on the UV-visible absorption spectra of anthocyanin-polyphenol solid and liquid systems and their absorbance values at the maximum absorption wavelength
不同功率微波(30、90、180、270、360 W)处理30 s花青素-多酚固态和液态体系紫外-可见吸收光谱的变化如图3所示。随着微波功率的增加,花青素-多酚固态体系的吸光度逐渐增加,但最大波长处吸收峰未发生改变,体系的最大波长处吸光度平均增大0.29 倍。随着微波功率的增加,花青素-多酚液态体系紫外-可见光谱中最大波长处吸收峰较对照组红移15.5 nm,表明在液态体系中具有不饱和基团的花青素和多酚相互作用,共轭程度增强,使得吸收光谱发生红移,其吸收带的最大吸收峰向长波的方向移动[27]。液态体系中的分子运动空间更大,更易使共色素分子剧烈振动,说明微波处理与体系状态有关,体系中分子间距离越大,微波处理效果越显著[29]。微波处理的花青素-多酚液态体系的最大吸收波长处(512 nm)吸光度相对于对照组提高1.50~1.57 倍。当微波功率为30 W和360 W时,花青素-多酚固态和液态体系在最大吸收波长处的吸光度均较高,但考虑到能耗因素,故微波功率为30 W为最佳选择。在相同量花青素-多酚体系(对照组)中,固态体系的吸光度比液态体系高出0.07 倍,但随着微波功率的增加,液态体系的平均吸光度是固态体系的2.19 倍。
2.2.2 不同时间超声处理对花青素-多酚固态和液态体系吸收光谱的影响
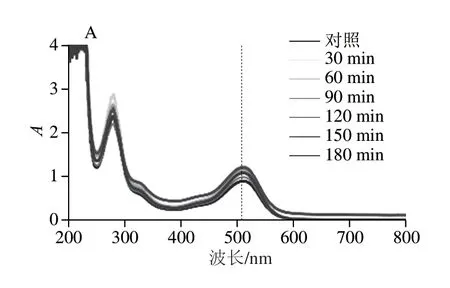
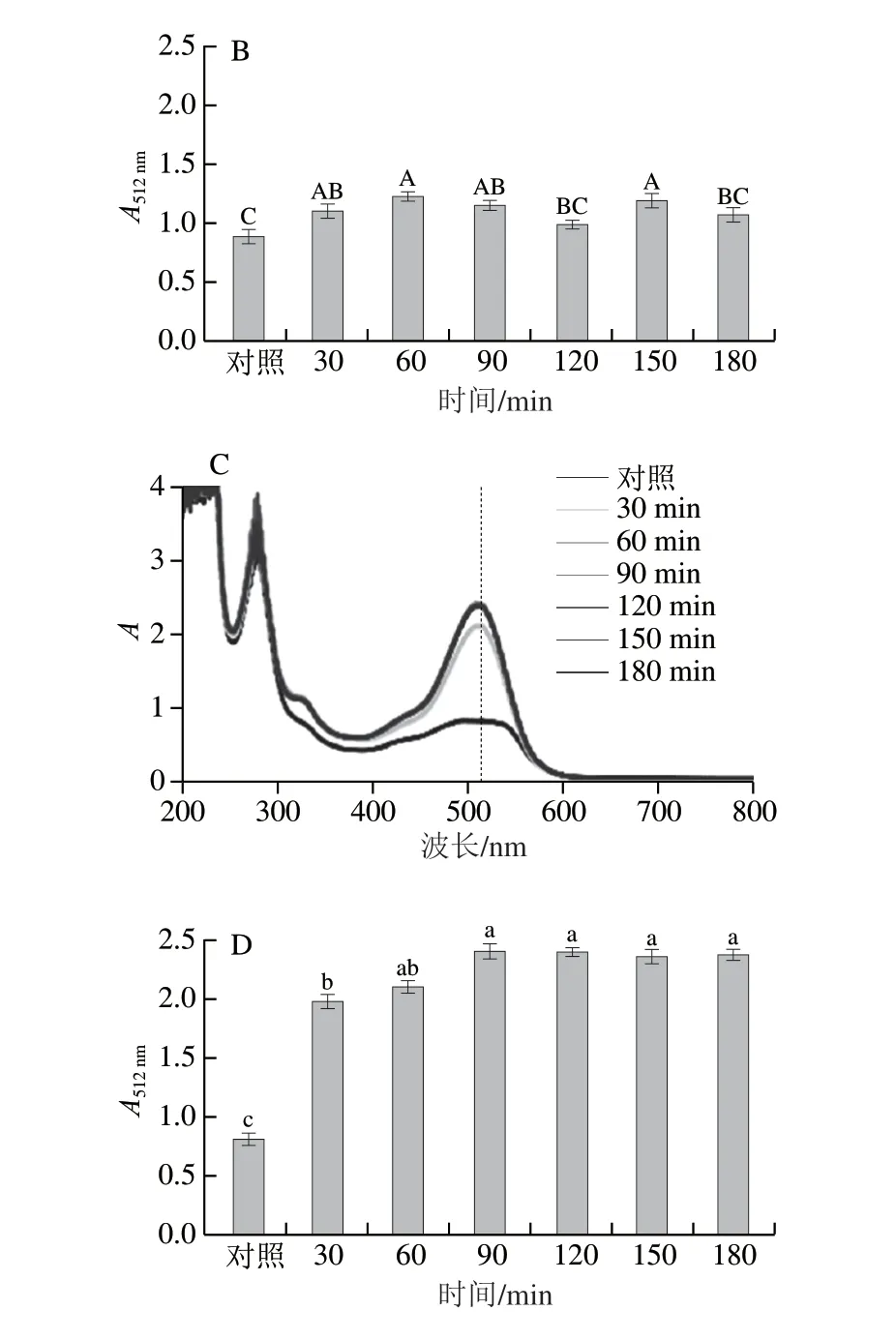
图4 不同超声时间对花青素-多酚固态与液态体系紫外-可见吸收光谱及其在最大波长处吸光度的影响Fig.4 Effect of ultrasonic treatment time on the UV-visible absorption spectra of anthocyanin-polyphenol solid and liquid systems and their absorbance values at the maximum absorption wavelength
频率为40 kHz超声处理不同时间(30、60、90、120、150、180 min)花青素-多酚固态和液态体系紫外-可见吸收光谱的变化如图4所示。随着超声时间的延长,花青素-多酚固态体系的吸光度逐渐增加,但最大吸收波长处吸收峰未发生改变。超声处理的花青素-多酚固态体系的最大波长处(512 nm)吸光度相对于对照组提高0.18~0.33 倍。随着超声时间的延长,花青素-多酚液态体系光谱中最大波长处吸收峰红移15 nm,超声处理组平均吸光度较对照组增大2.78 倍。表明花青素-多酚液态体系中的物质组分发生了结构的改变,使其最大波长处吸收峰向长波的方向移动,在液态体系中具有不饱和基团的花青素和多酚相互作用,共轭程度增强,使吸收光谱发生红移[30]。综合固态和液态体系,超声时间为90 min时,花青素-多酚固态和液态体系在最大吸收波长处的吸光度较高。在相同量花青素-多酚体系(对照组)中,固态体系的吸光度比液态体系的高出0.07 倍,但随着超声处理时间的延长,液态体系平均吸光度是固态体系的2.02 倍。超声处理引起的空化效应使液态体系内局部出现拉应力而形成负压,而压强的降低使原来溶于液体的气体过饱和,从液体逸出产生空气核,使花青素-多酚液态体系中共色素吸光度增大[31]。液态体系超声处理比固态体系超声处理的吸光度增速快,说明超声处理引起的空化效应在液态体系中对呈色物质的光谱吸收的影响更大。
2.3 不同处理方式对花青素-多酚体系花青素含量的影响

图5 不同超声时间、微波功率对花青素-多酚固态与液态体系花青素含量变化的影响Fig.5 Change in anthocyanin content in solid and liquid anthocyanin-polyphenol systems with ultrasonic treatment time and microwave power
本研究对花青素-多酚固态和液态体系中花青素含量和多酚组成进行了高效液相色谱分析。结果表明桑葚中花青素主要为矢车菊素-3-O-葡萄糖苷,因此本研究以矢车菊素-3-O-葡萄糖苷当量表示总花青素含量[32]。经过微波和超声波处理,体系中的游离花青素和多酚含量组成发生显著变化。如图5A所示,随着微波功率增大,花青素-多酚固态体系中总花青素含量逐渐升高,在270 W后趋于稳定。经微波处理的液态体系中总花青素含量显著高于对照组,但随着功率达到180 W后,总花青素含量没有显著变化。说明微波处理引起的分子振动对液态和固态体系中花青素与多酚相互作用所形成共色素稳定性有提高作用[28],从而有效提升总花青素的含量。从总体上看,在微波所有处理组中,花青素-多酚液态体系中总花青素含量比固态体系中高2.57 倍。同时,对超声处理影响固态和液态体系总花青素含量的变化进行了分析,如图5B所示,总花青素含量在花青素-多酚固态体系和液态体系中总体均呈上升趋势,当超声时间达到180 min时,总花青素含量在固态体系和液态体系中均显著降低。说明超声处理引起的空化效应对液态和固态体系中花青素-多酚所形成的共色素体系稳定性具有提升作用,但超过180 min会有相反的作用,Ribas-Agusti等[30]的研究成果与本实验结果相似。总体上看,花青素-多酚液态体系在超声所有处理组中游离总花青素含量比固态体系中高2.27 倍。
2.4 不同处理方式对花青素-多酚体系多酚含量的影响
2.4.1 不同功率微波处理对花青素-多酚固态与液态体系多酚含量的影响
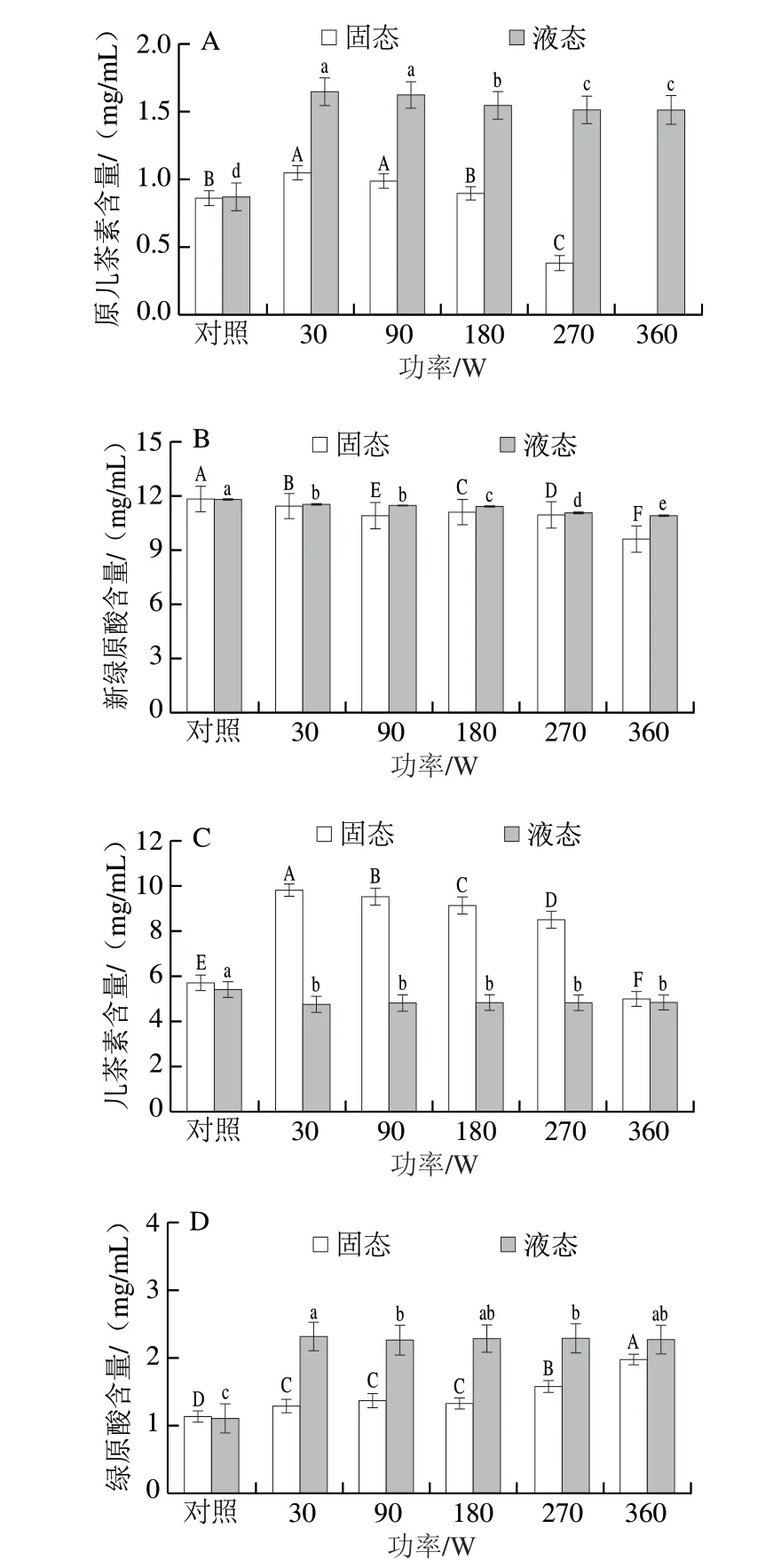
图6 不同微波功率对花青素-多酚固态与液态体系多酚含量的影响Fig.6 Change in polyphenol contents in solid and liquid anthocyanin-polyphenol systems with microwave power
不同微波功率(30、90、180、270、360 W)处理30 s花青素-多酚固态和液态体系中多酚含量和组成的变化如图6所示。白桃中的多酚经外标法定性定量分析可知,主要是新绿原酸、儿茶素、绿原酸和原儿茶酸。30~90 W条件下,当微波功率增大时,花青素-多酚固态体系中原儿茶酸含量显著高于对照组,当功率大于270 W时,原儿茶酸含量显著降低,在360 W时原儿茶酸未检出。微波处理的花青素-多酚液态体系中原儿茶酸含量显著高于对照组,并且随着功率的增大,原儿茶酸的含量显著降低,大于270 W后含量基本保持稳定。花青素-多酚液态和固态体系中新绿原酸含量随微波功率的增大总体呈降低趋势,而绿原酸含量在固态体系中随微波功率增大而增高,但在液态体系中基本保持不变。因此,推测微波处理可能导致新绿原酸向绿原酸的转化。此外,经微波处理的花青素-多酚固态体系中儿茶素含量显著高于对照组,但当微波功率逐渐增大时,儿茶素含量逐渐降低,当微波功率为360 W时儿茶素含量低于对照组。而经微波处理后的花青素-多酚液态体系中儿茶素含量显著低于对照组,但儿茶素含量随微波功率增大基本保持不变。综上所述,微波处理引起的超高频电磁波使花青素-多酚共色素复合体随电场变化迅速转动,相邻分子间出现摩擦和碰撞,可能导致新绿原酸转化为绿原酸。而Zhao Mengyao等[28]研究发现锦葵色素-3-O-葡萄糖苷和锦葵色素双葡萄糖苷在微波处理下也会发生异构化。
2.4.2 不同时间超声处理对花青素-多酚固态与液态体系多酚含量的影响
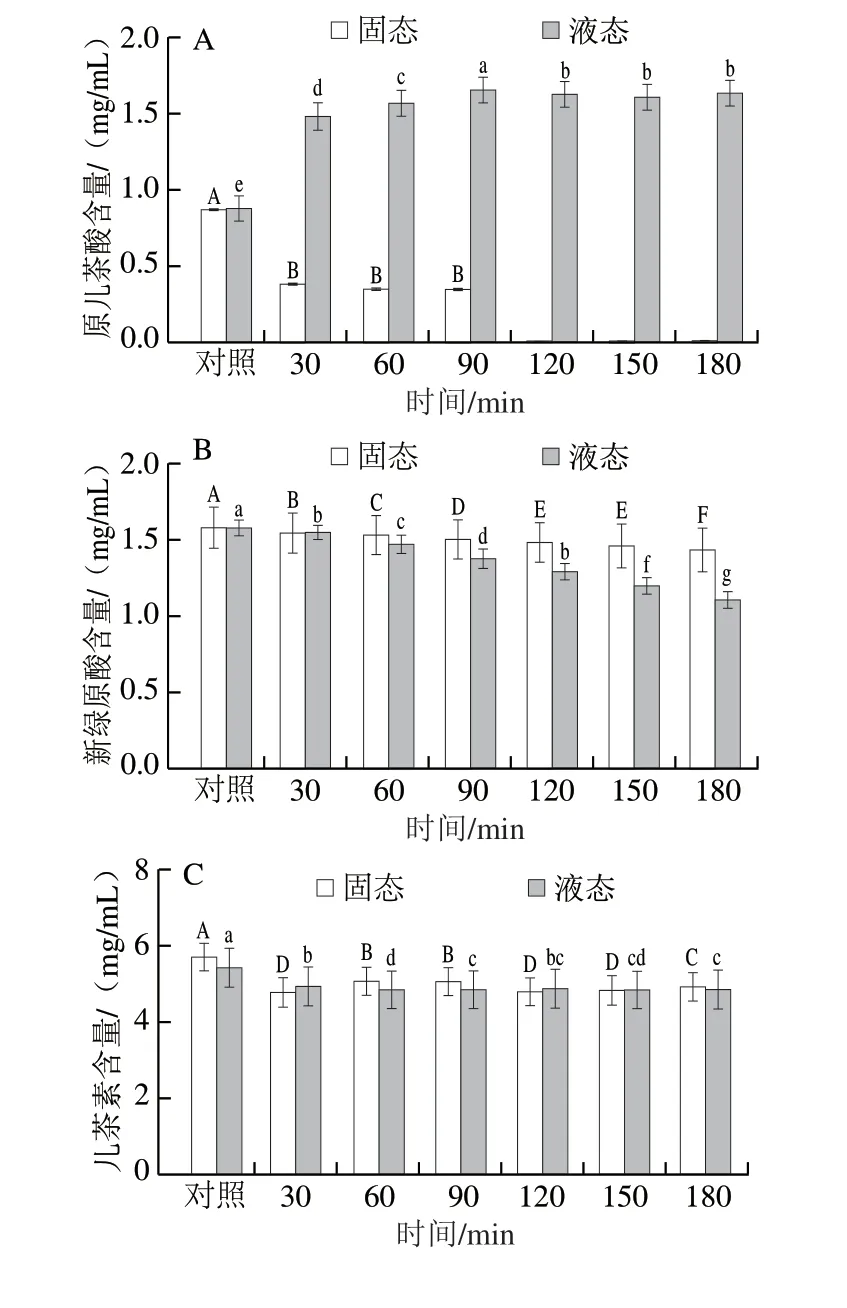

图7 不同超声时间对花青素-多酚固态与液态体系多酚含量的影响Fig.7 Change in polyphenol contents in solid and liquid anthocyanin-polyphenol systems with ultrasonic treatment time
频率为40 kHz超声处理不同时间(30、60、90、120、150、180 min)花青素-多酚固态和液态体系多酚含量和组成的变化如图7所示。随着超声时间的延长,花青素-多酚固态体系中原儿茶酸含量显著降低,当超声时间超过90 min时,原儿茶酸完全检测不到。在液态体系中原儿茶酸含量随着超声时间的延长而显著升高,在超声90 min时含量达最高,随后保持稳定。经超声处理的花青素-多酚固态体系与液态体系中儿茶素含量显著低于对照组;当超声时间延长时,儿茶素含量基本保持稳定。经超声处理的花青素-多酚固态体系中绿原酸含量显著高于对照组,当超声时间逐渐延长时,绿原酸含量逐渐降低,但仍高于对照组。液态体系中绿原酸含量显著高于对照组,当超声时间超过30 min,绿原酸含量保持稳定。综上所述,超声处理引起的空化效应使花青素-多酚共色素复合体溶液中形成空气核,在超声场的作用下振动、生长并不断聚集声场能量,当能量达到某个阈值时,空气核急剧崩溃闭合释放出巨大的能量,加速了新绿原酸和绿原酸的扩散以及二者的相互转化,而在固态体系中超声场作用逐级减弱,对共色素稳定性的影响亦逐级减弱,但仍能显著影响原儿茶酸及儿茶素的稳定性[33]。
2.5 相关性分析结果
进一步对花青素-多酚固态和液态体系经超声波和微波处理后的色泽L*值、a*值、b*值、最大吸收波长吸光度、多酚及花青素含量变化进行多元变量统计分析。通过PCA-X和PLS-DA获得载荷和得分双标图。如图8所示,PCA获得两个主成分PC1和PC2,分别解释了样品总体变异的34.3%和24.6%,其中PC2可以有效区分微波处理和超声波处理样品的差异,且差异主要来源于超声样品中的原儿茶酸、儿茶素含量变化,以及微波样品中的儿茶素和总花青素含量变化。PLS-DA进一步消除相同处理内部的系统误差,获得两个主成分分别解释24.3%、17.0%的总体差异(图9)。进一步明确了超声时间150、180 min显著影响共色素体系稳定特性,而微波功率180 W以上处理对体系呈色相关特征产生了显著的影响。
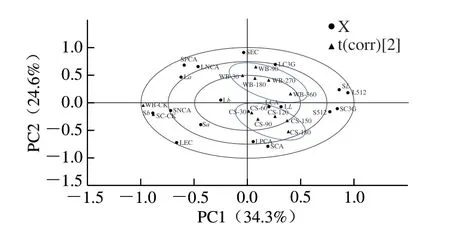
图8 不同超声时间、微波功率处理对花青素-多酚固态与液态体系色泽相关特性的PCA-X载荷得分图Fig.8 PCA-X loading biplot for correlation of ultrasonic treatment time and microwave power with color characteristics of anthocyanin-polyphenol solid and liquid systems

图9 不同超声时间、微波功率处理对花青素-多酚固态与液态体系色泽相关特性的PLS-DA载荷得分图Fig.9 PLS-DA loading biplot for correlation of ultrasonic treatment time and microwave power with color characteristics of anthocyanin-polyphenol solid and liquid systems
3 结 论
不同条件微波与超声波处理的花青素-多酚固态与液态体系,在色泽、光谱、花青素和多酚含量方面的变化存在显著不同。在相同量花青素-多酚的溶液及模拟固态体系中,微波和超声处理花青素-多酚固态体系L*值升高,b*值降低,a*值无明显变化,实际表观色泽变浅;综合考虑,微波功率30、90 W和超声时间90 min处理均对液态共色体系的色泽形成和稳定性有较明显的影响。随着微波功率的增加和超声时间的延长,花青素-多酚固态体系的吸光度逐渐增加,但最大吸收波长未发生改变。花青素-多酚液态体系的最大吸收波长分别红移15.5 nm和15 nm,吸光度显著增加。微波处理和超声处理对花青素-多酚液态体系光谱的影响比在固态体系中更明显。微波和超声处理对花青素-多酚固态体系和液态体系中总花青素的稳定性均有提升作用,原儿茶酸含量在固态体系中先升高后降低,在液态体系中显著升高,儿茶素含量显著降低,固态和液态体系中新绿原酸含量显著降低,绿原酸含量显著升高,表明新绿原酸转化为绿原酸。微波功率为30 W或超声时间为90 min处理的花青素-多酚固态体系和液态体系总花青素和多酚含量较高,对体系呈色稳定性的贡献最大。原儿茶酸、儿茶素、及总花青素含量在超声和微波处理中的变化是引起体系呈色特性差异的主要原因。
