桑葚渣多酚提取物冻干粉的制备及稳定性分析
2021-01-20余元善程丽娜肖更生吴继军卜智斌徐玉娟
邹 颖,余元善,邹 波,程丽娜,肖更生,吴继军,卜智斌,徐玉娟
(广东省农业科学院蚕业与农产品加工研究所,农业农村部功能食品重点实验室,广东省农产品加工重点实验室,广东 广州 510610)
桑果鲜果味道甜美多汁,含有人体所必需的营养素如维生素、氨基酸、矿物质以及具有生理活性的黄酮类、酚酸类化合物,是1993年首批列入“既是食品又是药品”的农产品[1]。现代医学研究确证桑果具有抗氧化、抗炎、增强机体免疫力、护肝、降血糖、降血脂等功能[2]。但桑果季节性强,且柔软、含水量高,不易贮藏或运输,极易腐烂,所以目前对桑果资源的利用主要是在原产地进行加工,直接榨汁或者少部分用于酿造果酒、果醋,而产生的大量果渣则被白白丢弃,且桑葚渣中仍残留大量花色苷、多酚和黄酮等活性成分[3-4]。桑葚渣多酚提取物中富含多酚类物质,尤其是花色苷,是一种潜在的抗氧化物质的来源。桑葚渣中的花色苷主要为矢车菊-3-芸香糖苷和矢车菊-3-葡萄糖苷,是桑果主要的活性成分和呈色物质[5-6]。但花色苷是一类高活性但易降解的黄酮类化合物,它们的稳定性取决于环境和化学因素,如pH值、金属离子、光照、紫外线照射、温度、氧及酶活性等[7]。由于这些化合物在加工和贮存过程中稳定性较差,特别是在水溶液的食品体系中[8],因此,需通过有效的技术手段提高其稳定性。微胶囊技术是以天然或人工合成的高分子成膜材料为壁材,以所保护的物质为芯材并将其进行包埋,通过微胶囊化可以减少芯材与外界环境接触,使其免遭光照、温度或氧气等条件的破坏,从而提高芯材的稳定性,延长目标物质的货架寿命[9]。前人对不同原料来源的多酚类提取物的微胶囊化进行了研究,如覆盆子[10]、可可壳[11]、黑米[12]、葡萄皮[13]等,均提高了其稳定性。
本实验以副产物桑葚渣为原料,制备了一种醇提物,添加冻干保护剂得到桑葚渣多酚提取物冻干粉,以期获得稳定的富含多酚化合物的功能型果粉配料。
1 材料与方法
1.1 材料与试剂
新鲜桑葚渣由四川攀枝花桑果汁工厂提供;2,2'-偶氮二(2-甲基丙基咪)二盐酸盐(2,2'-azobis(2-amidinopropane) dihydrochloride,AAPH)、荧光素、Trolox(纯度99%)、原儿茶酸、芦丁、槲皮素、金丝桃苷 美国Sigma公司;麦芽糊精 河南万邦实业有限公司;乳清蛋白粉 河北千聚生物科技有限公司。实验所用其他试剂均为分析纯。
1.2 仪器与设备
Varioskan Flash型酶标仪 美国Thermo公司;UV-721型紫外-可见分光光度计 上海精密科学仪器仪表有限公司;LRH-250A-II生化培养箱 韶关市泰宏医疗器械有限公司;SKY-211B恒温培养振荡器 江苏苏昆仪器有限公司。
1.3 方法
1.3.1 桑葚渣多酚提取液的制备
取新鲜桑葚渣加体积分数70%乙醇溶液(质量分数0.1%柠檬酸为酸化剂),超声提取3 次,每次20 min,料液比1∶10,1 500×g离心10 min取上清液,合并3 次提取的上清液,45 ℃减压旋转蒸发浓缩至固形物含量为11 °Brix左右,-20 ℃保藏备用。
1.3.2 桑葚渣多酚提取物冻干粉的制备
分别按一定比例向桑葚渣多酚提取浓缩液中添加冻干保护剂(麦芽糊精、乳清蛋白、发酵荔枝果渣),搅拌均匀后放置在4 ℃冰箱内预冷1 h,随后置于-80 ℃下冷冻30 min,最后放入真空冷冻干燥机中干燥48 h,其冷肼温度为-80 ℃,真空度小于10 MPa,得到各桑葚渣多酚提取物冻干粉。P1为未添加保护剂,P2为提取物干物质(dry extract,DE)-麦芽糊精-乳清蛋白质量比1∶1∶1,P3为DE-乳清蛋白质量比1∶2,P4为DE-麦芽糊精质量比1∶2,P5为DE-发酵荔枝果渣质量比1∶1,P6为DE-乳清蛋白质量比1∶4,P7为DE-麦芽糊精质量比1∶4。
1.3.3 桑葚渣多酚提取物冻干粉总酚含量的测定
样品提取液的制备方法参考Chen Qinqin等[14]的方法并作调整。取适量桑葚渣多酚提取物冻干粉,取2 g样品,加入10 mL含体积分数1%盐酸的甲醇,超声提取10 min,4 500 r/min离心5 min,取上清液,沉淀再用10 mL含体积分数1%盐酸的甲醇超声提取10 min,离心,与上述上清液合并,加含体积分数1%盐酸的甲醇至30 mL,混匀。总酚含量的测定参考Folin-Ciocalteu法[15]进行。
依据国家防总制定的有关办法和四部委相关文件精神,结合江西省实际,特别是后期项目运行管理的要求,制定 《江西省山洪灾害防治县级非工程措施项目建设管理办法》和《江西省山洪灾害防治县级非工程措施项目验收管理办法》,用于指导项目实施和明确各级各部门的建设职责。
1.3.4 桑葚渣多酚提取物冻干粉总花色苷含量的测定
总花色苷含量参照Giusti等[16]的方法,采用pH示差法测定。取2 g样品,加入10 mL 1%(体积分数,下同)的盐酸-甲醇,超声提取10 min,4 500 r/min离心5 min,取上清液,沉淀再用10 mL 1%的盐酸-甲醇超声提取10 min,离心后与上述上清液合并,加1%的盐酸-甲醇至30 mL,混匀。取提取液2 份,分别加入pH 1.0和pH 4.5的缓冲液,避光放置15 min,测定510 nm和700 nm波长处的吸光度。总花色苷质量浓度按下式计算。

式中:A=(A510nm,pH1.0-A700nm,pH1.0)-(A510nm,pH4.5-A700nm,pH4.5);M为矢车菊素-3-葡萄糖的摩尔质量(449.2 g/mol);ε为26 900 L/(mol·cm);1为比色皿光径(1 cm)。
1.3.5 桑葚渣多酚提取物冻干粉氧自由基吸收能力的测定
参考Steed等[17]的方法,样品用pH 7.4的75 mmol/L磷酸盐缓冲液稀释后备用。黑色96 孔板每孔加入20 μL稀释后的样品,孵育至37 ℃,加入80 μL 1.25 μmol/L荧光素钠溶液(磷酸盐缓冲液配制),37 ℃孵育5 min,每孔加入100 μL 140 mmol/L的AAPH,振荡混匀后,用酶标仪测各孔的荧光强度。以120 μL蒸馏水与80 μL 1.25 μmol/L的荧光素钠溶液混合作为阴性对照,以20 μL蒸馏水与80 μL 1.25 μmol/L的荧光素钠溶液以及100 μL的140 mmol/L AAPH为空白对照。分别移取500 μmol/L Trolox 4、8、12、16、20 μL于96 孔板后,加蒸馏水至20 μL作标准曲线。
荧光强度测定条件:激发波长485 nm;发射波长520 nm,循环35 次,每个循环2.5 min。以Trolox为标准品,样品的氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)以Trolox当量表示,单位μmol/g。以ORAC表征抗氧化活性。
1.3.6 桑葚渣多酚提取物冻干粉的单体酚类物质含量的测定
单体酚类物质含量参考曾丹等[18]的方法,采用高效液相色谱法测定。色谱柱:Wondasil C18柱(250 mm×4.6 mm,5 μm);流动相A为体积分数4%的磷酸溶液,流动相B为乙腈。梯度洗脱程序如下:0~10 min,8% B;10~55 min,8%~18% B;55~55.01 min,18%~70% B;55.01~60 min,70% B;60~60.01 min,70%~8% B;60.01~66 min,8% B;每个样品之间平衡1 0 m i n,进样量1 0 μ L,流速1 mL/min,检测波长520 nm,柱温35 ℃。外标法定量分析单个花色苷的含量,称取一定量的标准品,分别用甲醇溶解,然后配制成混合标准品,用甲醇稀释至不同质量浓度,进行高效液相色谱分析,制作标准曲线,标准曲线质量浓度范围为2.5~100 mg/L。
参考林恋竹等[19]的方法并略作修改,配制10 mg/mL样品溶液,用1.0 mol/L盐酸溶液调节至pH 2.0,加入样品质量分数2%的胃蛋白酶,搅拌均匀,37 ℃孵育2 h;用0.1 mol/L NaHCO3溶液调节至pH 5.3,接着用1.0 mol/L NaOH溶液调节至pH 7.5,加入样品质量分数2%的胰酶,搅拌均匀,37 ℃孵育2 h。每隔1 h取样,沸水浴中灭活,冷却,6 000×g离心15 min,取上清液,测定总花色苷含量。
1.4 数据统计分析
采用SPSS 17.0软件中的方差分析法对数据进行差异显著性检验,以P<0.05为差异显著,数据以平均值±标准差表示。
2 结果与分析
2.1 桑葚渣多酚提取物冻干粉的总酚、总花色苷含量及抗氧化活性
桑葚渣多酚提取物中富含多酚类物质,尤其是花色苷,是一种潜在的抗氧化物质来源。本研究以副产物桑葚渣为原料,制备了一种醇提物,并对添加不同的冻干保护剂(麦芽糊精、乳清蛋白、荔枝发酵果渣)所得桑葚渣多酚提取物冻干粉进行了分析,以期获得稳定的富含多酚化合物的成分,用于功能性食品或食品补充剂的生产。
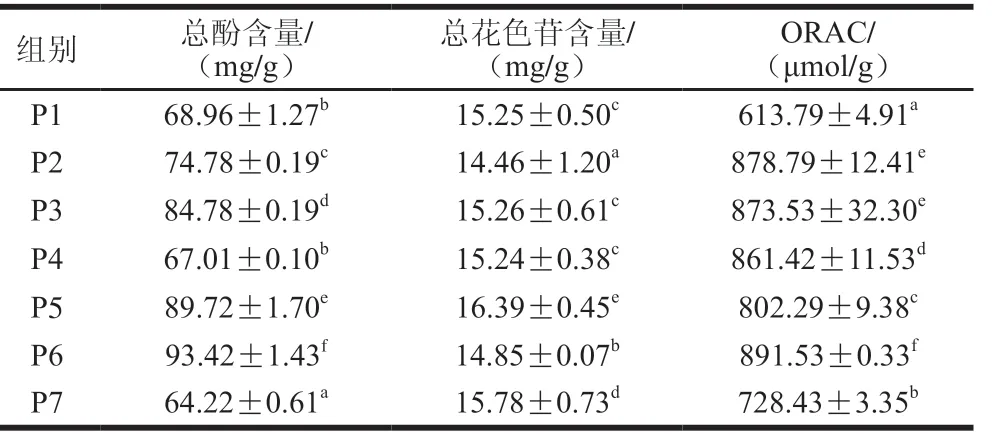
表1 桑葚渣多酚提取物冻干粉的总酚、总花色苷含量及抗氧化活性Table 1 Contents of total polyphenols and total anthocyanins, and antioxidant activity of freeze-dried powder of polyphenol extracts from mulberry pomace
如表1所示,添加不同的冻干保护剂后的桑葚渣多酚提取物冻干粉的总酚含量均有所提高(单独添加麦芽糊精组除外),其中P6组最高(93.42 mg/g),P5次之(89.72 mg/g);总花色苷含量由高到低依次为:P5>P7>P3>P1>P4>P6>P2,以P5含量最高(16.39 mg/g),显著高于P1未添加保护剂组;P2、P6组的总花色苷含量与P1未添加保护剂组相比有所下降,可能是由于包埋影响了花色苷的提取率,类似的结果在Papillo等[12]的研究中也有报道。添加不同的冻干保护剂后的桑葚渣多酚提取物冻干粉的抗氧化活性均有显著提高。
2.2 桑葚渣多酚提取物冻干粉的单体酚类物质含量
矢车菊素-3-葡萄糖苷、矢车菊素-3-芸香糖苷是桑葚渣多酚提取物冻干粉中主要的花色苷单体,Song Wei[20]、李丰廷[21]等在对桑葚的研究中均得出相似结论。添加不同冻干保护剂的桑葚渣多酚提取物冻干粉的单体花色苷含量均显著降低,保护剂的包裹影响了花色苷的提取率,可能是提取过程中离心后沉淀中还有少数与辅料结合的花色苷残留。桑葚渣多酚提取物冻干粉的高效液相色谱分析结果如图1所示。
图1 桑葚渣多酚提取物冻干粉高效液相色谱图Fig.1 High performance liquid chromatography gram of freeze-dried powder of polyphenol extracts from mulberry pomace

表2 桑葚渣多酚提取物冻干粉的单体酚类物质含量Table 2 Contents of major phenolic compounds in freeze-dried powder of polyphenol extracts from mulberry pomace
由表2可知,P1未添加保护剂组中矢车菊素-3-葡萄糖苷含量为(15.87±0.25)mg/g,矢车菊素-3-芸香糖苷含量为(4.96±0.08)mg/g,P5矢车菊素-3-葡萄糖苷含量为(14.82±0.14)mg/g,矢车菊素-3-芸香糖苷含量为(4.68±0.03)mg/g;芦丁是桑葚渣多酚提取物冻干粉中含量最丰富的单体酚类物质,含量为(1 440.35±4.09)~(1 978.20±3.43)μg/g,在桑葚渣多酚提取物冻干粉中还鉴定出了原儿茶酸、槲皮素、金丝桃苷,原儿茶酸的含量为(83.19±1.41)~(128.52±1.43)μg/g,金丝桃苷的含量为(141.82±1.49)~(190.40±4.06)μg/g,槲皮素的含量为(2.73±0.08)~(48.49±0.98)μg/g。在Papillo等[12]的研究中微胶囊组的矢车菊素-3-葡萄糖苷含量也仅为未包埋组的88.9%~96.3%,在一定程度上说明了包埋会影响提取率,测出的数值呈偏低的趋势。总体而言,P5的包埋效果较好,其次为P4、P7(麦芽糊精包埋组)。
2.3 桑葚渣多酚提取物冻干粉贮藏过程中的稳定性
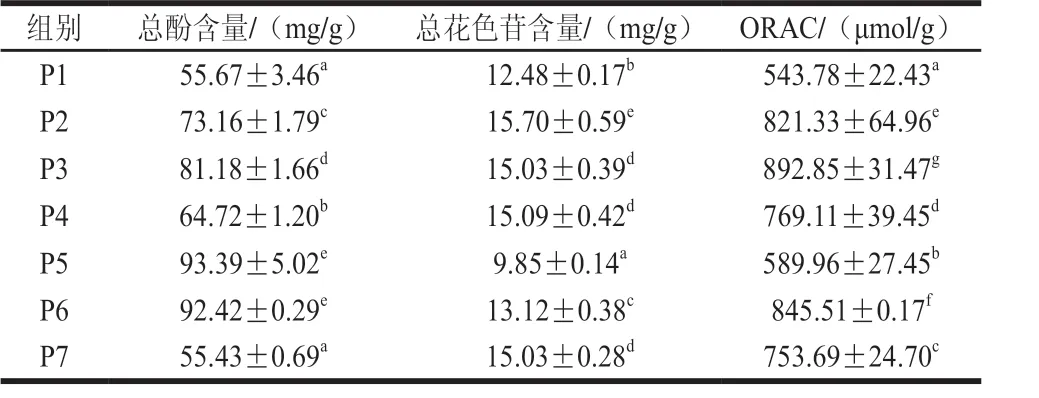
表3 25 ℃贮藏1 个月桑葚渣多酚提取物冻干粉的总酚、总花色苷含量及抗氧化活性Table 3 Contents of total polyphenols and total anthocyanins, and antioxidant activity of freeze-dried powder of polyphenol extracts from mulberry residues after storage at 25 ℃ for one month
为了对桑葚渣多酚提取物冻干粉的稳定性进行评价,测定了桑葚渣多酚提取物冻干粉在25 ℃贮藏1 个月后的总酚含量、总花色苷含量、抗氧化活性以及单体酚类物质的含量。结合表1、3可知,P1未添加保护剂组的总酚含量、总花色苷含量、抗氧化活性分别下降了19.27%、18.16%、11.41%。对比之下,添加保护剂组均体现了一定的保护作用,且添加保护剂组的桑葚渣多酚提取物冻干粉的总酚含量、总花色苷含量、抗氧化活性总体显著高于P1未添加保护剂组,但P5发酵荔枝果渣保护组的总花色苷含量(贮藏后降低39.9%)及抗氧化活性(贮藏后降低26.47%)较贮藏前明显下降。说明麦芽糊精和乳清蛋白粉的添加提高了桑葚渣多酚提取物的贮藏稳定性,且活性成分含量更高,抗氧化活性更强。麦芽糊精因其较好的水溶性和低黏性,可提高被包埋活性成分的氧化稳定性[22],有研究表明乳清蛋白对桑葚花青素具有较好的包裹性和辅色性,且两者之间的紧密结合能力是其辅色效果显著的原因[23]。但P5发酵荔枝果渣组贮藏过程并未体现出明显的保护效果,可能是辅料添加比例较少,25 ℃贮藏1 个月后吸潮严重。
从单体酚类物质的含量来看(表2、4),贮藏后P1未添加保护剂组的矢车菊素-3-葡萄糖苷含量为(11.63±0.13)mg/g,矢车菊素-3-芸香糖苷含量为(4.14±0.05)mg/g,分别下降26.72%、16.53%,相较而言,P4、P7的2 种主要花色苷单体的含量25 ℃贮藏1 个月后没有明显下降,体现了较好的稳定性。
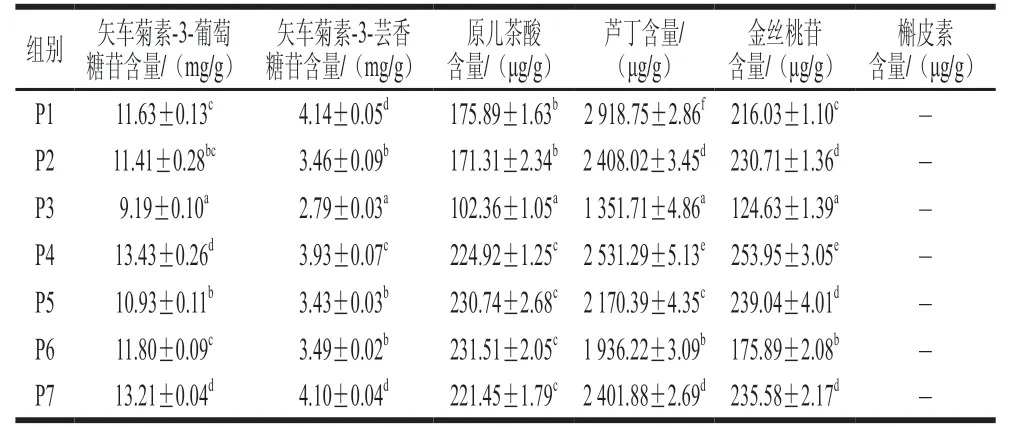
表4 25 ℃贮藏1 个月桑葚渣多酚提取物冻干粉的单体酚类物质含量Table 4 Contents of major phenolic compounds in freeze-dried powder of polyphenol extracts from mulberry pomace after storage at 25 ℃ for one month
2.4 模拟胃、肠道消化对桑葚渣多酚提取物冻干粉总花色苷含量的影响
机体摄入的生物活性物质在胃肠道消化过程中会发生降解或转化。因此,摄入的活性物质并不能完全被机体利用。研究表明,生物活性物质对机体功效的主要影响因素为生物有效性即消化稳定性[24]。可见,采用模拟体外消化的方法研究物质的生物活性更接近于物质被生物体利用的情况。生物可接受度是营养物可被机体吸收利用的程度,即营养物直接进入人体的消化系统并可被人体胃、肠道溶解的部分,是评价营养有效性的一个关键指标[25-27]。
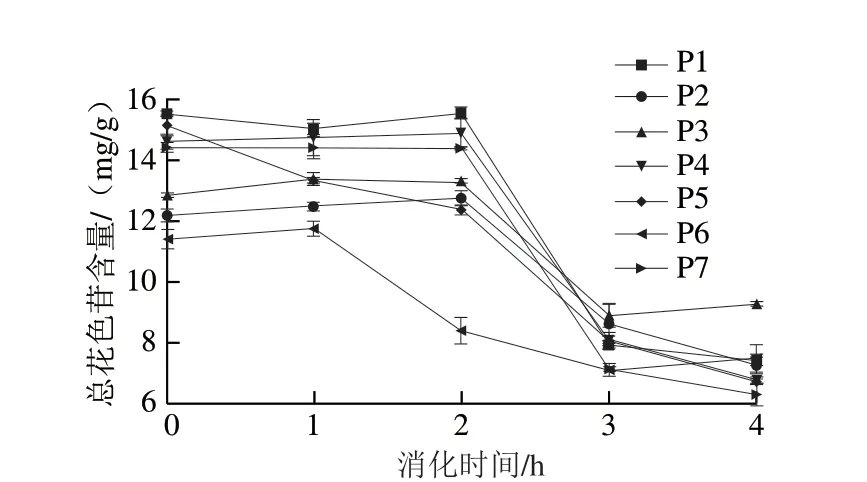
图2 模拟胃肠道消化对桑葚渣多酚提取物冻干粉总花色苷含量的影响Fig.2 Effect of simulated gastrointestinal digestion on the content of total anthocyanins in freeze-dried powder of polyphenol extracts from mulberry pomace
由图2可知,未消化的P1未添加保护剂组的花色苷含量为15.52 mg/g。胃消化初期,花色苷含量逐渐降低,胃消化1、2 h后样品的花色苷含量无明显差异。肠消化阶段,花色苷含量明显下降。肠消化2 h后P1的花色苷含量下降了52.23%。随着体外消化的进行,微胶囊包埋组的花色苷含量亦呈明显下降的趋势,但P3、P6、P2经肠消化2 h后花色苷含量分别比未消化时下降了28.13%、34.63%、40.54%,保留率均明显高于P1未添加保护剂组。实验结果表明,花色苷在胃消化条件下比肠消化条件下稳定;随着体外消化的进行,样品花色苷含量呈下降趋势,这与Huang Haizhi[28]和Tagliazucchi[29]等的研究结果相似。此外,肠消化条件下花色苷含量显著降低的原因可能是花色苷在中性条件下不稳定,较容易降解为查耳酮或其他小分子酚类化合物[30]。且微胶囊包埋组(P3、P6、P2)中花色苷保留率较高,可能是因花色苷被壁材(乳清蛋白粉、麦芽糊精)包裹,避免其与环境直接接触,说明将桑葚渣多酚提取物微胶囊化可提高其消化稳定性。
3 结 论
添加不同的冻干保护剂后的桑葚渣多酚提取物冻干粉的总酚含量(单独添加麦芽糊精组除外)及抗氧化活性均有所提高,但单体花色苷含量(表观)均显著降低,保护剂的包裹影响了花色苷的提取率,提取过程中离心后沉淀中还有少数与辅料结合的花色苷残留,总体而言,P5的保护效果较好,其次为P4、P7(麦芽糊精包埋组)。
25 ℃贮藏1 个月后未添加保护剂组的桑葚渣多酚提取物冻干粉总酚含量、总花色苷含量、抗氧化活性分别下降了19.27%、18.16%、11.41%。微胶囊组均体现出一定的保护作用,麦芽糊精和乳清蛋白粉提高了桑葚渣多酚提取物的贮藏稳定性,且活性成分含量更高,抗氧化活性更强。从单体酚类物质的含量来看,P1未添加保护剂组的矢车菊素-3-葡萄糖苷含量为(11.63±0.13)mg/g,矢车菊素-3-芸香糖苷含量为(4.14±0.05)mg/g,分别下降26.72%、16.53%,相较而言,P4、P7的2 种主要的花色苷单体的含量25 ℃贮藏1 个月后没有明显下降,体现了较好的稳定性。
桑葚渣多酚提取物冻干粉的花色苷在胃消化条件下比肠消化条件下稳定;随着体外消化的进行,样品花色苷含量呈下降趋势,且微胶囊包埋组(P3、P6、P2)中花色苷保留率较高,提高了桑葚渣多酚提取物的消化稳定性。
