采用核酸酶酶解联合离子交换树脂吸附开发低嘌呤腐竹
2021-01-20万茵余新金冯思麟王家槐肖辉雷宇皮潇文李文辉付桂明
万茵,余新金,冯思麟,王家槐,肖辉,雷宇,皮潇文,李文辉,付桂明*
1(食品科学与技术国家重点实验(南昌大学),江西 南昌,330047)2(南昌大学 食品学院,江西 南昌,330047) 3(北京二商(江西大观楼)食品有限公司,江西 高安,330802)
嘌呤(purine),又称普林,是一类带碱性的2个相邻碳氮环的含氮有机化合物,分子式C5H4N4[1],在食品中主要以核酸、嘌呤核苷酸的形式存在[2],在人体内代谢成终产物尿酸(2,6,8-三氧嘌呤)[3]。若嘌呤代谢出现障碍,会导致机体尿酸生成增加或尿酸排泄减少,出现高尿酸血症[4],超饱和的尿酸易以尿酸钠晶体形式在各个组织和器官等处沉积(如关节、软组织及肾器官),导致关节发炎、尿路结石及其他并发症[1,5]。男性体内血清尿酸钠浓度超过420 μmol/L,女性超过357 μmol/L的患者易得痛风和尿酸性结石[6]。
腐竹是大豆植物蛋白制品,其结构为蛋白质-脂类薄膜,由豆浆中的蛋白质受热变性与脂类物质在液-气界面吸热聚合,同时蒸发脱水凝结而成[7],又名腐皮,起源于唐朝,距今已有一千多年的历史,是中国人很喜爱的传统大豆制品[8]。腐竹含有丰富的营养成分,每100 g腐竹含有14 g脂肪、25.2 g蛋白质、48.5 g糖类及其他维生素和矿物元素[9],素有“豆制品中的营养冠军”之称[10]。据检测豆制品中嘌呤含量在84.4~1 674.9 μg/g,平均为823.0 μg/g[11],归属为痛风患者宜限量食用的中等嘌呤含量食物[12],而腐竹总嘌呤含量在1 528.1~1 669.3 μg/g,远高于豆制品的平均值,因此痛风病人更需限量食用腐竹。
为降低豆浆中的核酸、核苷酸和嘌呤(统称嘌呤类物质),本文将树脂吸附和核酸酶酶解核酸2种方法相结合,通过正交实验确定去除嘌呤类物质的最佳技术条件,开发出适宜高尿酸血症等特殊人群的低嘌呤腐竹产品,扩大腐竹消费人群,同时可为其他豆制品的嘌呤去除提供理论参考。
1 材料与方法
1.1 材料与仪器
材料:大豆,北京二商(江西大观楼)食品有限公司提供;离子交换树脂NUF01、NUF110、NUF10和NUF20,为向树脂生产企业订制实验室改良产品;腺嘌呤、鸟嘌呤、黄嘌呤、次黄嘌呤,色谱纯,美国Sigma公司;四丁基氢氧化铵(含体积分数10%的甲醇溶液),国产色谱纯;食品级核酸酶(4万U/g,5′-磷酸二酯酶)、鸟嘌呤核苷酸、腺嘌呤核苷酸为国产生化试剂,KH2PO4、K2HPO4、冰乙酸、KOH、高氯酸、氯仿、正丁醇、无水乙醇、NaCl、柠檬酸三钠、乙二胺四乙酸、十二烷基硫酸钠、NaOH、氯仿、异戊醇、高氯酸钠均为国产分析纯。
Waters高效液相色谱系统,美国Waters公司;PHS-3C精密pH计、FA1604上皿分析天平、UV-7504单光束紫外-可见分光光度计、FA-1604电子分析天平,上海精密科学仪器有限公司;5810R离心机,Eppendorf 股份有限公司;JJ-2高速组织捣碎机,金坛区西城新瑞仪器厂。
1.2 实验方法
1.2.1 高效液相色谱法测定嘌呤含量
Waters高效液相色谱系统,e2695泵,2998检测器,Phenomenex luna 5 μm C18柱(250 mm×4.60 mm,5 μm),集成自动进样器,Empower Pro工作站;柱温25 ℃,进样量10 μL;紫外检测器波长254 nm;流速0.8 mL/min。流动相,超纯水、冰乙酸、四丁基氢氧化铵体积比为997∶1.5∶1.5的混合液[13](流动相A)与无水甲醇(流动相B)按97∶3的体积比混合。参照毛玉涛等[14]方法绘制嘌呤标准曲线,计算样品中嘌呤含量。
1.2.2 豆浆中嘌呤含量的测定
1.2.2.1 原料预处理
取85 g干大豆,洗净,加入300 g蒸馏水浸泡10 h,用高速组织捣碎机打成豆浆,再加入900 g蒸馏水混匀,100目纱布过滤除豆渣,得到豆浆样液,分装冻藏待用。
1.2.2.2 豆浆总嘌呤含量检测
参照文献[15]的方法。量取2 mL豆浆样液于50 mL烧杯中,加入10 mL 体积分数70% HClO4溶液,沸水浴水解0.5 h,冰浴冷却,用8 mol/L KOH溶液调pH至7.0,滤去沉淀,再用0.2 mol/L的冰乙酸调pH至3.0,离心,取上层清液加水定容至50 mL,取1 mL上清液过0.22 μm滤膜滤,进行高效液相色谱分析。
1.2.3 根据嘌呤核苷酸吸附率选择树脂
准确称量50 mg鸟嘌呤核苷酸标准品、50 mg腺嘌呤核苷酸标准品,用双蒸水定容至500 mL,配制成质量浓度为100 μg/mL的鸟嘌呤核苷酸和腺嘌呤核苷酸混合溶液。取30 mL 100 μg/mL核苷酸标准混合溶液于100 mL小烧杯中,加入1 g树脂,置于恒温水浴锅,60 ℃搅拌吸附1 h,过滤,稀释,采用紫外分光光度法在260 nm处测光吸收值,按公式(1)计算滤液中的核苷酸含量。比较4种树脂对核苷酸的吸附效果,选择吸附率高的树脂。

(1)
式中:OD260为溶液在 260 nm 波长下的光吸收值;N为稀释倍数;0.032为1 mL溶液含1 μg核苷酸的比消光系数。
1.2.4 豆浆的核酸酶酶解条件预实验
1.2.4.1 核酸酶用量
取30 mL豆浆于100 mL小烧杯中,分别加入6.67、12.33、20.00、26.67 和33.33 U/mL核酸酶,置于60 ℃恒温搅拌水浴锅中酶解1 h后,测定豆浆中核苷酸和核酸含量,按公式(2)计算酶解转化率,并分析核酸酶用量对酶解转化率的影响。

(2)
1.2.4.2 酶解时间
取30 mL豆浆于100 mL小烧杯中,加入26.67 U/mL核酸酶,置于60 ℃恒温搅拌水浴锅中分别反应0.5、1.0、1.5、2.0和2.5 h,分析酶解时间对酶解转化率的影响。
1.2.4.3 酶解温度
取30 mL豆浆于100 mL小烧杯中,加入26.67 U/mL核酸酶,置于恒温搅拌水浴锅中,分别在50、55、60、65、70和75 ℃下反应1 h,分析酶解温度对酶解转化率的影响。
1.2.5 树脂NUF20结合核酸酶酶解技术条件的确定
1.2.5.1 树脂添加量对嘌呤吸附效果的影响
取30 mL豆浆于100 mL 烧杯中,分别加入3、4、5、6和7.5 g树脂,26.67 U/mL核酸酶,置于70 ℃恒温水浴锅中,搅拌吸附1 h,过滤,按1.2.2.2小节方法检测总嘌呤含量,按公式(3)计算吸附率。考察树脂添加量对吸附效果的影响。
(3)
式中:X,豆浆嘌呤类物质的吸附率,%;ρ0,酶解吸附前豆浆总嘌呤质量浓度,mg/mL;ρ,酶解吸附后豆浆总嘌呤质量浓度,mg/mL。
1.2.5.2 处理温度对嘌呤吸附效果的影响
取30 mL豆浆于100 mL烧杯中,加入6 g树脂、26.67 U/mL核酸酶,置于恒温水浴锅中,分别在60、70和80 ℃下搅拌吸附1 h,过滤,分析同上。考察不同温度对吸附效果的影响。
1.2.5.3 处理时间对嘌呤吸附效果的影响
取30 mL豆浆于100 mL烧杯中,加入6 g树脂,26.67 U/mL核酸酶,置于70 ℃恒温水浴锅中,分别搅拌吸附0.5、1、1.5和2 h,过滤,分析同上。考察处理时间对吸附效果的影响。
1.2.5.4 正交试验设计
根据单因素试验结果,确定各因素对应水平,按L9(34)正交表安排正交试验。
1.2.5.5 嘌呤吸附率的计算
按公式(3)计算豆浆中总嘌呤类物质的吸附率[16]。
1.2.6 腐竹成品嘌呤含量检测
采用煮浆揭皮锅(由北京二商(江西大观楼)食品有限公司提供)进行低嘌呤腐竹工业化制作实验,将按照前期研究所获最佳的酶解条件、最佳树脂类型及用量、最佳吸附温度和时间处理的豆浆倒入揭竹盘,浆量约为盘容量的2/3,揭竹温度控制在80~85 ℃。待豆浆表面自然凝固成薄膜时,用涂油的竹棍挑起,将腐竹内的浆液控干之后烘干。称量腐竹样品(精确到0.000 g)于烧杯中,加入10 mL 体积分数为70%的HClO4溶液,在100 ℃水浴锅中水解1 h,冰浴冷却,用8 mol/L KOH溶液中和水解液pH至7.0,滤去沉淀物,再用0.2 mol/L的冰乙酸溶液调pH至3.0,离心,取上清液加水定容至50 mL,再取1 mL样品过0.22 μm滤膜,进行高效液相色谱分析。
1.2.7 数据分析
本实验采用Origin 9.0作图,并通过SPSS 21.0软件进行实验数据的方差和相关性分析。
2 结果与分析
2.1 嘌呤标准曲线
图1为4种嘌呤标准品的高效液相色谱图,腺嘌呤、鸟嘌呤、次黄嘌呤和黄嘌呤的保留时间分别为9.859、12.580、17.364和20.439 min,各峰达到了完全分离。

图1 四种嘌呤标准品的高效液相色谱图Fig.1 High performance liquid chromatograms of four purine standards
对每种嘌呤的峰面积(Y)与对应质量浓度(X)进行线性回归分析,得线性回归方程、相关系数R2及RSD于表1。由表1可知,RSD<1%,可知该方法精密度高,重现性很好。

表1 四种嘌呤的标准曲线及方法精密度Table 1 Standard curve of four purine and accuracy of the method
2.2 豆浆中的嘌呤含量分析
图2为豆浆经高氯酸水解后的高效液相色谱图,经与图1比对,可见腺嘌呤、鸟嘌呤的峰的保留时间分别为9.888和12.874 min,未见另2种嘌呤的峰,可能是含量太低导致未能检出。不同品种大豆生产的豆浆中嘌呤含量有所不同,但本文中黄嘌呤和次黄嘌呤含量很低的结果与文献报道基本一致。如毛玉涛等[14]测定了贵州地区大豆制作的豆浆中嘌呤含量,未在豆浆中检测到黄嘌呤和次黄嘌呤;李慧慧等[17]采用高效液相色谱法在豆浆中检出了黄嘌呤和次黄嘌呤,但含量偏低。根据计算,豆浆中腺嘌呤、鸟嘌呤的含量分别为(52.2±1.09)和(68.9±2.28)mg/L,总嘌呤含量为(121.1±3.38)mg/L。
2.3 嘌呤核苷酸吸附效果最佳树脂确定
由表2可见,树脂NUF10和树脂NUF20对嘌呤核苷酸的吸附效果很好,吸附率分别达到96.48%和98.4%,均超过95%,树脂NUF110对嘌呤核苷酸吸附作用微弱,吸附率只有9.6%,而树脂NUF01对核苷酸几乎没有吸附,这可能是由于不同种类树脂性质和结构不同,导致对嘌呤核苷酸的吸附效果存在显著差异。所以选定树脂NUF20进行后续实验。
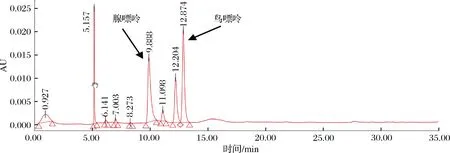
图2 豆浆中嘌呤的高效液相色谱图Fig.2 High performance liquid chromatograms of various purines in soymilk

表2 四种树脂对嘌呤核苷酸的吸附率 单位:%
2.4 豆浆的核酸酶酶解条件
由图3-a可知,豆浆的核酸酶酶解条件:核酸酶用量26.67 U/mL,温度60 ℃,酶解时间为1 h时,酶解转化率为(79.51±1.32)%,较其他水平的高。由图3-b可知,26.67 U/mL,温度60 ℃,酶解时间为2 h时,酶解转化率为(85.71±3.01)%,较其他水平的高,但1 h的酶解率即可达到(81.20±1.88)%,为了节约时间和生产成本,后续实验采用了1 h的作用时间。由图3-c可知,核酸酶用量26.67 U/mL,酶解温度在70 ℃,酶解时间为1 h时,酶解转化率为(84.40±4.32)%,较其他水平的高。比较上述酶解转化率数值,并参考文献的报道,陈雪玉等[18]酶解RNA的水解温度为70 ℃,慕娟[19]以麦芽根为核酸的水解酶源制备核苷酸时,酶解温度也为70 ℃,故将核酸酶用量26.67 U/mL、酶解1 h、温度70 ℃作为后续实验的参考值。

a-酶用量;b-反应时间;c-反应温度图3 酶用量、反应时间和反应温度对豆浆核酸酶解反应的影响Fig.3 Effects of enzyme dosage, reaction time and reaction temperature on nuclease hydrolysis in soymilk
2.5 树脂NUF20结合核酸酶酶解的最佳工艺条件
2.5.1 树脂添加量、反应温度和反应时间对吸附效果的影响
由图4可知,当树脂的添加量逐渐增大时,嘌呤的吸附率也逐渐增大,当树脂添加量达到0.2 g/mL时,吸附率已趋于平稳,反应温度对嘌呤吸附率的影响不是很大,70 ℃时,嘌呤吸附率最大。随着反应时间的增长,嘌呤吸附率先明显上升,1 h的吸附率高达95%以上,后即使时间延长,吸附率仍保持相对平稳。
由表4可见,R1>R2>R3,因素A对嘌呤吸附率的影响最大,其次是因素B、因素C,最佳组合为A3B3C3。但从单因素试验中可以得出,当树脂添加量为0.2 g/mL时,吸附率已趋于平稳;当吸附时间为1 h时,吸附率增加趋势已经不明显。k2与k3相差不大,为节省能耗,缩短生产周期,且考虑到树脂添加量越大以及吸附时间越长,对豆浆的理化与感官性质影响越大,故在树脂添加量为0.2 g/mL、反应温度70 ℃下搅拌吸附1 h,嘌呤平均吸附率(91.73±0.32)%,即豆浆绝大部分嘌呤类物质可被除去。从文献中获知几种对豆浆中嘌呤物质的脱除方法的效果,如CaCl2对豆浆中嘌呤物质的去除率为45.33%[16],活性炭对豆浆中嘌呤物质的脱除率为48.88%[20],CaCl2盐析结合活性炭吸附处理得到的最高嘌呤脱除率65.87%[17]。通过对比可知,本文将树脂吸附和核酸酶酶解核酸相结合的处理方法所得到的嘌呤脱除率较高。
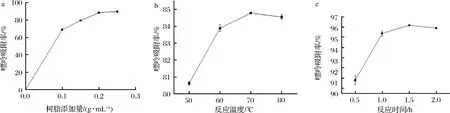
a-树脂添加量;b-反应温度;c-反应时间图4 树脂添加量、反应温度和反应时间对豆浆中嘌呤吸附率的影响Fig.4 Effect of resin addition,reaction temperature and reaction time on purine adsorption rate in soymik
2.5.2 正交实验结果
根据单因素试验结果,确定各因素对应水平见表3。
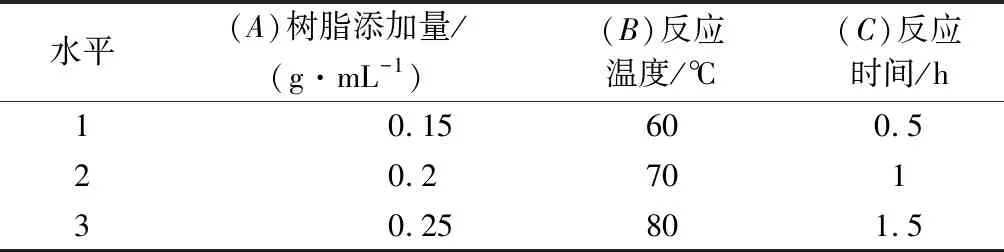
表3 因素水平表Table 3 Factors and levels of orthogonal experiment
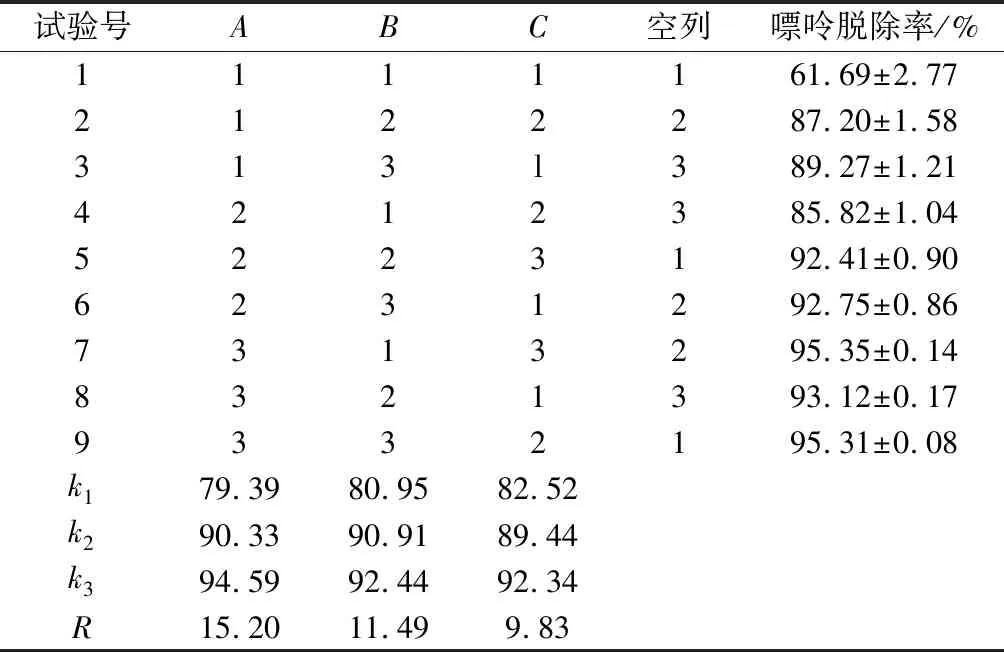
表4 正交实验结果Table 4 Results of orthogonal experiment
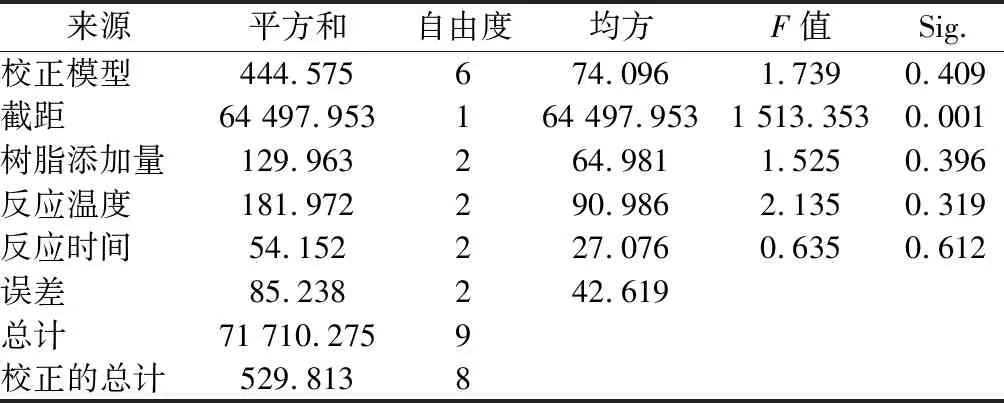
表5 正交试验方差分析表Table 5 ANOVA of orthogonal experiment
2.6 树脂NUF20结合核酸酶酶解技术生产的腐竹成品降嘌呤效果分析
由表6可知,对照组腐竹总嘌呤含量为(1 226.4±8.21)μg/g,不同原材料和生产工艺制作而成的腐竹嘌呤含量有所不同,荣胜忠等[11]测得的腐竹嘌呤含量为(1 598.7±70.6)μg/g。与对照组相比,经过树脂NUF20结合核酸酶酶解技术处理加工的腐竹产品,第1~5张腐竹中总嘌呤含量分别下降(89.70±0.80)%、(88.28±0.72)%、(76.69±0.41)%、(72.03±0.58)%和(65.62±0.47)%。其中,第1、2张腐竹总嘌呤含量分别为126.29和143.48 μg/g,低于普通低嘌呤食品250 μg/g限量。
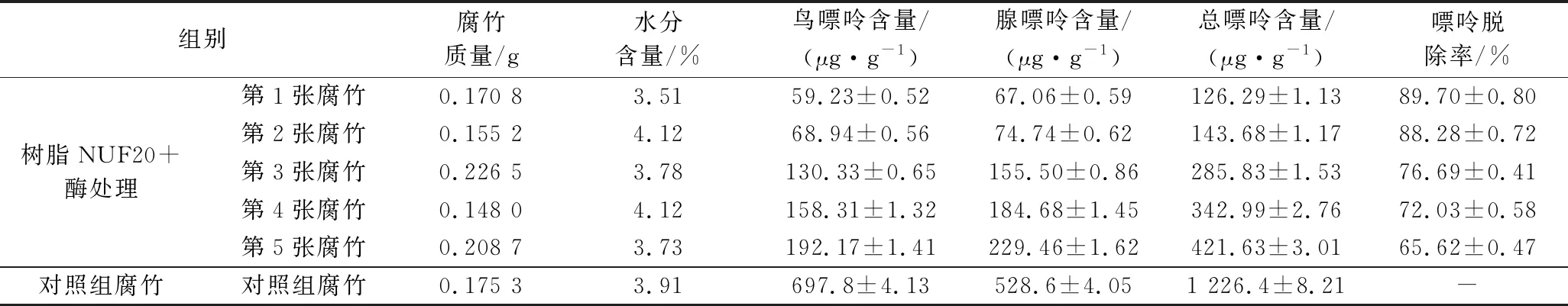
表6 腐竹中嘌呤含量的变化Table 6 Change of purine content in dried beancurd sticks
3 结论
优化得到树脂NUF20结合核酸酶酶解吸附豆浆中嘌呤的工艺条件为:核酸酶26.67 U/mL,树脂添加量0.2 g/mL,反应温度70 ℃下搅拌吸附1 h,豆浆中的嘌呤类物质吸附率最高达98.40%。与对照组相比,经过树脂NUF20结合核酸酶酶解技术处理加工的腐竹产品,第1~5张腐竹的嘌呤含量分别下降89.70%、88.28%、76.69%、72.03%和65.62%,其中第1、2张腐竹总嘌呤含量分别为126.29 和143.48 μg/g,属于低嘌呤食品。据此研究开发出一种适合具高血尿酸症和痛风的特殊人群的低嘌呤腐竹产品,丰富市场上腐竹产品的种类,也扩大了腐竹的消费人群,同时可为其他豆制品中降嘌呤研究提供理论参考,能进一步带动低嘌呤豆制品产业的发展。
