生物-化学法合成维生素D的研究进展
2021-01-20曲丽莎于文文吕雪芹李江华堵国成刘龙
曲丽莎,于文文,吕雪芹*,李江华,堵国成,刘龙*
1(江南大学 未来食品中心,江苏 无锡,214122) 2(糖化学与生物技术教育部重点实验室(江南大学),江苏 无锡,214122)
维生素D(Vitamin D, VD),被称为“阳光维生素”,是维持机体健康所必需的一种脂溶性维生素。麦角钙化醇(ergocalciferol, VD2)和胆钙化醇(Cholecalciferol, VD3)是VD系列化合物中主要的两种存在形式[1]。人体皮肤组织内含有大量的7-脱氢胆固醇(7-dehydrocholesterol, 7-DHC),经紫外光照射后会转变为VD3,该合成途径也是人体获得VD最主要的来源。与VD3可在体内自主代谢合成不同,VD2在人体内无法代谢合成,必须依靠外界的饮食摄取。
VD本身没有生理活性,只有经过羟基化修饰后转变为活性形式才能在人体内发挥生理作用。如图1所示,饮食摄取或人体自身合成的VD3由结合蛋白(vitamin D-binding protein, DBP)从血液转运至肝脏,在肝脏中经细胞色素P450酶羟基化修饰形成25-羟基维生素D3(25-hydroxyvitamin D3, 25(OH)D3),25(OH)D3是VD在人体内的主要循环方式,其浓度是衡量体内VD状况的标准之一。之后25(OH)D3将由DBP再次运输至肾脏并修饰转变为1,25-二羟基维生素D3(calcitriol,1,25(OH)2D3)、24,25-二羟基维生素D3(24,25-hydroxyvitamin D3,24,25(OH)2D3)等活性形式[2]。
VD是骨骼正常生长发育所需的重要营养物质,人体缺乏VD时会导致佝偻病、骨质软化等疾病[3]。VD不仅能够促进钙磷吸收[4],还能作用于大脑神经,预防精神分裂症、自闭、认知障碍和神经退化等疾病[5-8],同时适当补充VD可有效治疗和预防糖尿病[9-10]。此外越来越多的实验证明,VD在治疗免疫性系统疾病、癌症以及心血管疾病等方面也具有良好的生理作用[11-13]。
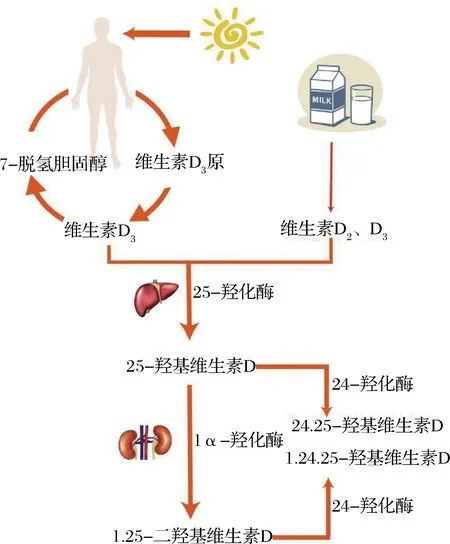
图1 VD活性形式转变示意图Fig.1 Schematic diagram of VD active form transformation
随着VD的各种生理活性不断被发现,VD的全球市场年需求量也在日益增长。目前工业化生产VD的主要方法为半化学合成法,即以胆固醇、麦角固醇、豆甾醇、岩藻甾醇以及孕烯醇酮等为底物,经过简单的化学反应生成[14]。反应底物是半化学合成的重要因素之一,如何大量廉价地获取天然甾醇也是目前工业化生产VD过程中面临的挑战之一。麦角固醇、7-DHC分别是半化学合成VD2及VD3的理想前体,但这些天然甾醇在宿主中的单体含量较少,已渐渐无法满足当下工业化合成VD的生产需求。
合成生物学是以系统生物学和代谢工程学的研究为基础,使用工程化设计思路,将已知或未知的天然生物模块进行构建串联,从而建立全新的人工生物系统。随着合成生物学的迅猛发展,越来越多的代谢机理途径得到阐明,这使得人们可以借助合成生物学在微生物细胞内对宿主固有途径进行调控,协调外源基因表达模块与内源代谢路径模块,平衡各模块之间的代谢流通量,从而在工业规模上实现其高效合成。这种新技术不仅可以满足市场的增长需求,而且绿色环保,是解决资源可持续化问题、提高目标代谢物产量的最佳途径之一。
利用合成生物学技术在微生物体内重构代谢途径是提高产物产量的有效手段。由于提高VD前体甾醇的合成是增加VD得率的关键步骤,因此本篇文章着重介绍当前VD前体合成的新兴技术与手段,主要包括动态调控、亚细胞工程、无细胞系统、定向进化等。
1 VD前体的生物合成进展
1.1 VD前体生物合成途径
如图2所示,甾醇在细胞内的生物合成途径可以分为2个部分,即法尼基二焦磷酸(farnesyl diphosphate,FPP)合成途径与后角鲨烯合成途径[15]。
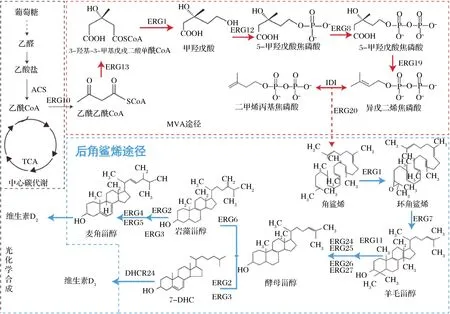
ERG10:乙酰乙酰辅酶A 硫解酶(acetyl-CoA C-acetyltransferase);ERG13:3-羟基-3-甲基戊二酰-CoA合酶(3-hydroxy-3-methylglutaryl-CoA (HMG-CoA) synthase);HMG1:3-羟基-3-甲基戊二酰辅酶A还原酶 (3-hydroxy-3-methylglutaryl coenzyme A reductase);ERG12:甲羟戊酸激酶(mevalonate kinase);ERG8:磷酸甲羟戊酸激酶(phosphomevalonate kinase);ERG19:甲羟戊酸焦磷酸脱羧酶(mevalonate pyrophosphate decarboxylase);IDI1:异戊烯基焦磷酸异构酶(isopentenyl diphosphate isomerase);ERG20:法尼基焦磷酸合酶(farnesyl pyrophosphate synthetase);ERG1:鲨烯环氧酶(squalene epoxidase);ERG7:羊毛甾醇合酶(lanosterol synthase);ERG11:甾醇14α-去甲基化酶(lanosterol 14-alpha-demethylase);ERG24:C-14甾醇还原酶(C-14 sterol reductase);ERG25:C-4固醇甲基氧化酶(C-4 methyl sterol oxidase);ERG26:C-3甾醇脱氢酶(C-3 sterol dehydrogenase);ERG27:C3-酮基还原酶(3-keto sterol reductase);ERG2:C-8 甾醇异构酶(C-8 sterol isomerase);ERG3:甾醇-C5-去饱和酶(sterol C5-desaturase); ERG4:固醇C-24(28)还原酶(C-24(28) sterol reductase);ERG5:固醇C-22-去饱和酶(C-22 sterol desaturase);ERG6:甾醇C-24 甲基转移酶 (Delta(24)-sterol C-methyltransferase)图2 甾醇代谢合成途径Fig.2 Sterol metabolic pathway
原核细胞内的FPP主要通过2-C-甲基-D-赤藻糖醇-4-磷酸(2-methyl-D-erythritol-4-phosphate, MEP)途径代谢合成,而真核生物则是通过甲羟戊酸(mevalonate,MVA)途径合成。真核生物中含有线粒体、内质网等细胞器,有助于关键酶(细胞色素P450酶、异源蛋白酶等)的表达,因此选择真核生物如酿酒酵母(Saccharomycescerevisiae)等为底盘细胞进行甾醇产量的优化调控更为高效[16]。MVA途径以乙酰辅酶A(acetyl coenzyme A,acetyl-CoA)为催化底物,经多步酶作用合成FPP[17]。MVA途径是麦角固醇与7-DHC合成的共同代谢途径,调控MVA代谢途径,提高FPP代谢通量是最终实现甾醇的高效合成的首要方法。HMGR (3-羟基-3-甲基戊二酰辅酶A还原酶,encoding the catalytic domain of 3-hydroxy-3-methylglutaryl coenzyme A reductase)和IDI1都是MVA途径代谢的主要限速酶,增加HMGR与IDI1的表达量能够显著提高FPP的产量[18]。KEASLING等在S.cerevisiae中过表达截短的HMGR(tHMGR),减少了HMG-CoA的积累,进而提高了甲羟戊酸的产量[19]。JIANG等在S.cerevisiae中过表达tHMGR和IDI1,异戊二烯焦磷酸(isopentenyl diphosphate,IPP)和二甲烯丙基焦磷酸(dimethylallyl pyrophosphate,DMAPP)的合成产量明显提高[20]。本课题组前期在枯草芽孢杆菌中通过异源表达kdpG基因,引入外源ED途径,同时替换组成型强启动子的方式强化MEP途径中的关键酶基因dxs、dxr、fni的表达,增强维生素K2前体异戊二烯焦磷酸IPP的含量,最终使维生素K2的产量提高到32 mg/L[21]。
FPP在角鲨烯合成酶的催化下合成角鲨烯,角鲨烯在酶催化作用下代谢合成麦角固醇。麦角固醇是细胞膜的重要组成成分,决定着结构膜的流动性和渗透性。强化ERG1、ERG4、ERG11等基因的表达最终都会提高麦角固醇的发酵产量[22]。POLAKOWSKI等[23]提高细胞的酯化能力,进而增加了酵母胞内的甾醇浓度。Are2基因编码甾醇-酰基转移酶,HE等在S.cerevisiae内同时强化表达了ERG4和Are2p基因,麦角固醇的产量最终达到1 707 mg/L[24]。
麦角固醇的合成途径天然存在于S.cerevisiae内[25],而7-DHC的合成途径需引入外源基因3β-羟基甾醇-D24还原酶(24-dehydrocholesterol reductase, DHCR24)[26]。麦角固醇代谢途径是合成7-DHC的最大竞争途径,抑制或敲除ERG5、ERG6基因可以阻断内源性麦角固醇合成途径[27],促进酵母甾醇的积累,从而有利于7-DHC的高效合成。GUO等在家鸡中分离鉴定出Gg_DHCR24蛋白,异源表达后7-DHC的产量达到64.1 mg/L,之后组合工程技术优化代谢途径7-DHC的产量达到了1.07 g/L[28]。
1.2 代谢工程调控甾醇合成途径
1.2.1 “推-拉-抑制”技术
Acetyl-CoA是碳代谢的关键中间体,其供给水平是决定MVA途径代谢通量的首要因素。增加acetyl-CoA在MVA途径中的供给效率,是近年来代谢工程的研究热点。胞质内的acetyl-CoA是由丙酮酸脱羧化酶(pyruvate decarboxylase,PDC)、乙醛脱氢酶(acetaldehyde dehydrogenase, ALD)、乙醇脱氢酶(alcohol dehydrogenase,ADH)和acetyl-CoA合成酶(Acetyl-CoA synthase, ACS)等多种酶共同催化作用[29]。乙酰CoA推拉抑制策略是通过代谢工程改造天然MVA途径和乙酰CoA途径的常用手段。该策略包括将代谢通量“推”向乙酰CoA的有效产生,即过表达ACS、乙酰乙酰辅酶A硫解酶(acetoacetyl-CoA thiolase, AACT)或者重构非天然代谢途径[30],使得碳代谢通量更多地流向乙酰CoA合成途径;“拉”动乙酰CoA的有效消耗,即过表达tHMGR、IDI1以及异戊二烯合酶(isoprene synthase, ispS)[31-32]。此外,抑制丙酮酸脱氢酶旁路(pyruvate dehydrogenase,PDH)以及乙醇降解途径同样可以显著提高胞质内acetyl-CoA含量[33]。LIAN等[34]在S.cerevisiae中过表达ADH2、ALD6、ACS等基因,使得碳代谢通量最大化地流向acetyl-CoA合成途径,并在此基础上过表达ACL基因,催化柠檬酸生成acetyl-CoA,最终胞内acetyl-CoA的浓度提高了3倍。SU等[35]基于模块化途径工程技术在S.cerevisiae内调控优化acetyl-CoA 的供给水平,最终7-DHC的产量增加了85.44%。
1.2.2 动态调控策略技术
传统的静态调控虽然可以提高目标代谢物的产量,但蛋白表达量的急剧增加会导致部分蛋白无法正确表达其功能,且会引起代谢失衡、有毒中间代谢物积累及细胞生长受损等问题。动态调控是近年来新兴的一种代谢工程改造策略。相比于静态调控,动态调控能够响应细胞内外环境的变化,可以在提高产物合成能力的同时动态协调相关代谢网络的流量分布,从而避免静态调控带来的问题,因此其在近年来受到了人们的广泛关注。
生物传感器是构建动态调控系统的关键。转录因子是最具代表性的生物传感器之一,转录因子是能够结合DNA上游特异核苷酸序列并且调节转录水平的一类蛋白质。转录因子由DNA结合结构域、锌指结构域等多个功能域构成,每个区域在转录调控中都发挥着关键作用。细胞内的基因转录受到大量转录因子的调控,通过调控转录因子对代谢途径优化是动态调控策略的经典思路。转录因子Upc2包含一个N末端锌指结构域和一个C末端配体结合结构域,该结构域可以直接结合麦角固醇以响应胞内的麦角固醇浓度,进而调控麦角固醇的生物合成。当胞内的麦角固醇浓度较高时,Upc2与其结合从而停留在细胞核外;当麦角固醇浓度降低时,Upc2与麦角固醇上解离,并转移到细胞核中以激活麦角固醇相关基因的转录[36]。
天然的生物传感器由于其内源性的特点,在进行表达时会有更好的兼容性。但天然的生物传感器在后续应用中存在着明显的局限性,许多代谢物尚未发现与之对应的天然生物传感器,这极大地限制了动态调控策略的普适性。基于此,研究者们通过结合蛋白质工程和生物传感器技术,创造了一个全新可编程的化学诱导二聚体系统(chemically induced dimerization systems, CIDs)。不同于在已知结构位点的改造,CIDs在蛋白质异二聚体复合物的连接处构建小分子结合位点,并在该聚合体上连接3~4个残基用于与目标配体进行相互作用;之后借助于计算机算法筛选优化相容的蛋白质支架。FPP是MVA代谢合成途径中的重要关键体, 筛选构建FPP生物传感器将具有良好应用性。ANUM等[37]选择FPP作为目标配体,借助于CIDs系统对已有的配体-蛋白结合进行筛选改造,最终得到了响应FPP的生物传感器。
群体感应系统(quorum-sensing, QS)是动态调控策略中另一经典思路,该系统能够较好地平衡细胞生长与代谢产物之间的关系[38]。不同于传统的人工诱导调节,QS能够通过调控代谢产物来响应细胞浓度的变化,即细胞浓度达到一定的阀值范围时,控制代谢途径的开关才会响应表达[39]。图3形象展示了QS系统在酿酒酵母细胞内的应用。THOMAS等[40]在S.cerevisiae内首先以响应芳香氨基酸的启动子ARO9控制表达α信息素基因,使得细胞浓度与α信息素浓度相关联;启动子FUS1可以响应α信息素,因此外源基因的表达由启动子FUS1控制,最终构建出适用于S.cerevisiae的QS系统。WILLIAMS等[41]基于QS系统的基础上,结合RNA干扰(RNA interference, RNAi)技术开发了双向动态调控系统。在酿酒酵母细胞中导入AGO1和DCR1基因,当目标代谢产物途径响应α信息素进行高效表达时,双链发夹结构的RNA(dsRNA)可以靶向任何mRNA,并对其进行降解,使目标基因沉默。因此通过RNAi干扰对竞争代谢支路进行抑制作用,进而更加高效地实现目标代谢物的合成。基于群体响应具有不依赖代谢途径,不需额外添加诱导剂等优势,本课题组前期在枯草芽孢杆菌中利用群体响应系统Phr60-Rap60-Spo0A动态调控脂溶性维生素K2的合成,使细胞的生长、有毒代谢物的积累与维生素K2的高效合成形成相对平衡的状态,使维生素K2的产量相较于野生菌株产量提高40倍,在15 L生物反应器中,第3天的产量达到200 mg/L[21]。
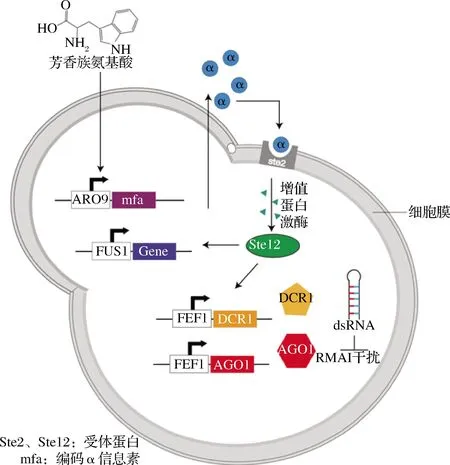
图3 动态调控Fig.3 Dynamic regulation
1.2.3 亚细胞工程
与原核生物相比,真核生物胞内具有内质网、线粒体等细胞器。这些细胞器在微生物生长代谢过程中发挥着重要作用。亚细胞工程就是对某些特定细胞器进行理性改造,使其能够更加有利于目的产物的代谢合成。代谢区室化可以为生物合成途径提供合适的物理化学环境、充足的前体物质和相应的酶。正如图4所示的乙酰CoA,其不仅可以在胞质内生成,还可以在线粒体、过氧化物酶体等多个细胞器中合成[29]。这类细胞器中并没有天然的MVA途径存在,因此在其中重构MVA途径可避免其他支路途径的竞争,提高代谢合成效率,增加FPP合成来源。线粒体基质中氧化还原电位较高,ATP含量丰富,有利于各种生化反应。此外线粒体内的A乙酰CoA浓度是胞质浓度的20~30倍,可以极大地提高MVA途径的代谢通量[42]。DANIELLE等[43]在MVA途径基因N端添加特定的定位氨基酸序列,成功在线粒体内重构完整的MVA途径。LV等[32]以S.cerevisiae为出发菌株,同时调控优化胞质产乙酰CoA途径和线粒体产乙酰CoA途径,促进了细胞生长并且提高了发酵产率。LIU等[44]在S.cerevisiae中发现过氧化物酶体是储存角鲨烯的动态仓库。利用过氧酶体作为亚细胞间室进行角鲨烯合成,使角鲨烯的发酵产量(1 312.82 mg/L)相对于亲本菌株提高了138倍。通过细胞质和过氧化物酶体工程的双重调控,角鲨烯发酵产量进一步提高到1 698.02 mg/L。这表明过氧化物酶体同样具有成为甾醇类生物合成亚细胞工厂的潜能。
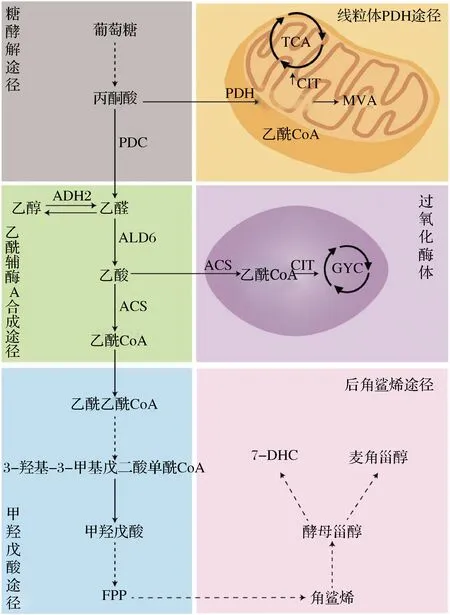
图4 代谢区室化Fig.4 Metabolic compartment
内质网(endoplasmic reticulum,ER)是蛋白质合成和折叠的场所,当蛋白表达量急剧增加时,ER无法平衡其蛋白合成与折叠修饰能力,蛋白质的合成效率降低,部分蛋白合成后无法折叠修饰,此时需扩张ER的尺寸进而来恢复ER的正常生理功能。ER的尺寸调节是通过诱导磷脂合成实现的[45],ER的扩张不仅为细胞提供了额外的空间来容纳结合蛋白,而且还提高了蛋白质合成的能力。细胞色素P450是典型定位于内质网的蛋白酶,强化基因INO2的表达时,内质网尺寸会明显扩张,该类蛋白酶的活性也会因此显著提高。因此对于含有细胞色素P450酶的代谢途径,内质网是理想的改造目标。
1.2.4 无细胞系统
通过微生物代谢工程做到生物制品的可持续、低成本的生产是实现工业化的必然趋势。而当前技术存在的常见问题包括有毒中间体或产物的积累、关键前体在竞争途径中的损失、最终产品的回收昂贵等[46]。为了克服这些局限性,无细胞代谢工程应运而生,其无需使用完整的细胞即可进行精确的复杂生物分子合成。通过使用体外纯化的酶或粗裂解物制备的催化蛋白集合体来扩展传统生物工程模型的范围,以生产目标产物[47]。图5简单介绍了传统代谢工程和无细脆代谢工程之间的差别。由于已知每种酶组分的浓度和活性,此系统可以精确控制反应条件和途径通量。研究表明,通过无细胞系统可提高MVA途径中间体和目的产物的合成。RODRIGUEZ等[48]利用无细胞代谢工程对MVA途径进行改造,同时对酶底物和产物进行及时回收,能够生产40 g/L的DMAPP和IPP。
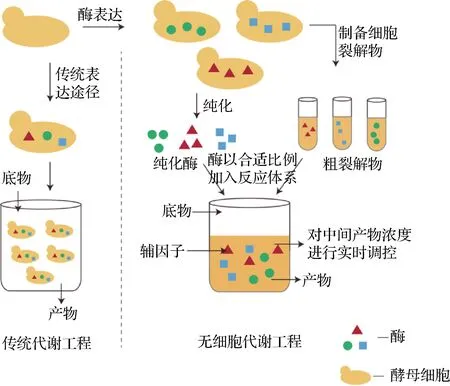
图5 无细胞系统Fig.5 Cell-free system
从生物制造的角度来看,无细胞系统将细胞生长与代谢产物生产分开,并将所有碳通量转移到产物上,可以实现更高的产率和回收率,并且更容易控制反应条件。但是,对于一个需要大量酶参与反应的途径来说,利用无细胞系统成本较高,辅因子和酶的再生也是一个不可忽视的挑战。另外,目前体外系统的成本远超体内方法的成本,限制了规模的扩大,因此大多数无细胞系统尚未应用在工业化生产上。
1.2.5 定向进化
定向进化是改善微生物性能的有效方法之一,旨在筛选符合预期的正向突变体。定向进化首先需建立基因突变库,之后结合与高通量筛选方法快速提升蛋白的特定性质,是目前最为常用的蛋白质设计改造策略[49]。基因突变库的构建手段主要包含随机突变、半理性设计和DNA改组等。易错PCR是目前最常用的随机突变方法之一,其通过改变PCR反应条件,降低DNA聚合酶的保真性,从而提高PCR反应的突变率,使错误的碱基以一定的频率随机地掺入到扩增的基因产物中,得到DNA突变文库;随后结合高通量筛选方法筛选出符合预期目标的突变基因[50]。IDI是甾醇代谢途径中的关键限速酶之一,天然的IDI酶活性低,半衰期短,底物亲和力弱。CHEN等[51]通过易错PCR以及组合位点特异性饱和诱变,筛选得到正向突变体,突变体IDI的Km比亲本IDI的Km降低了10%,Kcat比原IDI提高了28%。
相比于易错PCR的体外建库,ICE(Invivocontinuous evolution)是一种应用于真核生物体内的定向进化策略。该策略利用酵母细胞中天然存在的Ty1转座子,扩展酵母体内的诱变系统。将需进化的目标基因克隆至可诱导的Ty1反转录转座子的基因组中,之后逆转录酶将Ty1基因组以非高保真形式逆转录为cDNA,然后重新整合至基因组中。CROOK等[52]以S.cerevisiaeBY4741(Δrrm3)为出发菌株,基于ICE技术以木糖代谢途径作为进化目标,发现全局代谢途径进化的最适突变体并非该途径中单个酶最佳突变体的简单叠加。
随机突变的局限性在于所需的突变文库较大,并且产生的绝大多数突变体不符合预期性能或性能不佳。而半理性设计可以在人工选择的特定位置或区域内进行随机突变,可以大大缩小突变文库的容量,更易于筛选。FISCHER等[53]对ERG20进行同源模建,发现第197位的赖氨酸(Lys)是关键活性位点,之后以代谢物香叶醇产量作为酶活的间接表征方法,对该位点进行了一系列的定点突变,最终香叶醇的发酵产量提高约10~20倍,间接证明了突变后的ERG20酶活的显著提高。
与ICE策略类似,EvolvR系统可以实现胞内的定点突变[54]。该系统包含一个含有导向序列(gRNA)的质粒,改造后的enCas9蛋白(改造后其与非特异性DNA的亲和力降低),以及与enCas9蛋白融合表达的非高保真DNA聚合酶。当gRNA引导enCas9-DNA聚合酶融合蛋白至基因组上的靶向位点时,enCas9蛋白与靶基因结合使DNA双链断裂,然后非高保真DNA聚合酶对切口进行靶向突变。EvolvR可以同时对多个靶向基因进行定点突变,且在酵母细胞中具有传代时间短、细胞生长繁殖快速等优势。EvolvR技术为高等真核生物体内定向突变提供了一个高效的平台,但该技术目前仍存在一定的缺陷性,即胞内会存在游离的非高保真DNA聚合酶对整个基因组进行低概率的突变,因此距离实现完全定向的突变仍具有一定的距离。
定向进化是当前备受瞩目的研究热点领域。通过对蛋白质进行多轮突变、表达和筛选,引导蛋白质的性能朝着预期方向进化,进而大幅缩短蛋白质进化的过程[55]。但定向进化存在的最大挑战即是如何建立适宜高效的筛选方法,目前较为普遍的筛选方法是选择适合的生物传感器, 并以荧光基因表征突变结果。但如前文所述,许多代谢物目前仍未有与之响应的生物传感器,无法结合高通量筛选技术,这也成为定向进化技术提高应用普适性的难题之一。
2 光化学合成VD
VD是由关键前体甾醇经过光化学开环反应产生的。VD的光合作用是一个由多条异构化反应组成的复杂分支网络。
麦角固醇转化为VD2的过程中,影响VD2的转化率关键在于光源的选择和光转化器构造。目前国内光源的选择一般选用低压和高压汞灯两种。在VD2的光化学反应中波长的选择很重要。275~300 nm波长范围内,280~284 nm的紫外光有利于生成VD2,短于280 nm的光易于生成速甾醇,而长于284 nm的光容易生成光甾醇,VD2过度照射,过度辐射还会生成毒甾醇等物质[56],因此VD2的光转化中荧光灯的波长范围要求极其严格。图6展示了VD在光照条件下的像话转化。研究发现,波长为283 nm的低压汞蒸气紫外荧光灯照射麦角固醇,转化效果最佳,麦角固醇转化率50%以上,VD2收率在70%以上[57]。
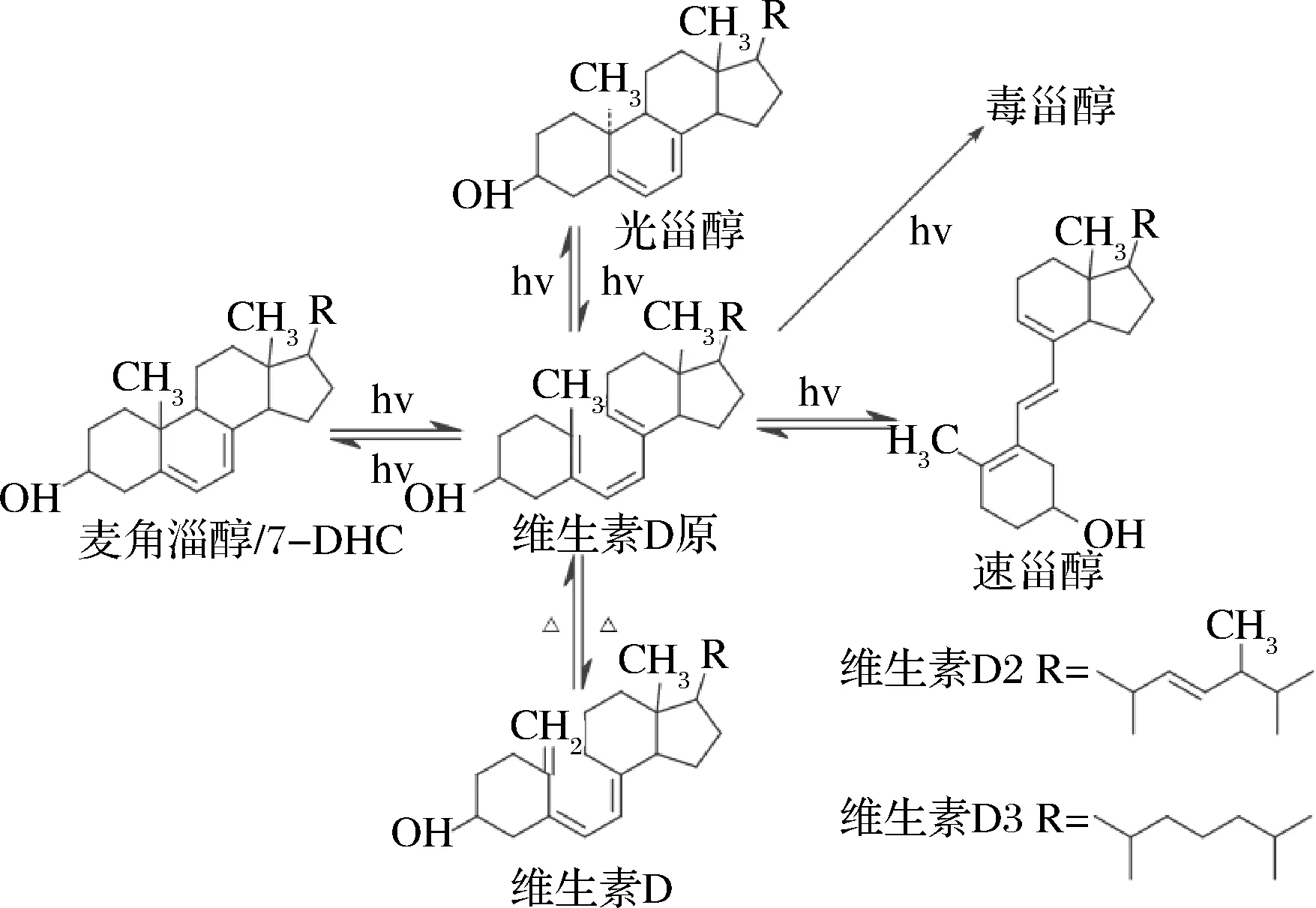
图6 VD的光化学反应Fig.6 Photochemical reaction of VD
7-DHC则会被290~315 nm波长的光子异构化为VD3,这与紫外线B (UVB)的电磁波谱范围相对应。FUSEO等提出利用连续微流系统合成VD3[58],与传统的两步法合成VD3不同,该方法在微反应器中可以同时进行光反应和热反应。7-DHC在反应器中光异构化后转化为维生素原D3,维生素原D3继续热异构化转化为VD3。相比于传统光合成法,该方法收率高(HPLC-UV:60%,分离率:32%),操作简便且无需纯化中间产物维生素原D3,具有良好的工业应用价值。
3 展望
随着人们逐渐意识到VD对于维持机体健康的重要意义,其全球年市场需求量也因此持续增加,但关键前体甾醇的供给不足却成为限制VD产能扩大的主要因素之一[59-60]。随着合成生物学的发展,在细胞内调控重构甾醇代谢途径,利用微生物发酵的方式制备甾醇成为解决甾醇可持续平稳供给的有效技术之一。
本文着重从推-拉-抑制、动态调控、亚细胞工程、无细胞系统、定向进化等方面阐述了代谢工程技术在甾醇代谢调控领域的研究应用。然而这些方法虽能够显著地提高甾醇代谢途径的催化效率与产量,但仍有些许方面值得进一步研究与探索:
(1)如何高效实现酶的催化活性?
酶的丰度和活性共同决定了酶的催化效率,过表达基因增加酶的丰度虽然在一定程度上可以提高酶的催化效率,但当丰度达到一定阈值后,酶的催化活性却无法继续提高,其主要因素之一就是忽视了辅因子在代谢途径中的关键作用[61]。MVA途径代谢过程中需要NADPH、ATP等辅因子的参与[62],因此在提高酶丰度的同时需增加NADPH、ATP等辅因子的供给。调控NADH激酶、NADP+依赖型脱氢酶增强NADPH合成途径,重构、替换消耗NADPH的支路代谢途径,使得NADPH等辅因子最大化地流向MVA代谢途径。辅因子的相对平衡是维持细胞内环境稳态的重要条件之一,而胞内全局的辅因子调控则需要对辅因子的合成、分布、运输和调节机制完全了解。
(2)如何实现甾醇代谢途径的整体定向进化?
定向进化可以改善细胞鲁棒性,优化细胞性能。然而目前定向进化主要集中于 “点”的进化,即对某一特定酶的改造。但代谢途径的催化效率并非是各种酶的简单叠加,每个“点”在整个代谢途径中需要的是最适的催化效率而非最高的催化效率。甾醇合成途径包含MVA途径、后角鲨烯途径等,涉及到多种蛋白酶,且许多中间代谢物没有与之特异响应的生物传感器,无法建立合适的高通量筛选方法。ICE与CIDs策略的交叉结合将成为解决这一难题的突破口,ICE策略有望实现甾醇代谢途径的全局性进化,而CIDs策略则可以计算、模拟、构建出非天然的生物传感器,建立高效、简便的高通量筛选方案。
(3)如何真正实现从头合成VD?
目前工业化制备VD的方法是以甾醇为前体,再经过化学合成得到VD。如何在细胞内真正实现从头合成VD将会是未来研究的热点与难点,其关键在于是否能够鉴定或人工设计出特定的酶来实现光化学合成这一步骤的功能[63]。酶工程是一种具有针对性的策略,借助蛋白质晶体结构和计算机模拟,酶工程可以提高酶的特异性和效率,甚至为特定的反应创造非天然的酶[64]。随着结构生物学的发展,越来越多的催化酶晶体结构得到了解析,这为鉴定未知酶、构建非天然酶提供了可行性基础。
