玉米蛋白水解物免疫活性的研究
2021-01-20高健林巍刘晓兰刘祥郑喜群李冠龙
高健,林巍,刘晓兰,刘祥,郑喜群,李冠龙
1(齐齐哈尔大学 食品与生物工程学院,黑龙江 齐齐哈尔,161006) 2(黑龙江省玉米深加工理论与技术重点实验室,黑龙江 齐齐哈尔,161006) 3(黑龙江八一农垦大学 食品学院,黑龙江 大庆,163319)
随着人类对食品功能性认识的不断深入,“食品”不仅仅是传统意义上供人类食用或饮用以满足人类果腹的物品,更承担起改善人体亚健康、调节人体机能的作用。研究发现,许多谷物蛋白来源的肽具有良好的免疫活性,不仅可以促进淋巴细胞分化成熟、转移免疫信息、增强机体免疫机能,还可以增强巨噬细胞吞噬能力,进而提高机体抵御外界病原体感染的能力,降低机体发病率[1]。刘剑利等[2]研究发现小米多肽可以刺激小鼠的淋巴细胞转化,且在灌胃剂量为500和1 000 mg/(kg·d)时,半数溶血值(half hemolytic concentration,HC50)和巨噬细胞吞噬能力与对照组有显著差异(P<0.01),表明小米多肽可以调节小鼠免疫能力;代卉等[3]发现小麦肽可以调节环磷酰胺致免疫抑制小鼠的免疫及抗氧化功能,发现100 mg/(kg·d)的小麦肽可以缓解免疫抑制小鼠应激状态所引起的机体抗氧化体系紊乱及免疫功能的降低,提高抗体生成细胞含量和腹腔巨噬细胞吞噬能力;刁静静等[4]研究发现,小分子绿豆肽在质量浓度为200 mg/mL时具有促进巨噬细胞的增殖、上调巨噬细胞中细胞因子表达量等功能,免疫效果良好。
玉米蛋白粉是玉米湿法生产淀粉的副产物,其蛋白质含量在60%以上,主要为醇溶蛋白(68%)[5],但水溶性差、气味特殊等特点限制了其在食品领域的应用。玉米蛋白的多肽链存在多个功能区,具有抗氧化[6]、降血压[7]、抗疲劳[8]、抗肿瘤[9]、促乙醇代谢及护肝[10]等多种生物活性,但目前关于玉米蛋白水解物(corn gluten hydrolysate,CGH)的研究主要集中于其抗氧化活性及护肝作用,其他活性研究尚需开展,尤其是其免疫调节活性。玉米蛋白粉含有丰富的疏水性氨基酸,且其水解物具有良好的抗氧化活性[11-13],而目前大量关于免疫活性的研究发现,免疫活性物质通常具有疏水性氨基酸[14],且同时有着很好的抗氧化活性。朱科学等[15]研究发现,菠萝蜜多糖可以提高正常小鼠脾淋巴细胞的抗氧化及免疫功能,可显著促进脾淋巴细胞抗肿瘤因子-α(tumor necrosis factor-α,TNF-α)、干扰素-γ(interferon-γ,IFN-γ)和白细胞介素-1β(interleukin-1β,IL-1β)的分泌;王君巧等[16]研究发现,黑灵芝多糖可以拮抗环磷酰胺对小鼠免疫功能的抑制作用,提高TNF-α含量和IL-2含量,还可提高免疫抑制小鼠的抗氧化功能,提升脾组织中超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、总抗氧化能力(total antioxidant capacity,T-AOC)和降低丙二醛(malonic dialdehyde,MDA)含量;包晓玮等[17]发现甜菜红素对正常小鼠体内抗氧化能力及免疫功能具有调节作用,可以提高小鼠血清中SOD、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)的含量,降低MDA的含量,还可以提高正常小鼠脾淋巴细胞增值能力、血清溶血素和自然杀伤(natural killer,NK)细胞活性。
本文以玉米蛋白粉为研究对象,预处理后通过双酶分步水解获得CGH,研究CGH体外脾淋巴细胞增殖活性,以及其对免疫抑制小鼠免疫调节作用的影响,为CGH在食品保健及医药领域的应用和玉米蛋白粉的深入开发提供理论依据。
1 材料与方法
1.1 材料与试剂
玉米蛋白粉,黑龙江龙凤玉米开发有限公司;α-淀粉酶,北京奥博星生物技术责任有限公司;复合蛋白酶、碱性蛋白酶,丹麦诺维信公司;RPMI-1640培养基,Gibico公司;胎牛血清,BI公司;二甲基亚砜(dimethyl sulfoxide DMSO)、红细胞裂解液,索莱宝公司;刀豆球蛋白A(concanavalin,Con A),BBI公司;Hank’s液、3-(4,5-二甲基-2噻唑基)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2H-tetrazolium bromide,MTT),上海生工生物工程有限公司;清洁级ICR小鼠(20±2)g,春亿斯实验动物技术有限责任公司[生产许可证为SCXK(吉)-2019-0004];环磷酰胺(cyclophosphamide,CTX),江苏盛迪医药有限公司; SOD、GSH-Px、CAT、MDA、TNF-α、IFN-γ、IL-2和IL-6 ELISA试剂盒,上海江莱生物科技有限公司。
1.2 仪器与设备
PC/PLC-LD-53冷冻干燥机,美国MILLROCK公司;TCL-16G型台式离心机,上海安亭科学仪器厂;CT15RE型高速冷冻离心机,天美科学仪器有限公司;DF-1型集热式磁力加热搅拌器,江苏省金坛市荣华仪器制造有限公司;SW-CJ-2FD超净工作台,苏州安泰公司;SX-500高温蒸汽灭菌锅,日本TOMY公司;DynamicaV 14R高速离心机,澳大利亚Dynamica公司;EnSpire多功能酶标仪,珀金埃尔默股份有限公司。
1.3 CGH制备
参考本课题组前期已经确定的方法[18]。称取一定量的去淀粉预处理后的玉米蛋白粉,用50 mmol/L pH 7.0的Tris-HCl缓冲液配制成质量浓度为100 g/L的玉米蛋白悬浮液,用复合蛋白酶和碱性蛋白酶分步水解。复合蛋白酶[酶解条件:加酶量2.5%(质量分数)、pH 7.0、温度50 ℃]酶解3 h后用2 mol/L NaOH溶液调pH至8.5,加入碱性蛋白酶。碱性蛋白酶[酶解条件:加酶量2.5%(质量分数)、pH 8.5、温度60 ℃]酶解2.5 h后将酶解液于沸水中灭酶15 min,于3 000 r/min离心20 min,取上清液得到CGH。水解过程中使用1 mol/L NaOH溶液保持2种酶反应体系pH的恒定。将得到的CGH进行纳滤脱盐,冷冻干燥后备用。
1.4 体外培养脾淋巴细胞增殖实验
1.4.1 脾淋巴细胞悬液的制备
将正常饲喂的小鼠引颈处死后,用体积分数为75%的乙醇浸泡10 min,将小鼠置于平皿中,在超净台上获取脾脏,剪去脂肪和多余的筋膜,用镊子将脾在盛有适量无菌Hank,s液的平皿中撕碎研磨,制成脾细胞悬液。200目筛网过滤后按照红细胞裂解液说明书加入裂解液2~3次,每次室温放置3 min后,1 000 r/min离心5 min去除红细胞,得到单细胞悬液。将此细胞悬液用磷酸缓冲盐溶液洗涤3次,每次1 000 r/min离心5 min,重悬于RPMI-1640完全培养基中,置于 37 ℃、5% CO2培养箱中,培养2 h,去除贴壁细胞后即为脾淋巴细胞悬液,台盼蓝染色计数,活细胞数在95%以上。
1.4.2 体外脾淋巴细胞增殖的测定
制备密度为5×106个/mL脾淋巴细胞悬液,接种于96孔板中。设置对照孔(100 μL细胞悬液+100 μL RPMI-1640培养基)、Con A孔(100 μL细胞悬液+100 μL Con A RPMI-1640溶液,调整Con A终质量浓度为5 μg/mL)、实验孔(100 μL细胞悬液+100 μL CGH RPMI-1640溶液,调整CGH终质量浓度为20、40、80、160和320 μg/mL),每组设6个复孔,设置3个平行实验。将上述孔板置于无菌室中,在37 ℃、5% CO2饱和湿度培养箱中培养48 h,培养结束前4 h每孔加入20 μL 5 mg/mL MTT,继续培养4 h。培养结束后弃去上清液,每孔加入150 μL DMSO溶液溶解 MTT作用活细胞所产生的甲瓒沉淀,使用微孔板振荡仪于37 ℃振荡混匀10 min,待紫色沉淀完全溶解后用酶联免疫检测仪检测各孔在570 nm波长处的吸光度A570。
1.5 动物实验分组及给药方法
ICR雌性小鼠60只,适应性生长4 d后,随机分为5组:正常对照组、CTX模型组、CTX+CGH低剂量组、CTX+CGH中剂量组和CTX+CGH高剂量组。其中,正常对照组和CTX模型组灌胃生理盐水,CTX+CGH低剂量组、CTX+CGH中剂量组和CTX+CGH高剂量组分别灌胃50、100、200 mg/(kg·d)的CGH溶液,每日定时灌胃1次,连续21 d。5组均正常摄食摄水,按1只小鼠4~8 g喂食,且在处死前禁食不禁水12 h。第21 天时,CTX模型组、CTX+CGH低剂量组、CTX+CGH中剂量组和CTX+CGH高剂量组腹腔注射200 mg/(kg·d)的CTX,正常对照组腹腔注射等量生理盐水,5组均于24 h后处死。
1.6 免疫抑制小鼠血清中细胞因子水平的测定
各组小鼠分别眼球取血,室温静置过夜析出血清,于4 ℃,3 000 r/min离心10 min分离血清,收集血清于2 mL Eppendorf管中,-80 ℃保存备用。将各组血清解冻后,严格按照TNF-α、IFN-γ、IL-2和IL-6的ELISA试剂盒说明书进行操作,测定免疫抑制小鼠血清中细胞因子TNF-α、IFN-γ、IL-2和IL-6水平。
1.7 免疫抑制小鼠体内抗氧化活性的测定
将各组血清解冻后,严格按SOD、GSH-Px、CAT和MDA的ELISA试剂盒说明书进行操作,测定免疫抑制小鼠血清中SOD、GSH-Px、CAT和MDA水平。
1.8 统计学处理
实验数据以平均值±标准差表示。采用SPSS 17.0软件进行单因素方差分析,显著水平为P<0.05。
2 结果与分析
2.1 CGH对体外脾淋巴细胞增殖的影响
脾淋巴细胞体外增殖实验结果如图1所示,结果表明,脾淋巴细胞增殖率随着CGH质量浓度的增加而增加,呈剂量依赖性,CGH终质量浓度在80~320 μg/mL时,与对照组(终质量浓度为0 μg/mL)相比差异显著(P<0.05),且质量浓度在80 μg/mL时,与质量浓度为5 μg/mL的Con A无显著差异(P>0.05),质量浓度在320 μg/mL时,脾淋巴细胞增殖率提高至192.16%,促增殖效果良好。
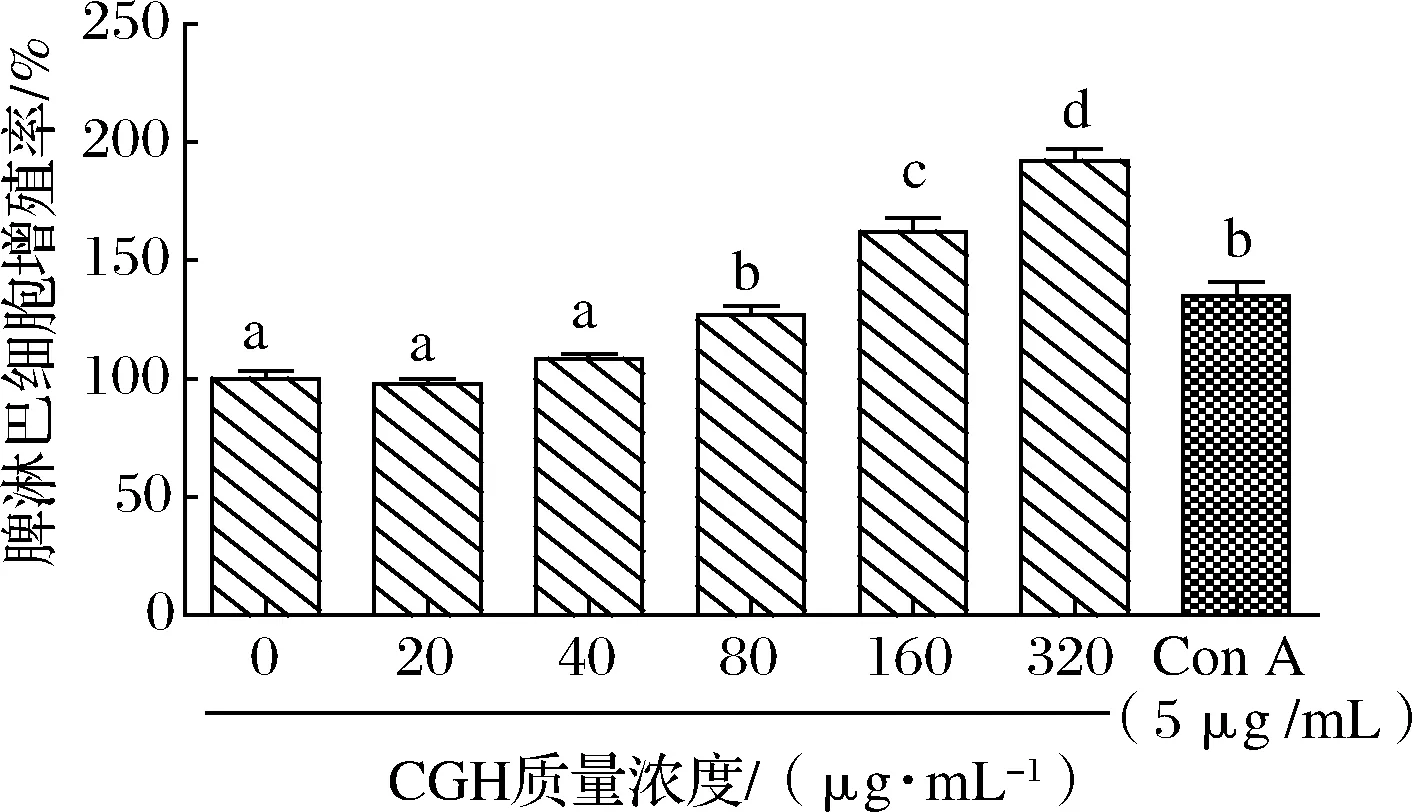
图1 CGH对体外脾淋巴细胞增殖的影响Fig.1 Effects of CGH on proliferation of spleen lymphocytes in vitro 注:不同小写字母表示样本间差异有统计学意义(P<0.05)(下同)
2.2 CGH对免疫抑制小鼠血清中细胞因子的影响
CGH对免疫抑制小鼠血清中细胞因子的影响如图2所示,CTX模型组TNF-α、IFN-γ、IL-2和IL-6含量与正常对照组相比均显著降低(P<0.05),说明CTX对免疫调节网络造成破坏,打破小鼠体内免疫系统的平衡,各项细胞因子均大幅下降,小鼠的免疫功能被抑制,建模效果良好。
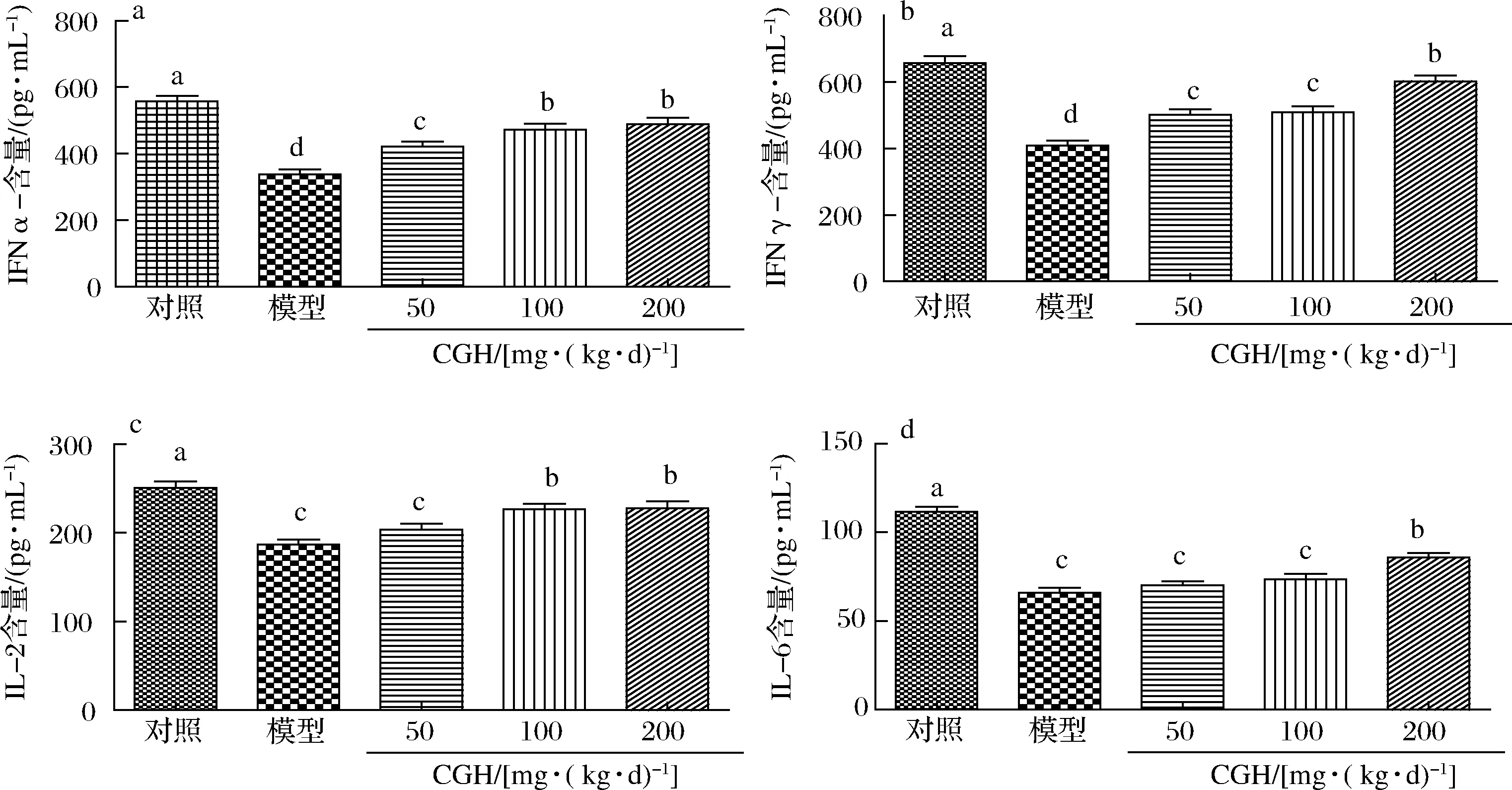
a-TNF-α;b-IFN-γ;c-IL-2;d-IL-6图2 CGH对免疫抑制小鼠血清中细胞因子的影响Fig.2 Effect of CGH on serum cytokines in immunosuppressed mice
CGH对免疫抑制小鼠血清中TNF-α的影响如图2-a所示,CTX+CGH低、中、高剂量组TNF-α含量与模型组相比显著提高(P<0.05),且随着CGH质量浓度的增加TNF-α含量增高,其中CTX+CGH高剂量组血清中TNF-α含量较模型组提高1.44倍,为(488.24±77.06)pg/mL。
CGH对免疫抑制小鼠血清中IFN-γ的影响如图2-b所示,CTX+CGH低、中、高剂量组IFN-γ含量与模型组相比显著提高(P<0.05),高剂量CGH使免疫抑制小鼠IFN-γ含量由(408.46±65.18)pg/mL提高至(602.01±71.05)pg/mL。
CGH对免疫抑制小鼠血清中IL-2的影响如图2-c所示,CTX+CGH中、高剂量组IL-2含量与模型组相比显著提高(P<0.05),由模型组的(186.53±25.72)pg/mL分别提高至(226.50±26.99)、(227.66±30.48)pg/mL,CTX+CGH低剂量组IL-2含量与模型组无显著性差异(P>0.05)。
CGH对免疫抑制小鼠血清中IL-6的影响如图2-d所示,CTX+CGH高剂量组IL-6含量与模型组相比显著提高(P<0.05),提高了1.30倍,而CTX+CGH低剂量组、CTX+CGH中剂量组IL-6含量与模型组无显著差异(P>0.05)。
2.3 CGH对免疫抑制小鼠体内抗氧化活性的影响
机体的抗氧化能力与免疫功能关系密切,抗氧化能力的强弱对维持机体的健康有着重要作用。正常生理状态时,自由基不断产生,并通过SOD和GSH-Px不断清除,处于动态平衡[19-20],当对机体注射CTX后,CTX可以打破这种平衡,引起机体的氧化应激[21]。在体内实验中,检测抗氧化关键酶SOD、GSH-Px、CAT和脂质过氧化产物MDA可以反映CGH的体内抗氧化水平,结果如图3所示。
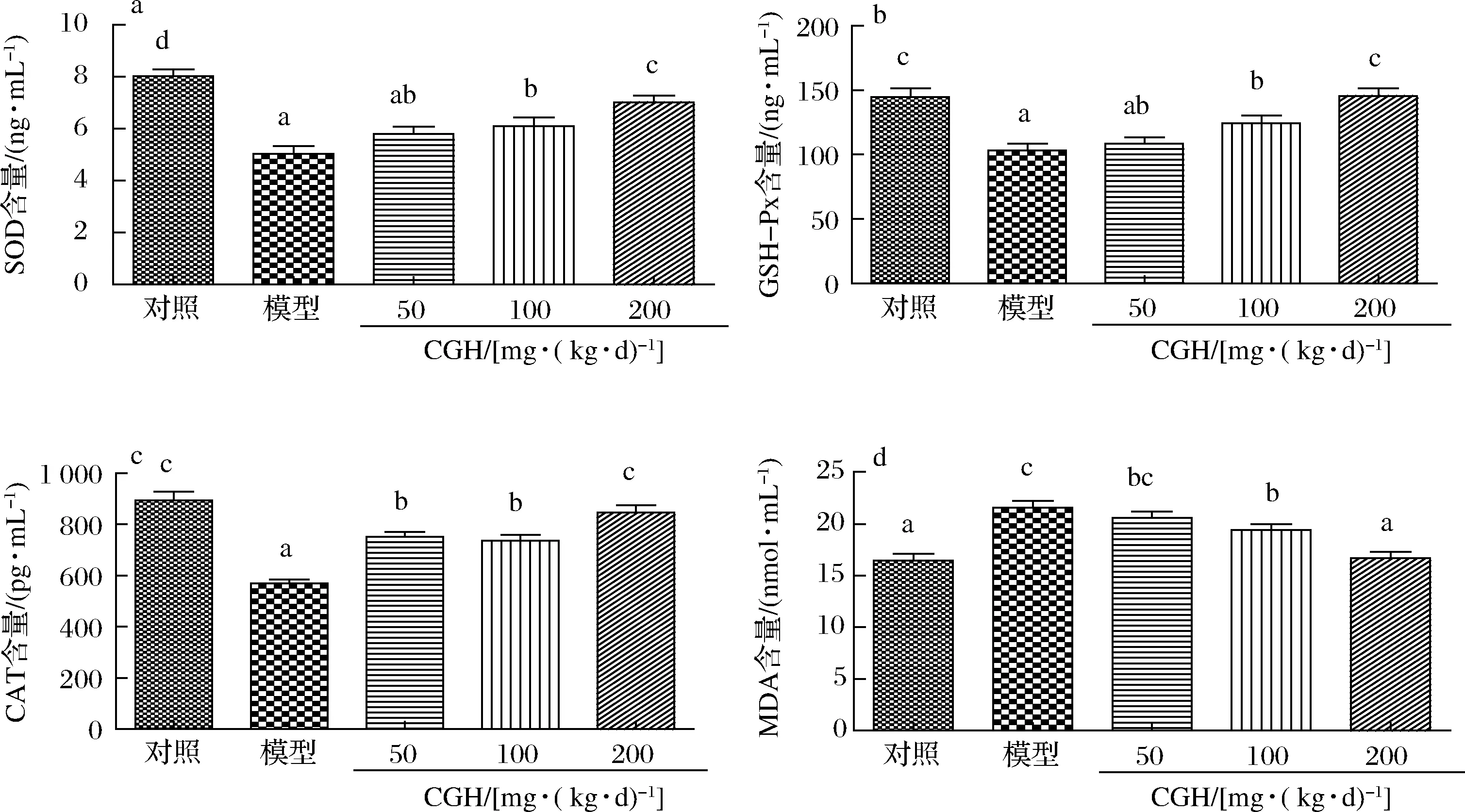
a-SOD;b-GSH-Px;c-CAT;d-MDA图3 CGH对免疫抑制小鼠体内抗氧化活性的影响Fig.3 Effect of CGH on antioxidant activity in immunosuppressed mice
CGH对免疫抑制小鼠血清中SOD的影响如图3-a所示,CTX模型组血清中SOD含量与正常对照组相比显著降低(P<0.05),其中CTX模型组血清中SOD含量为(5.04±0.84)ng/mL,较对照组降低1.60倍,SOD含量的显著降低表明CTX会引起体内超氧自由基富集,说明CTX会损伤免疫细胞,影响机体正常免疫反应的进行。CTX+CGH中、高剂量组SOD含量与模型组相比显著提高(P<0.05),CTX+CGH低剂量组的SOD含量与模型组无显著差异(P>0.05)。
CGH对免疫抑制小鼠血清中GSH-Px的影响如图3-b所示,CTX模型组血清中GSH-Px含量与正常对照组相比显著降低(P<0.05),由(147.80±19.49)ng/mL降低至(103.23±15.21)ng/mL,体内GSH-Px含量的减少说明CTX会影响有毒过氧化物的分解,从而对免疫细胞产生毒副作用,抑制机体正常的免疫功能。CTX+CGH中、高剂量组GSH-Px含量与模型组相比显著提高(P<0.05),分别较模型组提高1.21倍和1.41倍,CTX+CGH低剂量组GSH-Px含量与模型组无显著差异(P>0.05),CTX+CGH高剂量组GSH-Px含量与正常对照组相比无显著差异(P>0.05)。
CGH对免疫抑制小鼠血清中CAT的影响如图3-c所示,CTX模型组血清中CAT含量与正常对照组相比显著降低(P<0.05),腹腔注射CTX后,CAT含量会迅速下降,由(946.61±69.41)pg/mL降低至(568.86±46.54)pg/mL,使细胞受到过量H2O2的毒害,同样对机体的免疫系统造成损坏。CTX+CGH低、中和高剂量组CAT含量与模型组相比均显著提高(P<0.05)。
CGH对免疫抑制小鼠血清中MDA的影响如图3-d所示,CTX模型组血清中MDA含量与正常对照组相比显著升高(P<0.05),CTX注射后,血清中MDA含量提高1.39倍,这些过量的MDA会通过多种途径对细胞尤其是免疫细胞造成损伤,还会对机体的免疫功能产生抑制作用。CTX+CGH中、高剂量组MDA含量与模型组相比显著降低(P<0.05),CTX+CGH高剂量组降低至(16.67±1.81)nmol/mL,与正常对照组相比无显著差异(P>0.05),CTX+CGH低剂量组MDA含量与模型组无显著差异(P>0.05)。
3 讨论
脾脏是机体内形体最大的淋巴器官,脾的内部分为白髓和红髓,表皮则有一层结缔组织形成的被膜,脾淋巴细胞主要聚集在白髓中,脾淋巴细胞中含有T淋巴细胞和B淋巴细胞,均是机体的免疫活性细胞,免疫细胞的活化是免疫细胞参与免疫的重要体现[22]。免疫细胞在活化后有不同的表现,T淋巴细胞活化的重要表现之一就是T淋巴细胞的分裂增殖及分化,所以T淋巴细胞的增殖率是反映细胞免疫最直接的指标。本实验研究结果表明,与Con A阳性对照组相比,160 μg/mL的CGH能更好的促进脾淋巴细胞体外分裂增殖及分化,推断CGH可作为淋巴细胞的有丝分裂原,促进淋巴细胞增殖,进而发挥其免疫增强活性,对增强机体的免疫功能具有重要的意义。
细胞因子是一类由多种免疫细胞和一些非免疫细胞分泌的,最终作用于细胞的多肽、小分子蛋白或糖蛋白,能参与并调节机体免疫应答、细胞分化、造血、肿瘤免疫等多种生理及病理过程[23]。本实验选取淋巴细胞产生的IFN-γ、IL-2以及单核细胞或巨噬细胞产生的TNF-α和IL-6作为研究指标。TNF-α是血清中一种能使肿瘤发生出血性坏死的物质,主要来源于各种免疫细胞、内皮细胞、成纤维细胞,TNF-α在生物学上应用广泛,不仅有对肿瘤细胞造成损伤、强化中性粒细胞的吞噬能力,还可以增加过氧化物阴离子产生,刺激细胞脱颗粒和分泌髓过氧化物酶、抗感染,并诱导肝细胞急性期蛋白的合成[24],CGH低中高剂量时均可显著提高免疫抑制小鼠的TNF-α含量。IFN-γ为Ⅱ型干扰素,主要由活化的T淋巴细胞和NK细胞产生,IFN-γ可通过激活单核吞噬细胞杀灭微生物及肿瘤细胞,激活中性粒细胞和NK细胞,强化NK细胞对肿瘤细胞的杀伤活性,促进巨噬细胞的吞噬功能,抑制自分泌生长因子的形成和活性,抑制宿主向肿瘤细胞提供重要的营养因子或生长因子,从而造成肿瘤细胞的凋亡[25],CGH低中高剂量时均可显著提高免疫抑制小鼠IFN-γ的含量。IL-2能刺激T辅助细胞和NK细胞产生细胞因子,促进细胞因子的繁殖以及刺激T细胞在体外生长等功能[26],CGH中高剂量时均显著提高免疫抑制小鼠IL-2的含量。IL-6在多种细胞功能调节方面具有重要的作用,包括细胞分化、增殖、免疫防御、造血功能、神经系统等,IL-6与肿瘤细胞的生长、增殖密切相关,通过对肿瘤细胞的黏附性、活动力、增殖以及特异性抗原的表达,控制肿瘤的发展[27],CGH高剂量时可显著提高免疫抑制小鼠IL-6的含量。结果表明,CGH高剂量时可显著促进免疫抑制小鼠血清中TNF-α、IFN-γ、IL-2和IL-6含量的提高,拮抗CTX对小鼠免疫功能的抑制作用。
抗氧化与免疫之间有着密切的联系[3,14-16],自由基的过量失控也会对机体免疫系统造成损伤。免疫细胞和免疫器官对氧化应激十分敏感[28]。实验结果表明,CTX使小鼠血清中脂质过氧化物MDA含量增高,此时小鼠体内自由基过量,可损害机体的免疫组织和免疫细胞,还可作用于免疫和淋巴系统,降低了机体细胞免疫和体液免疫,引起机体免疫功能的损伤[29],而CGH可通过提高小鼠体内抗氧化酶的活性缓解CTX对机体的侵害。CGH体内抗氧化活性研究结果显示,CGH提高了免疫抑制小鼠体内抗氧化酶活性,在剂量为200 [mg/(kg·d)]时,血清中GSH-Px与MDA含量与正常对照组无显著差异,表现出良好的体内抗氧化能力,说明CGH可有效的提高免疫抑制小鼠体内抗氧化水平,提高小鼠体内抗氧化酶SOD、GSH-Px和CAT的含量,并减少脂质过氧化产物MDA的生成量,保护细胞免受MDA的毒副作用,缓解CTX对机体的氧化损伤。
4 结论
综上所述,复合蛋白酶和碱性蛋白酶协同水解制备的CGH可以促进脾淋巴细胞的体外增殖,质量浓度在320 μg/mL时,脾淋巴细胞增殖率提高至192.16%,缓解了CTX导致的免疫抑制作用,CGH高剂量时可有效提高免疫抑制小鼠血清中细胞因子TNF-α、IFN-γ、IL-2和IL-6的含量,提高了免疫抑制小鼠体内抗氧化活性,提高了抗氧化酶SOD、GSH-Px和CAT的含量,降低了免疫抑制小鼠体内MDA的含量,增强了小鼠免疫调节能力,从而保护机体健康。除此以外,CGH还具有易制备的优点,更利于实际应用,因而在玉米深加工领域具有广阔的应用前景。
