microRNA 与甲状腺乳头状癌相关性分析
2021-01-19谢青房延兵伊琳杨锐毛玉娟江华申进增何亚丽顾远晖
谢青 ,房延兵 ,伊琳 ,杨锐 ,毛玉娟 ,江华 ,申进增 ,何亚丽 ,顾远晖
1.宝鸡市中医医院急诊科,陕西宝鸡721000;2.甘肃中医药大学,甘肃兰州730000;3.甘肃省人民医院普外科,甘肃兰州730000
甲状腺癌(thyroid carcinoma)约占恶性肿瘤的1%,主要包括乳头状癌、滤泡状癌、未分化癌及髓样癌4 种病理类型,甲状腺乳头状癌(papillary thyroid carcinoma,PTC)约占甲状腺癌的 80% ~ 90%[1]。随着核辐射等危险因素影响,近年来,世界大部分地区甲状腺癌的发病率呈快速攀升态势[2]。在美国,65岁以上人群中甲状腺癌发病率以年均8.8%增长[3],中国统计数据显示,甲状腺癌发病率呈直线上升趋势,PTC 发病率近 26 年来增加了 5.7 倍[4]。
对于甲状腺微小乳头状癌,超声定位及穿刺活检术在诊断运用方面仍显不足,找到敏感的生物学指标更准确地诊断和制定合理的治疗方案是现在医学发展的方向。随着对PTC 发病机制的深入研究,生物靶向治疗受到日益关注,癌症精准医学应运而生,通过基因组测序及大数据分析,开展的针对癌症的精确诊断、预防及治疗等能提升前期癌症诊疗水平。尤其关于 BRAF 及 RAS 基因突变、RET / PTC基因重排、microRNA(miRNA)差异化表达等理论研究引起国内外学者的重视。
本研究使用转录组测序技术寻找PTC 癌组织及对应癌旁正常组织差异miRNA,并预测其与PTC相关的miRNA 靶基因及功能注释,筛查有潜在意义的miRNA 生物标志物,为进一步研究PTC 发病机制提供实验数据。
1 材料与方法
1.1 样本 PTC 癌组织及对应癌旁正常组织样本各6 份,收集于 2016 年 5 月 ~ 2017 年 5 月甘肃省人民医院普通外科经手术和病理确诊患者。患者年龄为40 ~50 岁,癌组织选择病灶中心部分,癌旁组织选择手术切除病灶的对侧甲状腺组织,样本采集后液氮冷冻及运输。样本采集经患者知情同意,并由甘肃省人民医院伦理委员会批准。
1.2 细胞 正常人甲状腺细胞Nthy-ori3-1(批号:BNCC337912)及人甲状腺乳头状癌细胞株TPC-1(批号:BNCC340487)、k1(批号:BNCC340489)均购自上海瑟欧生物科技有限公司,由甘肃中医药大学分子生物实验室传代培养。
1.3 主要试剂 细胞miRNA 超纯提取试剂盒(批号:CS047A)及反转录试剂盒(批号:ST1317B)购自宝生物工程(大连)有限责任公司;small RNA Sample Pre Kit 试剂盒(批号:ST1318S)、RPMI1640 培养基(批号:L210)、DMEM 培养基(批号:L110)、青霉素 /链霉素双抗(批号:S110)及胎牛血清(批号:CS047C)均购自美国GIBCO 公司;超纯RNA 提取试剂盒(批号:CS047A)购自北京索莱宝科技有限公司。
1.4 RNA 测序文库的构建 分别收集PTC 及癌旁正常组织样本,按超纯RNA 提取试剂盒提取并纯化组织总RNA,由北京百迈克科技有限公司高通量测序实验室检测。2 种RNA 样品纯度符合检测标准,无污染降解,符合建库要求。对合格的样品利用T4 RNA Ligase1 和 T4 RNA Li-gase 2(truncated)使用small RNA Sample Pre Kit 试剂盒进行文库构建,并用Qubit 2.0 软件确证检测的正确性。库检合格后应用Illumina HiSeg X Ten 平台测序,测序读长为singleend(SE)50 nt。
1.5 miRNA 差异表达分析 采用DESeq 1.25.9 软件进行2 组样品间的miRNA 差异表达分析。用错误发现率(false discovery rate,FDR)作为差异表达miRNA 筛选的关键指标,以差异倍数(fold change,FC)表示2 样品(组)间表达量的比值,以|log2(FC)|≥1,FDR ≤ 0.05 作为筛选标准。
1.6 miRNA 生物信息学分析 使用BLAST 软件将预测靶基因序列与基因功能注释(Gene Ontology,GO)、蛋白相邻类的聚簇(Cluster of Orthologous Groups of proteins,COG)、真核生物蛋白相邻邻类的聚簇(Clusters of orthologous groups for eukaryotic complete genomes,KOG)及信号通路(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库比对,获得靶基因的注释信息,并对差异miRNA 进行GO 功能注释及KEGG 富集分析。
1.7 novel-miR-26 及 miR-124 在 Nthy-ori3-1、TPC-1和K1 细胞中表达量的验证 采用QT-PCR 法。在培养瓶中,将TPC-1 及k1 细胞接种于含 10%胎牛血清的DMEM 完全培养基,Nthy-ori3-1 细胞接种于含10%胎牛血清的RPMI1640 完全培养基,均置37 ℃,5% CO2孵箱中培养至细胞呈贴壁生长,每隔3 d 换液1 次。按细胞miRNA 超纯提取试剂盒操作步骤常规提取细胞的 miRNA,用mRiNA 反转录试剂盒反转录为cDNA,以其为模板进行实时定量 PCR。novel-miR-26 上游引物:5′-GGGGTCCGGCTGGGTG-3′,下游引物:5′-TATGGTTGTTCACGACTCCTTCAC-3′;miR-124 上游引物:5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACGGCATT-3′,下游引物:5′-GCGGCGGTAAGGCACGCGGTG-3′;β-actin 上游引物:5′-GGAGATTACTGCCCTGGCTCCTA-3′,下游引物:5′-CACCTTGCAGGCACCTTTG-3′。引物由苏州泓迅生物科技有限公司合成。反应条件:预变性 95 ℃ 30 s;95 ℃ 5 s,60 ℃ 35 s,共 40 个循环(60 → 95 ℃,每 20 s 升温 1 ℃)。以 β-actin 作为内参照,采用2-△△Ct计算目的基因相对表达量,平行试验 3 次。
1.8 统计学分析 应用SPSS 23.0 软件进行统计学分析。芯片数据采用单因素方差分析,计量资料以表示,采用t 检验或单因素方差分析,以P <0.05为差异有统计学意义。
2 结 果
2.1 差异表达miRNA 的分析 测序共获得2 036个miRNA,已知1 591 个,新发现445 个。共发现1 166 个 miRNA 差异表达,表达上调 446 个,表达下调 720 个,深度分析发现,miR-124 及 miR-7 显著下调 ,miR-106a-3p、miR-494 及 novel-miR-26 显 著 上调,见表1。
2.2 miRNA 靶基因的预测 所有样品预测到靶基因的miRNA 有1 599 个,其中已知1 264 个,新预测335 个;预测到已知靶基因23 058 个,新预测靶基因18 203 个。对筛选出的5 个差异表达miRNA,使用百迈克平台进行靶基因预测筛选,部分靶基因与肿瘤的发生发展关系密切,见表2。

表1 2 组样品显著差异表达的miRNATab.1 Significantly differentially expressed miRNAs in two groups
2.3 差异表达miRNA 靶基因的注释
2.3.1 GO 分析 5 个差异表达miRNA 靶基因经分析,生物过程(biological process,BP)主要表现在生物黏附、生物调节、细胞成分组织、单一生物过程、细胞通信、对刺激的反应等方面;细胞组分(cell component,CC)主要表现在细胞连接、细胞外基质部分、细胞外区域、大分子复合物、细胞器等方面;分子功能(molecular function,MF)主要表现在黏连、催化活性、载体活性、转录因子活性、分子活动等方面。见表 3 ~ 5。

表2 miRNAs 预测的部分靶基因Tab.2 Partial target genes predicted by miRNAs

表 3 GO 的 BP 分析Tab.3 GO biological process(BP)analysis
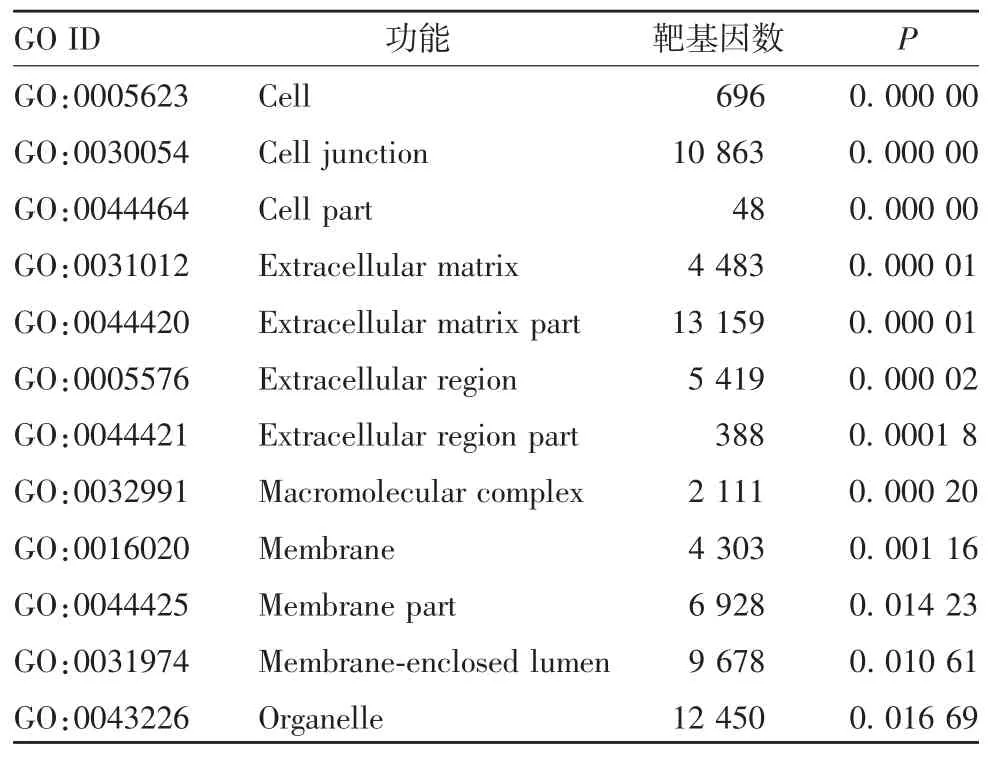
表 4 GO 的 CC 分析Tab 4.GO cell component(CC)analysis

表 5 GO 的 MF 分析Tab 5.GO molecular function(MF)analysis
2.3.2 KEGG 分析 5 个差异表达miRNA 靶基因经分析,PTC 细胞迁移可能是miRNA 对靶基因的影响,从而调控Axon guida-nce 等相关信号通路的调节,PTC 细胞周期的变化可能是靶基因参与单磷酸腺苷活化蛋白激酶(AMP-activated kinase,AMPK)等信号通路的调节,相关靶基因可能通过氨基酸代谢、昼夜节律、蛋白消化吸收等信号通路对肿瘤细胞的凋亡发挥相应的作用。前20 条KEGG 通路见图1和图2。

图1 差异表达基因KEGG 通路富集散点图Fig 1.Enrichment scatter diagram of KEGG pathway of differentially expressed genes

图2 差异表达基因KEGG 分类Fig 2.KEGG classification of differentially expressed genes
2.4 novel-miR-26 及miR-124 的相对表达量
2.4.1 在TPC-1 及Nthy-ori3-1 细胞中的表达量 novelmiR-26 在 TPC-1 细胞中表达量(17.991 ± 1.581)较在 Nthy-ori3-1 细胞中(1.151 ± 0.318)相对高表达,且差异有统计学意义(t = 28.57,P < 0.01);miR-124在 TPC-1 细胞中的表达量(0.042 4 ± 0.009 8)较在Nthy-ori3-1 细胞中(1.971 3 ± 0.428 1)相对低表达,且差异有统计学意义(t = 11.12,P < 0.01)。
2.4.2 在k1 及Nthy-ori3-1 细胞中的表达量 novelmiR-26 在 K1 细胞中表达量(10.011 ± 1.361)较在Nthy-ori3-1 细胞中(5.151 ± 2.168)相对高表达,且差异有统计学意义(t = 5.25,P < 0.01);miR-124在 k1 细胞中表达量(0.018 1 ± 0.006 4)较在 Nthyori3-1 细胞中(0.171 3 ± 0.018 1)相对低表达,且差异有统计学意义(t = 25.17,P < 0.01)。
3 讨 论
在PTC 临床诊疗中探寻更有价值的生物分子标志物在PTC 的术前诊断中尤为十分重要。本研究共测得2 036 个miRNA,已知1 591 个,新发现445个;共发现1 166 个miRNA 差异表达,表达上调446个,表达下调720 个,深度分析发现,miR-124 及miR-7 显著下调;miR-494、miR-106a-3p 及 novel-miR-26显著上调。这些 miRNA 可能在PTC 的发生发展,癌细胞增殖、浸润、迁移,预后复发等方面起一定的作用。
miR-494 可能作为潜在分子标志物运用于临床诊断及治疗,对于个体化病情评估具有一定的意义,其参与人体疾病的发生发展过程。杨英等[5]通过对恶性及可疑恶性甲状腺结节患者应用PCR 检测细针穿刺抽吸活检(fine needle aspiration cytology,FNAC)标本及外周循环中miR-191 和miR-494 的表达水平,发现癌组miR-191 的表达水平明显低于良性组,而癌组miR-494 表达水平明显高于良性组,表明miR-191 和miR-494 均可作为分子标志物的被选基因。王克义[6]在PTC 血清临床样本研究中筛选了表达上调的miR-494-3p,发现该基因与临床病理特征(如性别、年龄、肿瘤最大径、病灶数量、包膜侵犯、淋巴结转移状况及分期等)有关,推断miR-494 含量的变化很可能在PTC 的发生发展过程中起着至关重要的作用,可作为潜在的分子标志物进行深入研究。有研究发现,miR-494 不仅能抑制PTEN 表达,还能增加肿瘤细胞内磷脂酰肌醇3-激酶(phos-phatidylinositol3-kinase,PI3K)及 p-Akt 的表达,从而促进细胞增殖能力、迁移力及侵袭性[7]。miR-124 是一个高保守的抑癌基因,已被证实在多种肿瘤中表达下调,与肿瘤的发生、发展及转归过程密切相关,可用于诊断或区分健康或疾病状态的潜在分子标志物,在诊断及预防微小PTC 中具有临床意义。研究发现,与正常甲状腺组织对比,miR-124 在癌组织中表达下调,在k1 细胞的增殖及侵袭验证中发现,其作用机制可能是通过干扰miR-124 表达调控STAT3基因[8]。于佳等[9]通过检测 PTC(K1、BCPAP 及TPC-1)细胞和人甲状腺细胞Nthy-ori 3-1 中miR-124 的相对表达量发现,miR-124 表达均下调,其作用机制是负调控靶基因IQGAP1 的表达,改变癌细胞的增殖、迁移及凋亡。miRNA-106a 在PTC 组织中高表达,作为PTC 潜在分子标志物,其优点在于可作为临床应用中的敏感性及特异性指标。最新临床研究发现,miRNA-106a 表达诊断 PTC 的曲线下的面积为0.838,诊断 PTC 的敏感性及特异性分别为70%和80%[10]。结合现有研究成果,miRNA-106a在PTC 诊断方面具有潜在的临床应用价值。有研究发现,miR-7 可能是诊断甲状腺肿瘤最准确的miRNA,其优点在于其可作为鉴别甲状腺肿瘤不确定类型的辅助诊断标志物,从而避免不必要的甲状腺切除术,miR-7 还是区分良恶性甲状腺FNAB 样本的最适预测因子,其预测准确率高达 76%[11]。SAISELET 等[12]发现,miR-7 是PTC 发生淋巴结转移的患者基因中最显著下调的miRNA。HUA 等[13]通过双荧光素酶分析证实 CKS2 为 miR-7 的靶基因,miR-7 负调控 CKS2,miR-7 可通过抑制CKS2 的mRNA 及下游蛋白的表达抑制癌细胞的增殖、转移及侵袭。结合相关研究miR-7 可能成为PTC 早期淋巴转移诊断的分子标志物,为PTC 早诊断及淋巴转移预防方面提供了研究方向。novel-miR-26 作为此次实验筛选的新基因,其优点在表达倍数高,可备选为潜在分子标志物,扩充PTC 潜在分子标志物数据库,但缺乏文献及相应实验数据的支持,需结合细胞、动物、临床血清等多重验证,证实测序结果的可靠性。此次筛选出的5 个miRNA 差异基因,为后续深入研究提供了依据。
筛选的 5 个差异表达miRNA 靶基因经GO 富集分析,BP、CC 及 MF 主要信息提示,在 PTC 形成过程中可能是由于外界环境因素引起生物体对刺激的反应,使生物体细胞的细胞膜、细胞质成分改变,进而在物质运输过程中影响转录因子活性,影响细胞分子及酶的活性,且能造成ATP 异常,弱化机体的免疫系统,影响机体内环境从而造成PTC 的发生。经KEGG Pathway 注释分析,KEGG 排名前 20 条通路上,显著通路是Axon guidance 及AMPK 信号通路等。研究发现,磷酸化腺苷酸活化蛋白激酶(pAMPK)在PTC 组织中高表达,并与颈部淋巴结转移密切相关,AMPK-ACC 通路的激活在PTC 的发生及转移中起了促进作用[14]。AMPK 信号通路激活后可使血管内皮细胞生长因子和缺氧诱导因子1 的表达上调,从而导致肿瘤局部侵袭及淋巴结转移的加剧,缺氧还可直接激活AMPK 信号通路促使PTC 的发生发展[15-16]。在PTC 发生、发展及诊疗过程中,其癌组织局部微环境主要表现为缺血缺氧状态,从而激活AMPK,抑制合成代谢促进分解代谢,为肿瘤细胞的生长提供基础环境。而AMPK 的激活多伴随碘摄取能力下降,间接影响术后放射碘治疗的患者的疗效。结合以上相关研发现,AMPK 可能成为治疗靶点,不仅可减缓PTC 的转移及恶化,还可改善PTC 术后放射碘治疗的效果。有研究发现与神经发育密切相关的信号通路Axon Guidance 在前列腺癌进展中发挥关键作用[17]。甲状腺癌位于神经血管丰富的颈部,而Axon Guidance 在注释的通路中排在首位,这是否提示该通路在PTC 的发展过程中起着关键的作用,目前未发现相关文献报道,这为进一步研究提供了新的思路。地域环境因素不同也是导致地域性甲状腺癌发病率不同的重要因素,在已测得的通路中与代谢相关通路较多,地区水土不同可能影响正常氨基酸、脂质、嘌呤代谢、能量代谢、生物转化及氧化应激等过程,上述因素为从地域角度分析PTC病因提供了新的方向。
总之,高通量测序及功能分析的一些结论仅能作为后续实验的基础数据,还需根据差异表达miRNA靶基因注释筛选出显著差异的GO 条目和 KEGG Pathway,深入挖掘基因互作关系及蛋白互作关系,分析基因与基因及其靶基因蛋白之间的关系,了解具体的基因与蛋白之间的关系,需在动物、细胞、临床水平相互进行验证实验,逐步证实这些差异基因、蛋白之间的作用机制,从精准医学入手,为PTC 早期诊断及更好的防治寻找新方向。
