微小RNA-193a-3p和生长基因1抑制剂在食管癌中的表达和临床意义
2021-01-19胡少宏唐镇刘香庭
胡少宏 唐镇 刘香庭
食管癌在癌症相关死亡的原因中排名第六[1]。目前,食管癌的治疗手段在不断提升,但病人的预后仍然未得到明显改善,研究新的治疗靶点具有重要临床意义[2-3]。微小RNA(microRNA,miRNA)是一类非编码RAN,可作为抗肿瘤治疗的靶点[4]。miR-193a-3p在结直肠癌、胰腺导管腺癌和非小细胞肺癌等恶性肿瘤中被报道为抑癌基因,其过表达可以抑制肿瘤增殖、侵袭和转移等多种肿瘤恶性进展行为[5-7],但是在食管癌中miR-193a-3p的过表达却会增加食管鳞状细胞癌细胞的辐射抗性和化学抗性[8]。生长基因1抑制剂(inhibitor of growth gene 1,ING1)是肿瘤抑制基因[9],其与包括非小细胞肺癌和胶质母细胞瘤等恶性肿瘤的发生发展密切相关[10-11]。本研究探讨miR-193a-3p和ING1在食管癌中的表达水平和临床意义。
对象与方法
一、对象
2013年1月~2014年6月于我院诊治的食管癌病人90例。纳入标准:(1) 均为首次入院行食管癌切除治疗;(2)经病理检查确诊;(3) 具有完整的临床病理资料和随访资料;(4)之前未接受过抗肿瘤治疗。排除标准:肿瘤发生远处转移;患有其他类型肿瘤;合并影响生命健康的慢性疾病病人。收集手术切除的食管癌组织样本及其配对的癌旁组织样本(癌旁组织距离癌组织5 cm以上)。90例病人中,男性68例,女性22例;年龄≤60岁者36例,>60岁者54例;组织类型:鳞癌82例,腺癌8例;肿瘤位置:上段23例,中段41例,下段26例;淋巴结转移:有35例,无55例;TNM分期:Ⅰ期20例,Ⅱ期37例,Ⅲ期33例。所有病人或者家属均签署知情同意书,本实验的所有操作均由我院伦理委员会审核通过。
二、方法
1.实时荧光定量PCR(qRT-PCR):采用qRT-PCR检测食管癌和癌旁组织中miR-193a-3p的表达。手术切除的组织标本立即置于液氮中冻存,研磨成粉末后,加入TRIzol试剂裂解组织,加入氯仿混匀后低温高速离心,吸取上层上清液与异丙醇等体积混匀后离心,加入DEPC水获得RNA,经Nanodrop2000测得其浓度。将RNA逆转为cDNA,以其为模板,加入基因引物和PCR试剂进行扩增反应,按照两步法进行:95 ℃ 30秒和60 ℃ 30秒,72 ℃ 30秒40个循环。7 500上机检测各样品的循环阈值(Cycle threshold,Ct)。以U6基因为内参,用2-△△Ct法计算miR-193a-3p相对表达量。miR-193a-3p引物F:5′-GCATAACTGGCCTACAAAGT-3′,R:5′-GTGCAGGGTCCGAGGT-3′;内参U6引物F:5′-CTCGCTTCGGCAGCACA-3′,R:5′-AACGCTTCACGAATTTGCGT-3′。
2.免疫组化(IHC)检测:采用IHC检测食管癌和癌旁组织中ING1蛋白的表达。手术切除的组织标本经中性甲醛固定,酒精脱水和石蜡浸泡包埋成蜡块,经切片机制成厚度为4μm的石蜡切片。切片经烤箱和二甲苯脱蜡,梯度酒精水化后,在枸橼酸钠抗原修复液中经高温高压进行抗原修复,并经3%过氧化氢酶和非免疫羊血清共孵育封闭非特异性抗原,加入ING1一抗稀释液(1∶100)4 ℃孵育15小时,阴性对照为PBS孵育。PBS洗三次后二抗37 ℃孵育30分钟。显色液常温孵育2分钟,苏木素染核2分钟,二甲苯透明后封片。在高倍显微镜下观察染色情况,以染色面积和染色强度进行综合评分,染色面积0~5%计为0分,6%~25%计为1分,26%~50%计为2分,51%~75%计为3分,大于75%计为4分。染色强度无计为0分,弱计为1分,中计为2分,强计为3分;二者之和≥4分为阳性表达,0~3分为阴性表达。
3.随访:所有病人手术后1个月开始随访。采用电话随访以及门诊复查,随访截止到2019年6月。
三、 统计学分析

结果
1.miR-193a-3p在食管癌组织中的表达水平比较:miR-193a-3p在食管癌组织中的相对表达水平为(1.52±0.71),癌旁组织为(1.04±0.51),差异有统计学意义(P<0.05))。
2.ING1在食管癌组织中的表达:ING1在食管癌组织中的阳性表达率为31.11%,癌旁组织的阳性表达率为55.56%,两者比较差异有统计学意义(P<0.05)。见表1、图1。
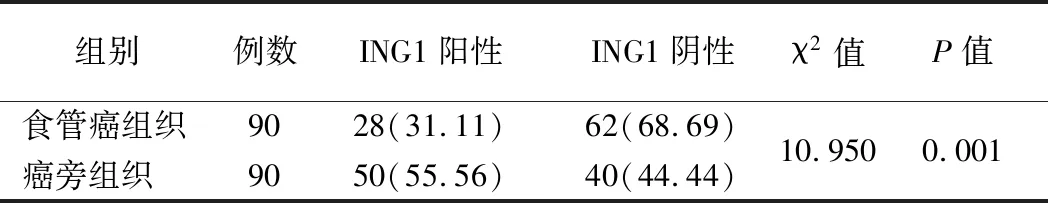
表1 IHC检测ING1在食管癌组织中的表达(例,%)

图1 IHC检测ING1在食管癌组织中的表达(SP染色法,×200)
3.miR-193a-3p与ING1靶向关系的预测:应用Target Scan7.1生物学信息软件预测miR-193a-3p与ING1靶向关系。结果显示,ING1的3′UTR区存在miR-193a-3p的结合位点。见图2。
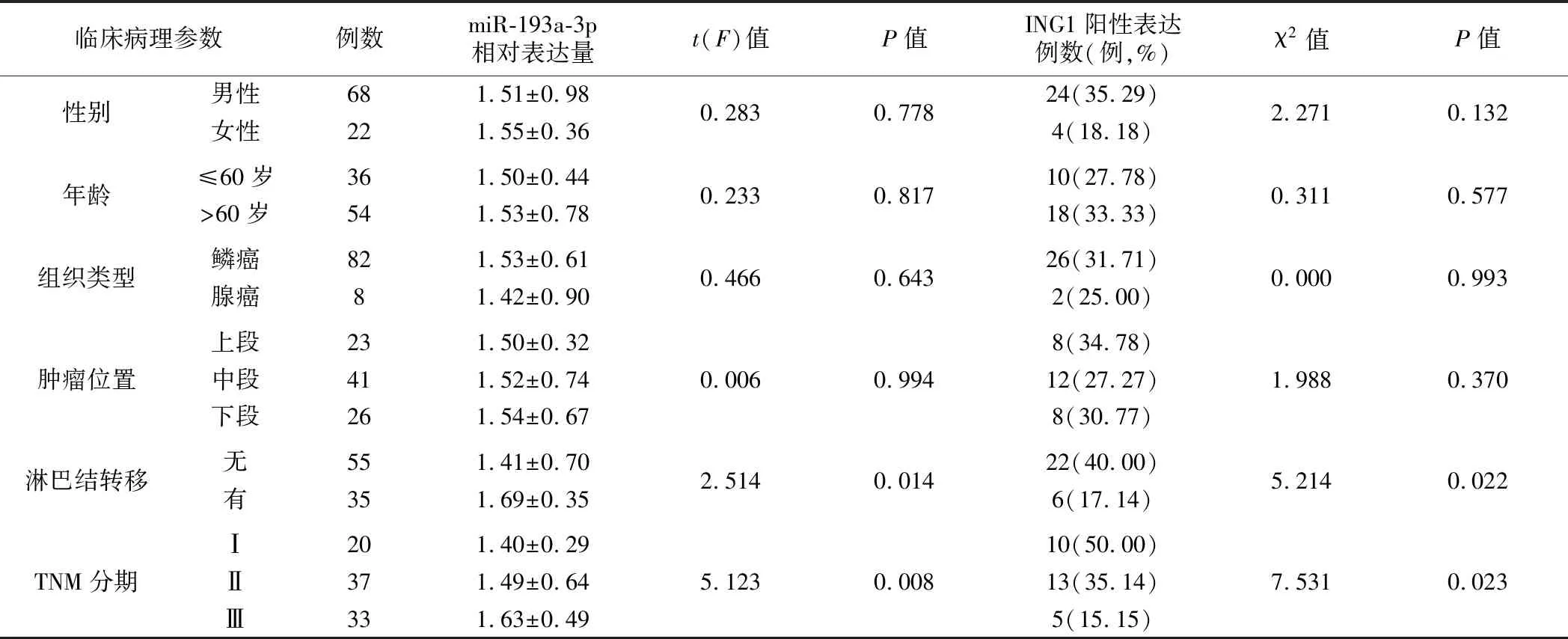
表3 miR-193a-3p和ING1在食管癌组织中的表达水平与病人临床病理参数之间的关系
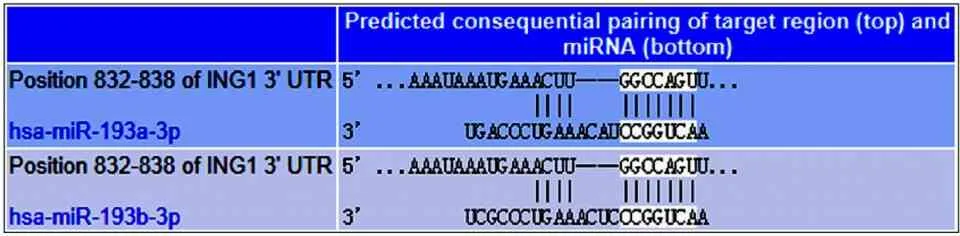
图2 Target Scan7.1预测miR-193a-3p与ING1的3'UTR区的结合位点
4.miR-193a-3p和ING1在食管癌组织中表达的相关性见表2、图3。按照miR-193a-3p在食管癌组织中的相对表达量1.52为界,将90例食管癌病人分为miR-193a-3p高表达病人(49例)和miR-193a-3p低表达病人(41例)。结果显示,miR-193a-3p与ING1在食管癌组织中的表达呈负相关(P<0.05)。

表2 食管癌组织中miR-193a-3p和ING1表达的相关性

图3 相关性分析(n=90)
5.食管癌组织中miR-193a-3p、ING1表达水平与病人临床病理参数之间的关系见表3。miR-193a-3p、ING1在食管癌组织中的表达水平与病人的性别、年龄、组织类型、肿瘤位置无关(P>0.05),与TNM分期和淋巴结转移相关(P<0.05)。
6.食管癌组织中miR-193a-3p、ING1表达水平对病人预后的影响见图4。对90例病人随访资料进行整理,绘制Kaplan-Meier生存曲线,分析miR-193a-3p和ING1对病人预后的影响。结果显示90例病人中死亡病例52例,存活病例38例。
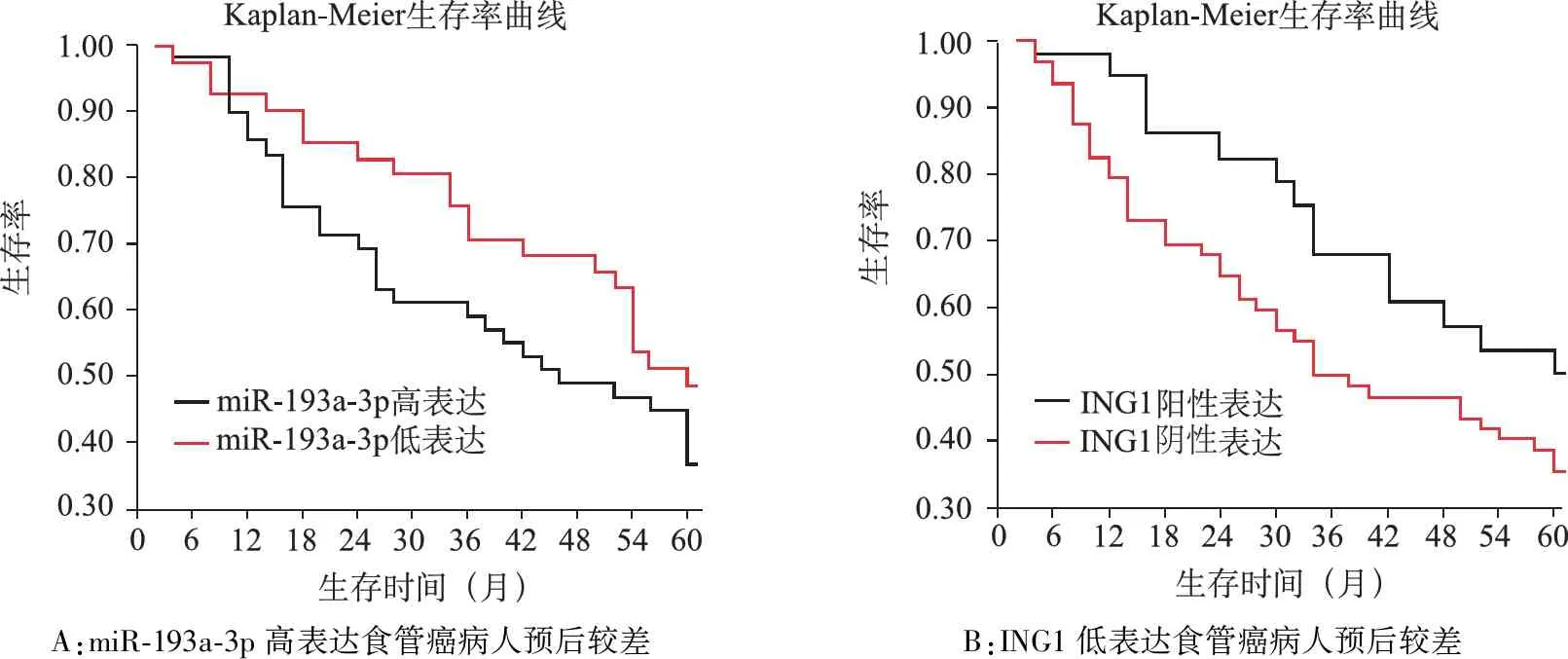
A:miR-193a-3p高表达食管癌病人预后较差B:ING1低表达食管癌病人预后较差
miR-193a-3p高表达组死亡31例,存活18例,5年生存率为36.73%(18/49);miR-193a-3p低表达组病人死亡21例,存活20例,5年生存率为48.78%(20/41)。miR-193a-3p高表达的病人预后比miR-193a-3p低表达的病人预后较差(P<0.05)。ING1阳性表达组死亡13例,存活15例,5年生存率为53.57%(15/28);ING1阴性表达组死亡39例,存活23例,5年生存率为37.10%(23/62)。ING1阴性表达的病人预后比ING1阳性表达的病人预后差(P<0.05)。
讨论
食管癌是常见的消化系统恶性肿瘤之一,每年死于食管癌的病例数超过27万,且具有增长趋势[12]。食管癌的治疗包括外科手术、化学疗法和放射疗法等传统治疗方法。联合治疗在改善预后方面取得了一定的进展,但由于食管癌病人缺乏特定的症状和有效的早期诊断方法,确诊时往往已经处于晚期,一旦发生远处转移或者复发,病人将失去手术切除机会,病人5年生存率仅为25%~30%[13]。食管癌的主要危险因素为吸烟、饮酒、食用腌制蔬菜和霉菌毒素污染的食物等[14],但是其发病的具体机制尚未完全阐明。
miRNA属于内源性非编码RNA,长度约为22个核苷酸,其可与靶mRNA的3'非翻译区(3'UTR)结合,从而导致mRNA降解或功能性抑制蛋白质翻译,进而调节基因表达[15]。miRNA的调控作用涉及各种系统性疾病,多种miRNA在恶性肿瘤中表达失调,进而参与肿瘤的增殖、分化、凋亡、侵袭、转移和耐药等多种恶性生物学行为[16]。miR-193a-3p位于人类17q11.2号染色体上,LaRos-Quintana等[17]研究表明,miR-193a-3p是一种肿瘤抑制剂和壁细胞的转化因子,在多种疾病中起着重要作用。在结直肠癌中miR-193a-3p的过表达抑制了肿瘤细胞的增殖、迁移和血管生成[5],miR-193a-3p在胰腺导管腺癌组织中的表达低于非癌性组织中的表达,在肿瘤细胞中过表达miR-193a-3p后,细胞增殖能力被抑制,细胞凋亡和细胞周期被诱导[6]。以上研究均表明,miR-193a-3p在结直肠癌和胰腺导管腺癌中的高表达有抗肿瘤作用。然而,在关于鼻咽癌和胃癌的报道中,miR-193a-3p表达的增加与肿瘤细胞放射抗性和化学耐药相关[18-19],同样miR-193a-3p的过表达可以增加食管鳞状细胞癌细胞的辐射抗性和化学抗性,提示miR-193a-3p具有促进肿瘤发展的作用。本研究结果显示,miR-193a-3p在食管癌组织中表达上调,且其高表达与病人的淋巴结转移和TNM晚期相关,表明miR-193a-3p可能参与了食管癌的恶性进展。本研究还对食管癌病人的生存率进行了分析,结果显示miR-193a-3p高表达的食管癌病人5年生存率较差,提示miR-193a-3p可能是食管癌预后不良的标志分子。
miR-193a-3p可以通过调控纤溶酶原激活物尿激酶(PLAU)、细胞周期蛋白D1(CCND1)和p21激活的激酶4(PAK4)等靶基因发挥作用[5-7]。靶基因是miRNA发挥调控作用的重要机制,每个miRNA可以存在成千上百个靶基因,本研究通过软件预测发现ING1基因的3'UTR区存在与miR-193a-3p两个结合位点,其可能是miR-193a-3p的靶基因。ING1属于INGs家族,其家族由ING1-5组成,发挥Ⅱ型肿瘤抑制作用,ING1通过多种途径调节细胞增殖、凋亡、分化、血管生成、转移和侵袭等生物学过程,此外ING1还可增加癌细胞对化学疗法和放射疗法的敏感性,ING1是潜在的抗肿瘤治疗靶点[20]。ING1的过表达可显著抑制非小细胞肺癌细胞的增殖、迁移和侵袭,并促进细胞凋亡[10]。在胶质母细胞瘤中抗原生动物药物Nitazoxanide(NTZ,硝虫唑)通过上调ING1的表达抑制自噬的发生,诱导肿瘤细胞周期停滞导致细胞生长抑制[11]。本研究采用免疫组化检测发现ING1蛋白在食管癌组织中表达下调,且其阴性表达与病人的淋巴结转移和TNM晚期相关,同时ING1阴性表达的食管癌病人5年生存率较差,表明ING1低表达参与了食管癌的恶性进展,其可能是食管癌预后不良的标志分子。采用Pearson线性相关分析对miR-193a-3p和ING1在食管癌中的表达水平进行了分析,结果显示两者表达呈负相关性,表明miR-193a-3p可能通过靶向ING1基因共同参与食管癌的进展。
综上所述,miR-193a-3p在食管癌中高表达,ING1在食管癌中低表达,两者的表达呈负相关性,并且均与食管癌病人不良病理参数和预后相关,miR-193a-3p可能通过调控ING1的表达促进食管癌的发生发展,miR-193a-3p和ING1有望成为食管癌治疗的候选靶点。
