横纹肌肉瘤中融合基因阳性和阴性细胞功能学及差异miRNA生物信息学分析
2021-01-18王晓萌李真真张海俊党鸿蔚刘春霞
王晓萌,李真真*,孟 莲,张海俊,党鸿蔚,李 锋,刘春霞
横纹肌肉瘤(rhabdomyosarcoma, RMS)好发于儿童及青少年[1],常见亚型为胚胎性横纹肌肉瘤(embryonal RMS,ERMS)、腺泡型横纹肌肉瘤(alveolar RMS,ARMS),ERMS发病率约60%,ARMS发病率约20%;由于ARMS中存在PAX3/PAX7-FOXO1融合基因,其恶性程度高,致死率更高[2]。已在成肌细胞模型中发现PAX3-FOXO1的表达可以促进RMS的发展[3]。因此,全面探索融合基因在RMS细胞中发挥的作用就显得尤为重要。
miRNA作为一种非编码RNA,对癌症的抑制或表达发挥重要作用。miR-27a等不同miRNA可以促进RMS侵袭、迁移等生物学行为[4],但尚未见在RMS细胞中比较融合基因阳性和阴性的生物学行为的研究,融合基因和miRNA的相关研究较少。因此,该文将比较RMS细胞融合基因阳性和阴性的生物学行为并结合生物信息学分析差异miRNA,为后续基因及信号通路的研究提供参考。
1 材料与方法
1.1 细胞系和细胞培养人RD和PLA-802细胞系购自中国科学院细胞库; RH30细胞系购自上海复翔生物技术有限公司;PLA-802、RH30和RD细胞的培养基为含10%胎牛血清的DMEM培养基(美国赛默飞公司),在37 ℃、5%CO2培养箱中培养。
1.2 主要试剂Cell Counting Kit-8购自上海东仁化学技术有限公司;Total RNA Kit、miScript II RT Kit、miScript SYBR Green PCR Kit均购自德国QIAGEN公司;Ultra SYBR Mixture(Low ROX)购自北京康为世纪公司;TIAN Script RT Kit购自北京天根生物科技公司;Transwell小室购自美国Corning Coster公司;Annexin V-FITC/PI双染细胞凋亡检测试剂盒购自南京凯基生物有限公司;miRNA引物购自上海生工生物工程有限公司。
1.3 方法
1.3.1CCK-8试验 在96孔板中(3×103个/孔)接种RMS细胞,分别在0、24、48和72 h,向RMS细胞中加入CCK-8试剂(10 μl/孔),并在37 ℃、5%CO2的潮湿培养箱中孵育2 h。避光使用Biotek酶标仪(美国Bio-Rad)记录450 nm的吸光度(optical density, OD)值。
1.3.2Transwell试验 收集RMS细胞(200 μl,25 000个/孔)。侵袭试验需提前2 h在小室内加入基质胶,随后更换DMEM培养基水化30 min,无血清培养基重悬RMS细胞后置于小室内,将小室置于20%FBS的600 μl DMEM培养基的24孔板中孵育2 d,小室用4%多聚甲醛固定20 min后晾干,用0.1%结晶紫染色15 min后用棉球轻轻擦拭上层,在显微镜下拍照记录。迁移试验则无需铺基质胶,在37 ℃下孵育24 h后,后续实验步骤同迁移试验。利用Image J软件计数和SPSS统计分析。
1.3.3流式细胞术 将细胞铺到6孔板(1×104个/孔)中,2 d后,消化收集RMS细胞,用预冷PBS洗涤2次,以1×106个/ml的浓度重悬于500 μl Binding Buffer中。向RMS细胞悬液中加入Annexin VAPC/PI双染试剂各5 μl。双染后1 h之内利用流式细胞仪检测凋亡细胞的百分比,并记录凋亡率。
1.3.4差异miRNA分析 利用GEO(http://www.ncbi.nlm.nih.gov/geo/)数据库中GSE97553数据集,包含患者的PAX3-FOXO1融合基因阴性细胞(3株:RD、RH2、RH18)和PAX3-FOXO1融合基因阳性细胞(5株:RH3、RH4、RH30、RH28、RH41)的miRNA芯片表达谱,运用在线软件GEO2R分析融合基因阳性和阴性细胞的差异miRNA, SangerBox分析差异miRNA绘制火山图, |log2FC| >3,P<0.05,设定筛选差异miRNA为有意义的阈值。
1.3.5qRT-PCR检测筛选miRNA RMS细胞铺到12孔板培养2 d后消化离心,弃上清液,加入700 μl QIAzol 裂解试剂混匀静置5 min,加入140 μl三氯甲烷混匀,室温静置15 min后离心,吸上清液加入1.5倍体积的无水乙醇混匀后,吸700 μl液体加入柱子上离心10 000 r/min,15 s,4 ℃。利用Total RNA Kit试剂盒提取总RNA,将提取miRNA测浓度后,试剂盒miScript II RT Kit进行逆转录,联合SYBR Green PCR Kit试剂盒上样后利用7500实时PCR进行检测,统计分析结果。

2 结果
2.1 融合基因阳性RH30细胞的迁移、侵袭能力最强RMS细胞培养24 h后,统计RH30细胞、RD细胞和PLA-802细胞的穿孔数量,结果显示RH30细胞的迁移能力高于RD细胞和PLA-802细胞(F=226.514,P均=0.000)。RMS细胞培养48 h后,统计RH30细胞和RD细胞、PLA-802细胞的穿孔数量,结果显示RH30细胞的侵袭能力高于RD细胞和PLA-802细胞(F= 90.917,P均=0.000)。 见图1。
2.2 融合基因阴性RD细胞的增殖能力最强分析3株RMS细胞在0、24、48和72 h的OD值,并绘制OD曲线。0 h时RD、RH30和PLA-802细胞的OD值曲线结果显示各组之间无差异(F=0.293,P>0.05)。在24、48、72 h时,RD细胞的增殖能力高于RH30和PLA-802细胞的增殖能力(F=29.16,PRH30=0.004,PPLA-802=0.000;F=109.726,PRH30=0.000,PPLA-802=0.000;F=56.646,PRH30=0.001,PPLA-802=0.000)(P<0.05)。此外,RH30细胞的增殖能力高于PLA-802细胞的增殖能力。所有结果差异均有统计学意义(P<0.05)。见图2。

图1 3株RMS细胞系的迁移和侵袭能力
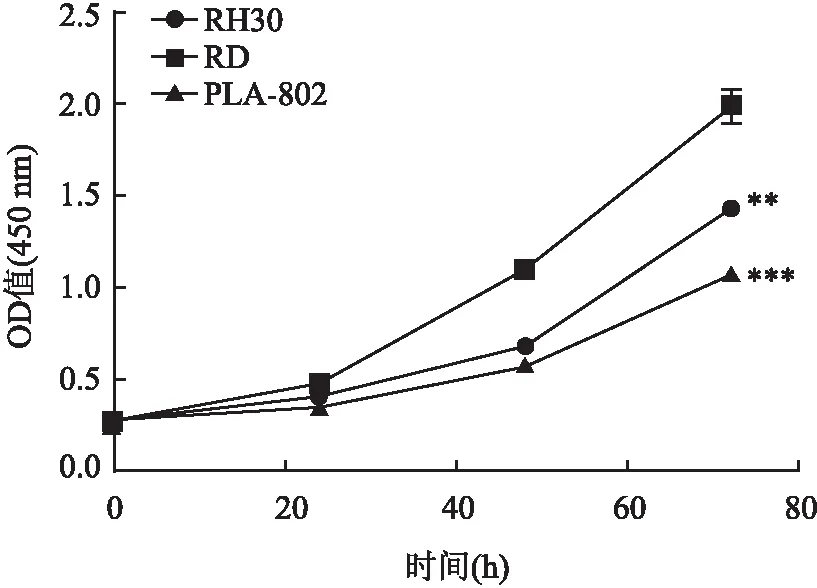
图2 3株细胞系的细胞增殖能力
2.3 融合基因阳性RH30细胞的抗凋亡能力最强在RMS细胞中加入Annexin V-APC / PI试剂后检测其凋亡能力,结果显示RH30细胞的凋亡率低于RD细胞和PLA-802细胞(F=7.415,PRD=0.015,PPLA-802=0.016)。PLA-802细胞与RD细胞之间的凋亡率差异无统计学意义(t=-0.040,P=0.97)。3株RMS细胞中,RH30的抗凋亡能力高于RD和PLA-802。见图3。
2.4 筛选差异miRNAGEO2R分析RMS中融合基因阳性细胞和融合基因阴性细胞中差异miRNA,利用sangerbox中火山图分析差异miRNA,红色代表上调miRNA,绿色代表下调miRNA(图4)。根据|log2FC|>3,P<0.05,筛选得到12个差异miRNA,其中上调miRNA有3个,分别为miR-1、let-7d-5p和let-7b-5p,下调miRNA有9个,分别为miR-196a-5p、miR-455-3p、miR-21-5p、miR-193a-3p、miR-29b-3p、miR-29a-3p、miR-100-5p、miR-222-3p和miR-221-3p(表1)。

表1 筛选差异miRNA
2.5 qRT-PCR验证差异miRNA在RH30细胞、PLA-802细胞、RD细胞中利用qRT-PCR检测筛选出的12个差异miRNA,结果显示miR-1(F=28.908,PRD=0.001,PPLA-802=0.000),let-7d-5p(F=187.469,PRD=0.000,PPLA-802=0.000)和let-7b-5p(F=2920.115,PRD=0.000,PPLA-802=0.000)在融合基因阳性RH30细胞中表达高于融合基因阴性PLA-802细胞和RD细胞(图5);miR-196a-5p(F=98.196,PRD=0.000,PPLA-802=0.001),miR-455-3p(F=8.773,PRD=0.006,PPLA-802=0.040),miR-21-5p(F=187.469,PRD=0.000,PPLA-802=0.000),miR-193a-3p(F=87.856,PRD=0.000,PPLA-802=0.002),miR-29b-3p (F=16.142,PRD=0.001,PPLA-802=0.044),miR-29a-3p(F=16.573,PRD=0.006,PPLA-802=0.002),miR-100-5p(F=13.040,PRD=0.002,PPLA-802=0.038),miR-222-3p(F=53.234,
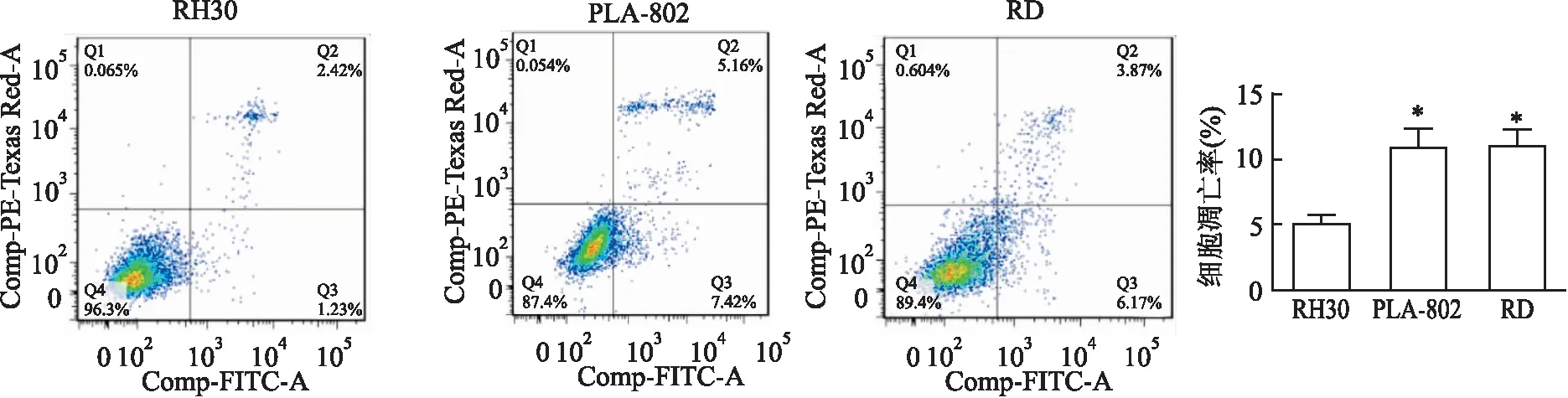
图3 3株细胞系的抗凋亡能力

图4 火山图分析差异miRNA
PRD=0.000,PPLA-802=0.003)和miR-221-3p(F=48.550,PRD=0.000,PPLA-802=0.003)在融合基因阴性RD细胞和PLA-802细胞中表达高于融合基因阳性RH30细胞(图5)。上述结果与生物信息学分析结果一致。

图5 qRT-PCR分析筛选差异miRNA的mRNA表达
3 讨论
ARMS中75%~80%存在t(2;13)(q36;q14)/PAX3-FOXO1或t(1; 13)(p36; q14)/PAX7-FOXO1易位,对RMS的发生发展起重要作用[5]。Williamson et al[6]在210位RMS患者中运用Kaplan-Meier分析无病生存率和总体生存率,结果显示融合基因阳性RMS患者的转移比例高于融合基因阴性的RMS患者,融合基因阳性患者比融合基因阴性患者预后差。本文在RMS细胞学水平证实,融合基因阳性RH30细胞的侵袭、迁移和抗凋亡能力高于融合基因阴性PLA-802细胞和RD细胞,而CCK-8检测结果显示RD 的增殖能力高于RH30和PLA-802,融合基因可能对RMS细胞的侵袭、迁移及抗凋亡能力起主要作用,对RMS细胞的增殖能力影响较小,可做进一步研究,为RMS的分子信号通路研究提供参考。
miRNA不仅参与正常的细胞生物进程,在肿瘤中同样发挥重要的作用。在乳腺癌细胞中过表达miRNA-144抑制CEP55的表达,抑制乳腺癌细胞的增殖、侵袭和迁移[7]。在RMS中,融合基因不仅影响肿瘤细胞的生物学功能,对miRNA同样发挥重要作用,过表达PAX3-FOXO1激活促进miR-486-5p的表达,进而促进ARMS的发展[8]。
本研究利用生物信息学分析miRNA芯片表达谱筛选RMS融合基因阳性和阴性的差异miRNA并利用qRT-PCR证实miR-196a-5p、miR-455-3p、miR-193a-3p、miR-100-5p、miR-222-3p和miR-221-3p等在RMS融合基因阳性中的表达低于融合基因阴性的RMS,在RMS融合基因阳性中可能发挥抑制作用。
Zhan et al[9]发现在胰腺癌中miR-455-3p表达降低,PDZ结合基序(TAZ)为Hippo途径的关键因子,过表达miR-455-3p靶向抑制TAZ表达抑制胰腺癌细胞的增殖。Mohamed et al[10]研究表明在RMS中TAZ促进RD(ERMS)细胞的增殖及成肌细胞转化。Lu et al[11]发现在耐西妥昔单抗的大肠癌中miR-100过表达,lncRNA MIR100HG可以驱动miR-100和miR-125b协调抑制Wnt信号通路的负调控因子,增强Wnt信号表达导致耐药,不利于肿瘤的治疗。Singh et al[12]在p53和c-fos双突变表达降低的小鼠模型体内发现,与正常成肌细胞相比,ERMS中的Wnt信号通路被下调。Xu et al[13]研究表明miR-196a-5p是唯一连接LOC134466和TAC1的miRNA,过表达LOC134466可抑制miR-196a-5p,促进TAC1的表达,抑制子宫内膜癌细胞的增殖。Wang et al[14]在肝癌中利用生物信息学分析及实验证实miR-221-3p/miR-222-3p高表达,其预测靶基因CBFB、UBE2N在肝癌预后预测表现良好,可能是肝癌预后的指标。本研究miR-221-3p/miR-222-3p等miRNA在RMS融合基因阴性的表达高于融合基因阳性,上述研究为RMS中研究差异miRNA提供参考,可利用miRNA做进一步研究。
综上,融合基因阳性的RMS细胞侵袭、迁移和抗凋亡能力高于融合基因阴性RMS细胞,融合基因对差异miRNA的表达可能起重要作用,这为深入研究融合基因在RMS的分子作用机制及靶向药物的研究奠定基础。
