促生菌Bacillus sp.KTS-1-1和/或氮磷钾复合肥 对太子参生长及代谢的影响
2021-01-18欧阳湖任建国焦松林王俊丽
欧阳湖,任建国,焦松林,宋 磊,何 江,徐 纬,蔡 静,张 华,王俊丽*
(1.贵州医科大学公共卫生学院,环境污染与疾病监控教育部重点实验室,贵州 贵阳 550025;2.贵州医科大学,贵州 贵阳 550025;3.贵阳农产品质量安全监督检验测试中心,贵州 贵阳 550081)
太子参(Pseudostellaria heterophylla)是石竹科多年生草本植物,在中药中具有很高的药用价值。太子参含有多种活性成分,包括皂苷、多糖、氨基酸、环肽和皂苷元[1]。现代药理学研究表明,太子参具有降血糖、止咳、抗疲劳,还可用于治疗心悸等疾病,太子参多糖类成分具有免疫活性,在抗炎和调节机体免疫功能方面具有显著作用[2-7]。近年来,随着野生太子参资源的稀缺,为满足市场需求,人工栽培迅速成为太子参生产的主流。但在人工栽培过程中,长期大量施用化肥和农药,使栽培太子参的土壤日益贫瘠,产量和品质逐年下降,病虫害危害严重。
植物根际促生菌(PGPR)在改善土壤环境的同时,还能起到促进植物生长、抑制病虫害、提高植物的抗逆性等作用。PGPR通过改善植物对养分的获取或激素的刺激以达到促进植物生长的目的[8]。研究表明,PGPR可以促进小麦的生长并增加其产量[9]。从大块土壤和大豆根际分离到的PGPR菌株不仅能拮抗Sclerotium rolfsii和Sclerotinia sclerotiorum,而且还可促进大豆的生长[10]。有学者从无机磷肥土中分离得到的8株解磷放线菌,能使小麦地上部增加70%,根系增加30%[11]。与化学肥料的增产效果相比,促生菌的能力有限。如梁运江等[12]研究不同处理(菌肥、化肥、菌肥+化肥、对照)对水稻营养特性和土壤养分可持续的影响,结果表明:单施菌肥,其产量低于单施化肥处理,而菌肥与化肥配施,既保证了水稻的产量,又使土壤肥力得到改善;Molla等[13]的研究结果表明:与单独施用氮磷钾复合肥、不施用菌肥和复合肥的对照相比,施用含Trichoderma的微生物肥料能明显提高番茄产量和全糖、Vc、β-胡萝卜素、番茄红素含量,但产量均低于氮磷钾复合肥,而微生物肥料和适当比例的氮磷钾复合肥配合施用却能获得高于复合肥的产量,且使果实品质(全糖、Vc、β-胡萝卜素、番茄红素、Ca、Mg、Na)有所改善;在陈敏洁等[14]的研究中发现化肥与Bacillus pumilus菌剂配施可显著增加油麦菜维生素C和可溶性糖。在Nosheen等[15]的研究中表明,促生菌Azotobacter与25%氮磷复合肥配施后可显著提高红花种子的粗蛋白含量和氨基酸含量,促生菌Azospirillum与50%氮磷复合肥配施及Azotobacter与25%氮磷复合肥配施均可提高红花叶中内源激素(生长素和赤霉素)的水平。由以上研究可看出,促生菌与化学肥料配施,能够保证植物产量,且对其代谢也有一定的影响。为此,本研究利用已获得的一株具有抑菌、溶解无机磷、解钾功能的太子参根际促生菌Bacillussp.KTS-1-1与氮磷钾复合肥进行太子参盆栽种植试验,研究两者及其配合施用对太子参生长和代谢的影响,为合理利用微生物肥料提供科学依据。
1 材料与方法
1.1 盆栽试验及促生菌Bacillus sp.KTS-1-1和氮磷钾复合肥处理设计
将于贵州省施秉县三泓药业有限公司购买的太子参筛选出健康、无病、大小一致的太子参块根作为种子进行盆栽(盆高40 cm,直径35 cm)种植试验,在容器中盛土壤(黄壤土,有机质1.28%,全氮0.16%,有效磷4.21 mg·kg-1,速效钾113.54 mg·kg-1,pH 7.03)8 kg后放入15株太子参块根,用4 kg的土壤将太子参覆盖,每个处理3个重复,共45盆。
促生菌Bacillussp.KTS-1-1(课题组前期获取)和氮磷钾复合肥(总养分>48%,氮∶磷∶钾=15∶18∶15 )施用处理设计见表1。待太子参长出开花后对每个处理组太子参地上部喷施200 mL 处理溶液,期间根据土壤状况适当补充自来水,以保证土壤湿润。促生菌施用的浓度为 3×108CFU·mL-1(菌悬液由牛肉膏蛋白胨琼脂平板涂布培养后,用玻璃刮铲刮取菌苔于自来水中制取标定浓度)。T1为含0.25 g复合肥的100 mL水溶液和100 mL菌悬液(3×108CFU·mL-1),T2为含0.5 g复合肥的100 mL水溶液和100 mL菌悬液(3×108CFU·mL-1),T3为含1 g 复合肥的100 mL水溶液和100 mL菌悬液(3×108CFU·mL-1),T4为含2 g复合肥的200 mL水溶液,T5为200 mL 菌悬液(3×108CFU·mL-1),T6处理(浸种)是利用浓度为3×108CFU·mL-1的促生菌悬液浸泡太子参块根0.5 h后阴干再种植,施洒200 mL自来水,T7 为200 mL自来水。盆栽试验期限为2019年1月至7月。
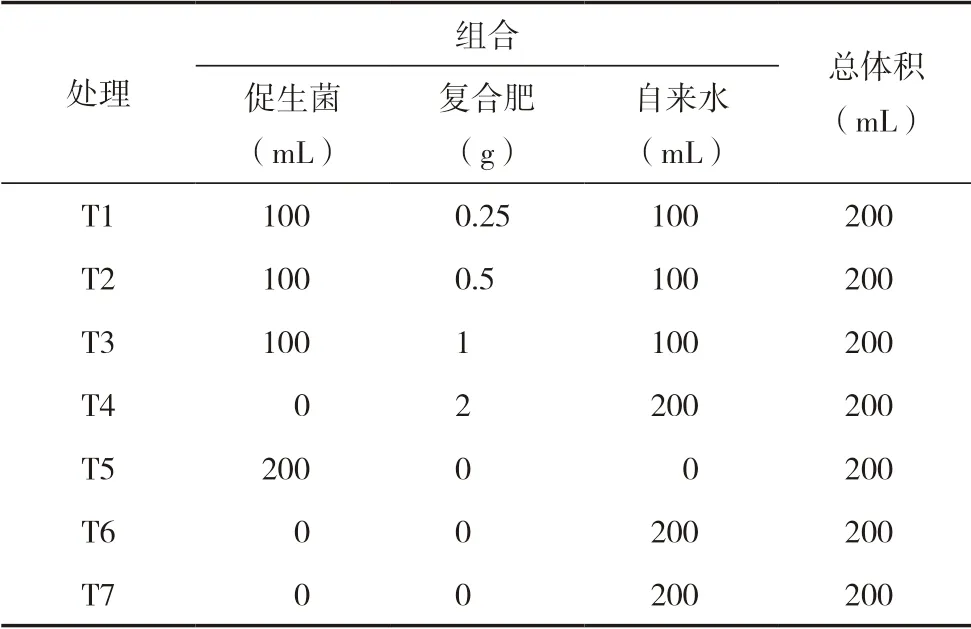
表1 促生菌Bacillus sp.KTS-1-1(3×108CFU·mL-1)与氮磷钾复合肥施用处理设计
1.2 样品的采集与预处理
太子参开花后按照表1对太子参进行处理,每隔1月对各处理的3个重复分别随机抽取3盆植株(15株/盆)进行采样且每盆样品单独包装存放,之后进行下一次促生菌和/或复合肥处理试验,直至成熟(本文数据源于第一次处理后1个月采集的样品)。采样时尽量保证植株的完整性,将采回的样品去除杂叶用蒸馏水洗净自然晾干后,叶片去茎剪碎,液氮研磨后-80℃冰箱保存,用于以下除生物量之外的各指标测定。
1.3 生物量
每个处理随机采20株太子参,称量植株鲜重,测量地上部株高,用叶面积仪(GDY-500M)测定平均叶面积,以分析促生菌、复合肥、促生菌/复合肥对太子参生物量的影响。
1.4 叶绿素及碳氮代谢
测定总叶绿素、还原糖、硝酸还原酶(NR)、总蛋白质、铵态氮、总氨基酸,以分析促生菌、复合肥、促生菌/复合肥对太子参光合作用及碳氮代谢指标的影响,每个处理3个重复,每个重复3盆(15株×3盆=45株)。
1.5 抗逆性
测定过氧化氢酶(CAT)、过氧化物酶(POD)、苯丙氨酸解氨酶(PAL)、超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APx)、木质素、丙二醛(MDA)、总酚、脯氨酸(Pro),以分析促生菌、复合肥、促生菌/复合肥对太子参抗逆性的影响,每个处理3个重复。
1.6 植物激素
测定太子参赤霉素(GA)、脱落酸(ABA)、细胞分裂素(CTK)、吲哚乙酸(IAA),以分析促生菌、复合肥、促生菌/复合肥对太子参激素的影响,每个处理3个重复。
2 结果与分析
2.1 促生菌Bacillus sp.KTS-1-1和/或氮磷钾复合肥对太子参生物量的影响
不同处理对太子参生物量的影响如表2所示。与单独施用复合肥(T4)相比:促生菌与氮磷钾复合肥配施(T1、T2和T3)可使太子参鲜重、株高和叶面积有所增加,特别是T1和T2在鲜重和株高上表现尤为明显;单独施用促生菌的T5(喷雾)和T6(浸种)在生物量各指标上能达到与T4 大致相同的效果。与单独施用自来水(T7)相比,T1~T6均会不同程度对植株鲜重、株高和叶面积起促进作用,但这种促生效果因促生菌施用方式以及促生菌和复合肥配施比例不同而不同。单独施用复合肥(T4)效果优于T7,尤其表现在株 高上。
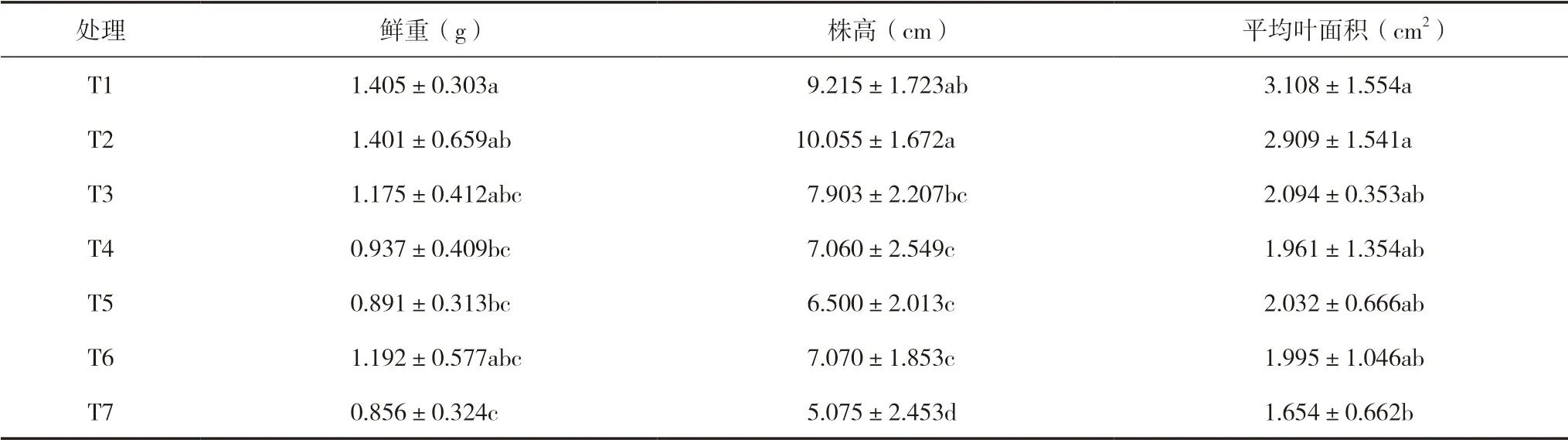
表2 不同处理对太子参生物量的影响
2.2 促生菌Bacillus sp.KTS-1-1和/或氮磷钾复合肥对太子参光合色素及碳氮代谢的影响
7个处理对光合色素的影响无显著差异,而对碳氮代谢影响具有差异性。从表3可知,在碳代谢方面:T1~T4还原糖含量均显著高于T7处理,其中T1含量最高,T2仅次于T1。在氮代谢方面:T1~T6与T7相比,促生菌和/或氮磷钾复合肥对太子参叶片总蛋白质合成无不良作用,T1、T4、T5、T6处理对叶片总蛋白质的合成有明显促进作用,且之间无显著差异,表明单独施用促生菌、促生菌与低剂量氮磷钾复合肥配合施用的效果与单独施用氮磷钾复合肥一致。
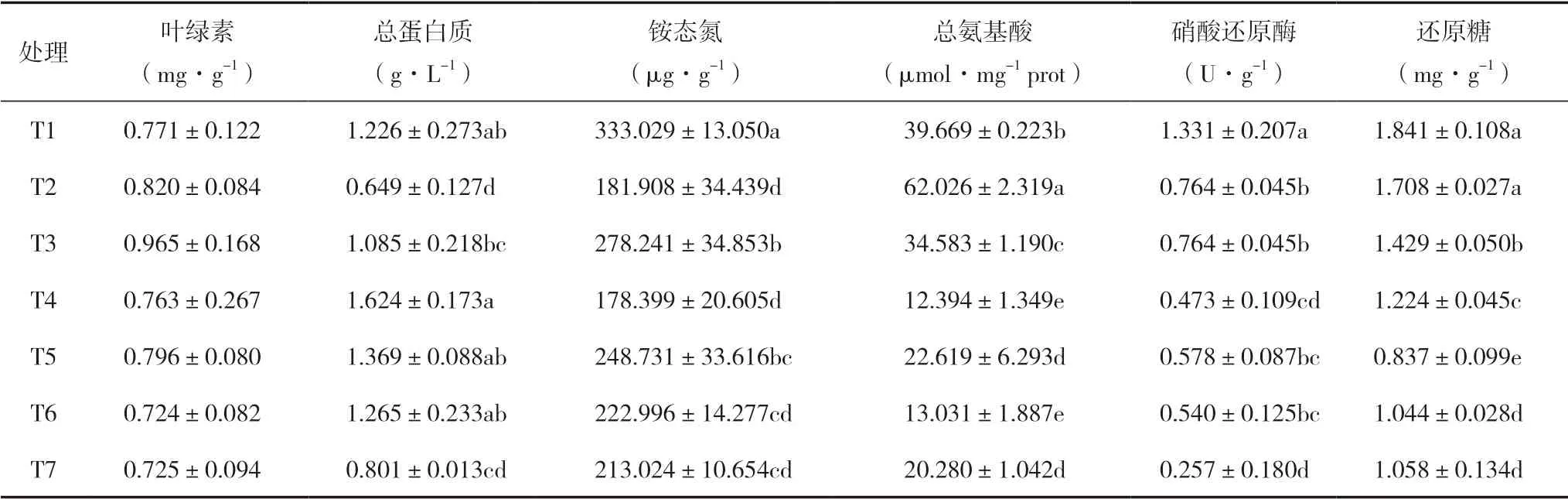
表3 不同处理对太子参光合色素及碳氮代谢的影响
与T4相比,施用促生菌(T1、T2、T3、T5、T6)后太子参叶片铵态氮和氨基酸含量及硝酸还原酶活力均有增加;与T7相比,促生菌与氮磷钾复合肥配施(T1、T2、T3)处理铵态氮和氨基酸含量及硝酸还原酶活力均增加,而T5和T6处理在铵态氮、硝酸还原酶上表现一致(均 增加)。
2.3 促生菌Bacillus sp.KTS-1-1和/或氮磷钾复合肥对太子参抗逆性的影响
促生菌和/或氮磷钾复合肥对太子参抗逆性的影响如表4。各处理组间太子参叶片SOD无显著差异,但施用促生菌的各处理其SOD活性均低于T4、T7,其中以T7处理SOD活性最强,由此可见,促生菌的施用会对叶片SOD活性产生一定的抑制作用。

表4 不同处理对太子参抗逆性的影响
各处理POD、CAT、PAL、APx、MDA、Pro、木质素及总酚存在一定差异。促生菌和/或复合肥的使用均可提高POD的活性,其中以T1和T5活性最强。上述结果表明,施促生菌可提高叶片POD的活性,但其作用效果与氮磷钾复合肥的有无及使用剂量密切相关,总体表现为促生菌处理(T5、T6)、低剂量氮磷钾复合肥配施处理(T1)>高剂量氮磷钾复合肥配施处理(T2、T3)。
与T4、T7相 比,T1、T2、T3和T6处 理CAT活性显著增强,T5无显著差异,但CAT活性较高。T4和T7间CAT活性并无差异。该结果表明:单独使用促生菌或促生菌和复合肥配施处理均能提高叶片CAT活性;单独使用促生菌以浸种(T6)CAT活性最高,促生菌与复合肥配施以低中剂量复合肥与促生菌配施(T1和T2)CAT活性最高,单独施用氮磷钾复合肥不会对叶片CAT活性产生影响。
与T7相比,促生菌和/或氮磷钾复合肥对PAL活性无显著影响;与单施用复合肥(T4)相比,T5可显著提高PAL活性,促生菌与氮磷钾复合肥配施处理(T1、T2和T3)的PAL活性均高于T4。该结果表明,喷施促生菌、促生菌与氮磷钾复合肥配施均可提高叶片PAL活性。
T1、T2、T3、T6处理APx活性均显著高于T7;与T4处理相比,单施用促生菌处理(T5和T6)的APx活性明显降低,而促生菌与低剂量复合肥配施处理(T1和T2)的APx活性明显增加。由此可见,促生菌与复合肥配施(T1和T2)可明显提高叶片APx的活性。
与T7相比,促生菌和/或氮磷钾复合肥均可显著提高木质素含量。在常规施肥(T4)水平上减少氮磷钾复合肥的使用量,增施促生菌(T1、T2、T3)可显著增加木质素含量,其中以T1处理含量最高。单施促生菌(T5和T6)与单施氮磷钾复合肥(T4)间木质素含量无差异,但T5、T6处理木质素含量均比T4高,该结果表明,单施促生菌或与氮磷钾复合肥配施均利于叶片木质素的生物 生成。
促生菌(T5、T6)、促生菌与复合肥配施(T1、T2、T3)两类处理MDA含量与T4无显著差异,T1处理MDA含量最低;与T7相比,T1和T6处理MDA含量显著降低,说明浸种或促生菌与低剂量氮磷钾复合肥(T1)可以降低植株叶片MDA含量。
与T4和T7相比,促生菌的施用可以显著增加太子参叶片总酚的含量,其中T5处理总酚含量最高,其次是T1。结果表明喷施促生菌或促生菌与低剂量氮磷钾复合肥配施可促进叶片总酚的生物 生成。
各处理组与T7间的Pro含量无显著差异。T1处理脯氨酸含量显著低于T4,其余处理与T4无显著差异。各处理中以T4的Pro含量最高,其次为单施用促生菌处理(T5、T6)。结果说明促生菌与氮磷钾复合肥配施诱导叶片生成的Pro含量低于单独施用促生菌Bacillussp.KTS-1-1或氮磷钾复合肥。
2.4 促生菌Bacillus sp.KTS-1-1和/或氮磷钾复合肥对太子参激素的影响
由表5可知,各处理组间赤霉素、细胞分裂素及脱落酸含量无显著差异,生长素有一定差异。与T7相比,T2~T6处理赤霉素含量均有提高,其中T2处理组赤霉素含量最高。T7处理脱落酸含量均高于其余各处理,其它处理中促生菌和低剂量复合肥配施处理(T1和T2)脱落酸含量最低。T4处理细胞分裂素含量最高,其次是T7,而T6和T1含量最低。T1和T7生长素含量显著低于其余处理,其中T6处理生长素含量最高。由此可见,促生菌 和/或氮磷钾复合肥配施对以上4种植物激素作用效果有所不同。

表5 不同处理对太子参激素的影响 (ng·mL-1)
3 讨论
3.1 促生菌和/或氮磷钾复合肥对太子参生物量的影响
植物的生物量是表征其长势的重要指标,PGPR是一种有益的细菌,通过多种机制在植物根系上定植,促进植物生长。Gholami 等[16]研究表明促生菌Pseudomonas putidaR-168、P.fluorescensR-93、P.fluorescensDSM 50090、P.putidaDSM291、A.lipoferumDSM 1691、A.brasilenseDSM 1690可使玉米株高、叶面积显著增加。本研究结果表明增施促生菌(T5、T6)(相对T7来说)可使太子参的株高分别增加28.1%、39.3%,鲜重分别增加4.1%、39.3%,平均叶面积分别增加22.9%、20.6%,这必然与促生菌Bacillussp.KTS-1-1发挥其促生作用功能相关[17]。有研究表明促生菌与低中剂量氮磷钾复合肥配合施用对植物生长有显著的促进作用[18-21],与过量氮磷钾复合肥配合施用,其促生增产效果则表现下降[22],这与本试验中促生菌Bacillussp.KTS-1-1与低中剂量氮磷钾复合肥(T1、T2)及高剂量复合肥(T3)配合施用的作用效果类似。
3.2 促生菌和/或氮磷钾复合肥对太子参光合色素及碳氮代谢的影响
有研究表明,接种PGPR后对提高植物叶绿素含量有积极作用[23-24],而在本研究中太子参叶片总叶绿素含量虽不受促生菌Bacillussp. KTS-1-1的影响,但却表现出随复合肥施用量的增多而增加的趋势(T4除外),这与Lopez- Cantarero等[25]报道的氮对植株叶片叶绿素含量的影响结果一致,而本研究中T4处理叶片叶绿素没有达到受复合肥影响的预期最高含量,或许也表明促生菌Bacillussp.KTS-1-1与复合肥的互作对叶片叶绿素含量提升有积极作用。
碳氮代谢作为植物体内两大最基本的代谢过程,二者共同调节碳水化合物和蛋白质的合成,且决定着植物的产量和品质[26]。本研究结果表明无论单施促生菌、复合肥或促生菌与复合肥配施均能提高叶片蛋白质含量,其中以单施氮磷钾复合肥的效果为最佳,其次为单施促生菌,再者为促生菌与复合肥配施(其中以低剂量复合肥和促生 菌配施较有利于叶片蛋白质的生物合成)。生物肥Biophosphate(含溶磷促生菌)和氮磷钾复合肥在药 用 植 物Roselle(Hibiscus sabdariffaL.)上 的 试 验表明,单施氮磷钾复合肥同样能最大程度提高叶片蛋白质含量,其次为Biophosphate与氮磷钾复合肥减量配施,再者为单施Biophosphate[27],造成本研究结果与文献[27]结果有差异的原因可能在于本试验所获得的促生菌Bacillussp.KTS-1-1为一种具有多种促生(抑菌、溶解无机磷、解钾)功能的菌株,而Biophosphate中的菌株则只具有溶 磷作用。另外,本研究结果表明单施促生菌的叶片蛋白质含量(T5和T6)明显高于对照(T7),而文 献[27]表明二者之间无差异,进一步确定了促生菌Bacillussp. KTS-1-1作为生物肥料菌株的应用价值。
已有研究表明PGPR施用于植物后,会使植物体内氨基酸含量增加[28],在本研究中,无论单独施用促生菌或促生菌与复合肥配施基本均能提高叶片氨基酸含量(特别是促生菌与复合肥配施)。与T7相比,促生菌喷施(T5)对叶片氨基酸含量的影响大于种子处理(T6),可能是由于喷施在叶片上的促生菌Bacillussp.KTS-1-1激活光合作用和代谢导致的结果[28]。有研究表明氮磷钾复合肥可提高叶片中氨基酸总量[29],而本研究显示T4处理(氮磷钾复合肥)太子参叶片氨基酸总量降低,究其原因可能是植株为了维持其生长而采取一定的措施来减除氨基酸积累带来的反馈抑制作用[30]。
铵态氮是高等植物吸收无机氮的形式之一,其被植物体吸收受铵态氮转运体家族调控,而这些转运体家族表达通常又受植物体内碳氮代谢、营养状况、光照、温度、外源氮素供应状况等外部环境因素的影响[31],本研究结果表明外源氮素供应状况对植物体铵态氮的吸收无显著影响(T4和T7相比),而促生菌的施用对植物体铵态氮吸收影响作用明显,具体表现在单独施用促生菌(T5和T6)或促生菌与复合肥配施(T1、T2和T3)均能提高叶片铵态氮含量。硝酸还原酶是植物器官中硝态氮还原同化过程中的限速酶,其活性高低与植物体内氮同化能力密切相关。不同施肥方案对小麦旗叶硝酸还原酶活力大小的影响结果表明,PGPR与推荐剂量氮磷钾肥料处理>单施推荐剂量氮磷钾肥料处理>PGPR与氮磷钾肥料(75%N)配施>PGPR与氮磷钾肥料(50%N)配施>单施PGPR[32],而本研究结果中硝酸还原酶活力却表现为PGPR+0.25 g 氮磷钾复合肥配施(T1)>PGPR+0.5 g氮磷钾复合肥配施(T2)= PGPR+1.0 g氮磷钾复合肥配施(T3)>单施PGPR(T5和T6)>单施推荐剂量氮磷钾复合肥(T4)。鉴于硝酸还原酶活性与土壤中可利用氮量的正相关性[33],造成上述两试验结果差异的原因主要是不同试验条件下土壤中可利用氮量不同,而这种不同量可利用氮的获得或许与不同环境中土壤微生物(包括外施PGPR)的作用有关[34]。
植物光合作用产物-还原糖作为渗透保护剂参与植物对水份胁迫反应[35]。已有研究表明促生菌对植物体还原糖含量的提升作用因促生菌种类和组成不同而有所差别,如溶磷菌Phosphobacteria对豇豆叶还原糖含量几乎无提升作用(1.65 mg·g-1,对照为1.62 mg·g-1),而Azospirillum则有大幅度提升(1.90 mg·g-1),Phosphobacteria+Azospirillum配合施用提升作用尤为明显(3.33 mg·g-1)[36],本研究中同样具有溶磷特性的促生菌Bacillussp.KTS-1-1单独施用(T6和T5)对太子参叶片还原糖含量的影响也表现出与Phosphobacteria作用相似的结果。关于促生菌Bacillussp.KTS-1-1和氮磷钾复合肥配合施用(T1、T2和T3)对叶片还原糖含量的影响结果与Gohil等[37]的研究结果基本一致,表现为促生菌与复合肥配合施用效果大于氮磷钾复合肥推荐使用浓度,进而确定Bacillussp.KTS-1-1和氮磷钾复合肥配施的实践可行性。
3.3 促生菌和/或氮磷钾复合肥对太子参抗逆性的影响
PGPR作为生物诱导因子,可引起植株生理和形态改变及植物防御素的积累以促进植物的生长[38]。有研究表明PGPR处理植株后会使植物组织中PAL、SOD、CAT等活性增强,脯氨酸、酚类物质的含量增加,MDA降低以提高植物对逆境的抵抗[39-42]。单独施用促生菌的各处理防御酶POD、CAT、PAL(除T6)、APx(除T5)活性增强,这与上述研究结果(除SOD)基本一致;促生菌与氮磷钾复合肥配施处理的POD与APx活性随氮磷钾复合肥使用量的增加活性逐渐降低,原因可能是促生菌促进植物对N、P元素的吸收,当植物体内N、P含量过多积累时会抑制植物氮代谢途径,使防御酶的活性降低[43-44]。在本研究中,尽管促生菌和/或氮磷钾复合肥处理间SOD活性变化无显著差异,但酶活性总体上表现为促生菌Bacillussp. KTS-1-1与复合肥配施处理=促生菌Bacillussp. KTS-1-1处理<复合肥处理<对照,这与Shahzad等[45]研究结果相一致,说明促生菌的施用降低了植株氧胁迫。本研究中促生菌不同施用方式(T5、T6)对太子参叶片PAL和APx活性的影响存在明显差异,可能与促生菌两种不同施用环境对PAL的选择性表达有关[46-47]。任何植物的抗氧化能力都高度依赖于酚类物质的种类和相对比例[48],本研究中T4和T7处理总酚、木质素含量最低,其它处理两者含量相对较高,究其原因可能是促生菌可通过激发植物体内酚类物质代谢的酶(PAL、PPO等)活性导致酚类物质的积 累[49]、增强木质化过程,进而引起木质素沉积[50]所致,这与前人报道的PGPR作用结果一致[51-53]。
3.4 促生菌和/或氮磷钾复合肥对太子参激素的 影响
植物激素在调节植物生长发育、提高植物抗逆性、促进植物生存和适应不同环境等方面发挥着重要作用[54]。本试验中,与T4、T7相比,单独施用促生菌及促生菌与氮磷钾复合肥配合施用对赤霉素、脱落酸和细胞分裂素的生成无显著影响,这与Turan等[55]关于PGPR处理植物后可使植物激素含量增加的报道不符。与T4相比,促生菌与氮磷钾复合肥配施(T1、T2、T3)处理生长素含量有所下降,其中以T1降低最为显著,本试验结果与文献[15]报道的促生菌与低剂量氮磷肥料配施可显著提高植株生长素水平结果相反。造成上述结果不符的原因可能是植物激素的生成受多方面(氮信号、蛋白质含量等)调控所致[15];与T7相比,单施用促生菌可显著增加植株生长素含量,表明Bacillussp.KTS-1-1可以诱导植株生长素的生成,这与前人的研究结果相符[55-56];施用促生菌后各处理组脱落酸低于T7,可能是Bacillussp.KTS-1-1参与调控脱落酸信号通路基因表达导致脱落酸水平降低,进而减弱其对植株生长的抑制作用[57]。
4 结论
相对太子参种植中常规施用氮磷钾复合肥来说,本研究结果表明,氮磷钾复合肥和促生菌Bacillussp. KTS-1-1(T1、T2)配施,不仅可以减少75.0%~87.5%化学肥料的使用量,还可同时促进太子参的生长代谢活动。
