土壤中一株溶磷青霉菌的分离鉴定及其应用效果研究
2021-01-18许昌超张俊涛叶少萍郑富海
许昌超,张俊涛,叶少萍,郑富海
(广州市林业和园林科学研究院,广东 广州 510405)
我国农业耕地土壤普遍存在速效磷含量偏低的情况[1]。为满足作物生长,大量磷肥的使用导致了严重的地下水污染以及地表水体富营养化等环境问题[2]。由于土壤中存在Ca2+、Al3+、Fe3+等金属离子易与可溶性磷肥形成难溶物,导致植物对磷肥的利用率极低[3],这种土壤总磷含量高但有效磷不足的情况被称作磷素的“遗传学缺乏”,而非“土壤学缺乏”[4]。研究表明,土壤中存在一类微生物可将植物无法利用的无效磷转化为植物可以吸收的有效磷,为解决植物营养性缺磷问题指明了新的方向[5]。目前,已知的溶磷菌涵盖了真菌、细菌和放线菌,其中溶磷真菌涵盖了数十个属[6-7],分离和研究较多的土壤溶磷真菌绝大多数属于曲霉属(Aspergillus)和青霉属(Penicillium),江红梅等[8]针对溶磷青霉菌进行了较为详细的罗列。多数研究认为溶磷菌的溶磷机理与菌株分泌的H+以及有机酸种类和含量有关[9]。总体来看,真菌活化和溶解土壤难溶性无机磷盐的能力要比细菌强,且效果更为稳定[6,10]。
目前,已报道的溶磷真菌能够溶解的难溶性无机磷源包括Ca3(PO4)2、 FePO4、 AlPO4、Zn3(PO4)2、 氟磷灰石以及磷矿粉等,多数对Ca3(PO4)2具有较好的溶解能力[11]。溶磷真菌的溶磷能力范围波动较大,以对Ca3(PO4)2的溶解能力为例,杨顺等[12]从作物根围土壤中筛选出的黑曲霉(A.niger)和塔宾曲霉(A.tubingensis)的溶解量分别为83.36 和79.50 mg/L;李学平等[13]从盐碱地草坪根际筛选出的真菌溶磷能力达到310.23 mg/L;史发超等[14]从玉米和大豆土壤根际筛选出的一株斜卧青霉菌(P.decumbens)的溶磷能力高达956 mg/L;姜焕焕等[15]从土壤中筛出的16株真菌溶磷量在 11.4 ~231.7 mg/L之间。
李海云等[3]对文献中溶磷菌的来源进行统计分析,发现溶磷菌的分布具有很强的根际效应;赵小蓉等[16]也发现玉米和小麦根际溶磷菌数量比非根际土壤中的溶磷菌数量要高出1~2个数量级。因此,从植物根际土壤中可能更容易筛选出溶磷 菌株。
目前,国内外关于溶磷菌的使用方式和效果也开展了较多的研究。Wang等[17]利用不同灭菌方式(伽马射线灭菌或高温灭菌)处理的泥炭、玉米芯、珍珠岩、麦麸以及腐熟牛粪搭配组合来作为溶磷黑曲霉的载体,添加到白菜种植土中后,显著提高了土壤有效磷含量和白菜植株的生物量,同时实现了黑曲霉菌株在土壤中的稳定续存。史发超等[14]向农田土壤中接种一株斜卧青霉菌,相对于不接种菌剂的农田,其玉米产量增加2.4 t/hm2,增产率达到35.3%。闫辉等[18]发现不同形态氮素和溶磷菌混施对土壤有效磷增量和小白菜促生的效果存在 差异。
考虑到溶磷真菌在溶磷能力和溶磷稳定性方面的优势,该研究以广州南沙区农田作物根际土壤为筛选对象,进行新优溶磷真菌的筛选并获得一株溶磷青霉菌。经鉴定该菌为P.brocae,目前国内外关于该种青霉菌的研究较少,对其溶磷能力的描述更是鲜见报道。本文进一步对P.brocae的溶磷特性进行了分析,并结合栽培试验验证了该菌株的应用潜力,为新优溶磷菌剂的开发和研究提供理论依据和可用的菌株资源。
1 材料与方法
1.1 试验材料
土壤样品:采集自广州市南沙区耕地土壤。
改良Pikovskaya(PVK)培养基:Glucose 10 g,无机氮源[(NH4)2SO40.5 g或KNO30.76 g,二者N含量相同],NaCl 0.3 g,KCl 0.3 g,MgSO4·7H2O 0.3 g,FeSO4·4H2O 0.03 g,MnSO4·4H2O 0.03 g,Yeast extract 0.5 g,无机磷源[Ca3(PO4)2、FePO4或AlPO4,其中P素含量2 g,相当于Ca3(PO4)210 g、FePO49.74 g或AlPO47.87 g,在培养基灭菌后分别单独加入],Agar 15 g(固体平板),文中无特别说明磷源均选择Ca3(PO4)2,氮源均选择(NH4)2SO4,蒸馏水补足1 L,pH调节至7.0左右,灭菌120 ℃,30 min。
溶磷真菌筛选培养基:以Ca3(PO4)2为无机磷源的PVK固体培养基,分别添加氯霉素和链霉素至终浓度为50 mg/L。
PD/PDA培养基:马铃薯葡萄糖液体/马铃薯葡萄糖固体培养基(BD,美国)。
分子试验材料:真菌DNA提取试剂盒(OMEGA,美国);PCR试剂盒(东盛,国产)。
HPLC标准品:乙酸、乳酸、丙二酸、琥珀酸、柠檬酸、葡萄糖酸和酒石酸(Sigma-Aldrich,美国)、苹果酸(源叶生物,国产)。
1.2 试验方法
1.2.1 分离、纯化和培养
称取10 g土壤,放入500 mL三角瓶中,加100 mL无菌水,摇床振荡30 min(30℃,200 r/min),将适量悬液用溶质质量分数为0.9%的灭菌NaCl水溶液按体积比梯度稀释至10-4,取100 μL稀释液均匀涂布在溶磷真菌筛选培养基上,每个样品重复3次,然后放于30℃培养箱培养5 d,每天对平板上菌落的生长和溶磷圈进行跟踪 观察。
将溶磷真菌筛选培养平板上具有溶磷圈的菌落重新接种在改良的PVK培养基平板上进行纯化和溶磷圈的观察。将纯化了的真菌菌落接种到PDA平板或PDA斜面进行形态观察和保存,在PDA平板上挑取菌落接种于液体PD培养基中进行扩繁,用于DNA提取和鉴定。
1.2.2 DNA提取和鉴定
取3 mL真菌液体培养基(OD600约0.8~1.0), 10 000 r/min,5 min收 集 菌 体,0.8% NaCl清 洗2次(重悬后离心收集菌体),利用真菌DNA提取试剂盒提取DNA。利用引物ITS1(5’-TCCGTAGCTG AACCTGCGG-3’)和ITS4(5’-TCCTCCGCTTATT GATATGC-3’)对真菌ITS序列进行扩增(94℃ 2 min;94℃ 30 s,55℃ 30 s,72℃ 30 s,30 cycles;72℃ 5 min;4℃ forever),反应体系:PCR premix 25 μL,ITS1 1 μL(10 μmol/L),ITS4 1 μL(10 μmol/L),Template 1 μL,加水补足至50 μL。回收PCR产物,进行基因测序分析。
1.2.3 液体培养条件下的溶磷能力测定
液体培养试验共设置3种无机磷盐[Ca3(PO4)2、 FePO4或AlPO4]和 两 种 氮 源[(NH4)2SO4或KNO3],重复4次。将平板上的菌株接种到3 mL液体培养基中,待OD600达到0.6左右,取3 mL接种到装有500 mL无机磷液体培养基的三角瓶中,摇床振荡培养,每隔24 h取样一次,连续取样7 d,对样品进行离心,收集上清液,利用钼锑抗比色法测定液体中有效磷含量,并记录对应pH,以7 d内能够达到的最大溶磷量为溶磷峰值。
1.2.4 溶磷菌促生效果盆栽试验
供试土壤为广州市常见的山地红壤。钙镁磷肥(P2O5含量为10%)与土壤按照0.5 g/kg的比例混合,孢子悬液(1×108cfu/mL)或水按照10 mL/kg土壤添加,试验设计如表1所示。每个处理3个重复,采用方形育苗盘(52 cm × 52 cm × 13 cm),每盆装土15 kg且移栽长势一致的小白菜16株,移栽30 d后测量根际抖落土壤有效磷含量(NaHCO3浸提)、小白菜植株鲜重以及干重,记录分析。

表1 试验设计
1.2.5 发酵液小分子有机酸组成分析
取P6发酵液,经高速离心(13 000 r/min,30 min)后取上清液,过0.45 μm滤膜压滤等处理,用高效液相色谱仪(岛津,LC-20A)检测有机酸种类和含量。色谱条件见表2。

表2 色谱参数
1.2.6 数据分析
用MEGA 5.0构建系统发育树,采用SPSS 21.0对数据进行分析。
2 结果与分析
2.1 溶磷菌的分离与鉴定
以Ca3(PO4)2为无机磷源,从农田土壤中得到一株溶磷真菌,从外观上看初步判断为青霉属(Penicillium),命名为P6(图1)。将纯化后的P6分别接种于AlPO4、FePO4和Ca3(PO4)2无机磷筛选平板上(图2),观察发现P6在AlPO4平板上的菌落最小,无可见溶磷圈;在FePO4平板上,基内菌丝和气生菌丝的着色均较深,无可见溶磷圈;在Ca3(PO4)2平板上基内菌丝和气生菌丝着色最浅,基本呈乳白色,略带青色,周围有较浅溶磷圈。为了优化P6在Ca3(PO4)2平板上溶磷圈的观察条件,这里以Ca3(PO4)2浓度和观察时间为变量,照片记录溶磷圈的变化情况(图3),从图中可以看出Ca3(PO4)2浓度越低,溶磷圈出现的时间越早且越明显,说明在筛选初期适当降低Ca3(PO4)2浓度可方便溶磷圈观察。

图1 P6在PVK平板上的成熟形态

图2 P6在含Ca3(PO4)2、AlPO4或FePO4平板上的 菌落形态和溶磷情况

图3 P6在平板上产生的溶磷圈特征与Ca3(PO4)2 浓度和培养时间之间的关系(平板反面)
将ITS序列测序结果和已知的其它青霉菌属菌株进行序列比对,并利用Mega 5.0构建系统发育树(图4)。结果显示,P6和P.brocae的同源性高达99.8%,目前尚未见关于该种溶磷菌的相关 报道。
2.2 P6的溶磷能力分析
为了量化P6的溶磷能力,对液体环境下连续培养7 d内的P6溶磷峰值进行了分析(表3),在以(NH4)2SO4为氮源的培养基中,P6溶解Ca3(PO4)2的能力在第4 d达到峰值(403.4 mg/L);对AlPO4的溶解量在第2 d达到峰值(14.5 mg/L);对FePO4的溶解量在第3 d达到峰值(16.5 mg/L),P6对3种无机磷源的溶磷能力总体表现为Ca3(PO4)2> FePO4>AlPO4。在以KNO3为氮源的培养基中,P6在上述3种无机磷培养液中的溶磷能力分别于 第4、第3和第4 d达到溶磷峰值分别为428.7、11.6和10.1 mg/L,溶磷偏好性表现为Ca3(PO4)2> AlPO4>FePO4。总的来说,以NO3-替代NH4+,能提高P6对Ca3PO4的溶解能力,但对AlPO4和FePO4的溶解能力均有所降低。前面的试验表明,P6不能在含AlPO4和FePO4的固体平板上形成溶磷圈,但在液体环境下能够溶解AlPO4和FePO4,从溶磷量上来看,要远小于P6对Ca3(PO4)2的溶解能力。

表3 P6在液体培养条件下氮源对Ca3(PO4)2、FePO4和AlPO4的溶磷峰值 (mg/L)
2.3 P6发酵液pH变化和组成分析
对发酵过程中的PVK培养基的pH进行跟踪检测发现,随着培养时间延长,发酵液的pH总体呈下降趋势(图5)。有相关研究表明,溶磷真菌的溶磷作用与其分泌的有机酸密切相关,在此基础上通过HPLC对培养基的有机酸组成进行分析。标准品和P6发酵液样品色谱图如图6、7所示,结果表明培养基中有较高含量的草酸和乳酸以及少量的苹果酸和柠檬酸,这可能是导致发酵过程中培养基的pH持续下降的原因。

图5 溶磷菌P6发酵液的pH随时间的变化关系
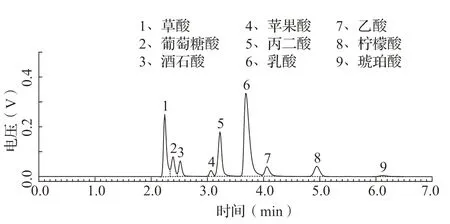
图6 9种有机酸标准品色谱图
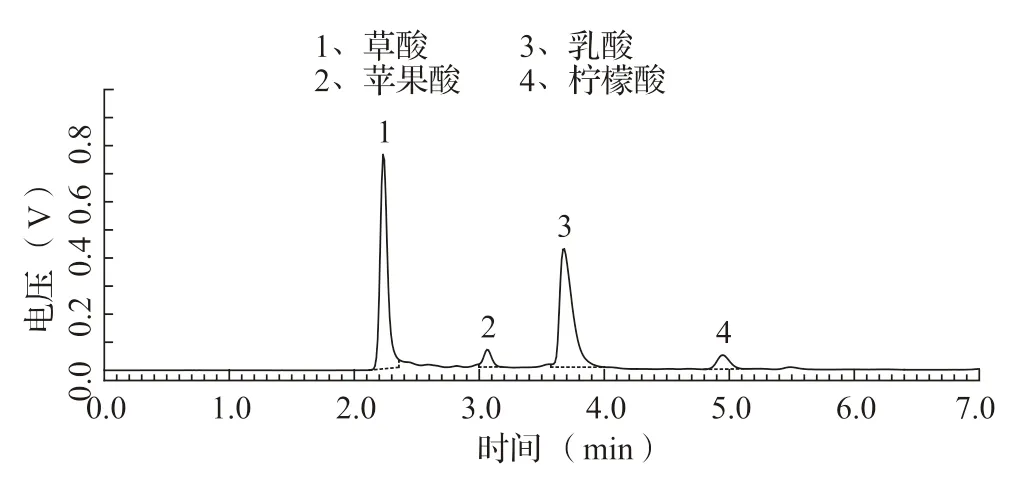
图7 P6培养基有机酸组成色谱图
2.4 P6对小白菜的促生效果
本研究对处理和对照组小白菜的鲜重、干重以及根际土壤有效磷含量进行了统计分析(表4),发现T2处理组的上述各项指标均优于其他3组,较对照组CK2处理分别提高了21.8%、16.0%和13.6%,且差异显著(P<0.05),说明了在P6和钙镁磷肥混合施肥的情况下,P6能够提高钙镁磷肥的肥效。此外,数据分析还表明,尽管T1处理在各项检测指标上均不及CK2处理,但T1处理的小白菜鲜重和根际土壤有效磷含量相较于CK1处理分别增加了10.2%和14.2%,有显著提高,该结果说明单独向土壤中添加P6的改良和促生效果不及添加钙镁磷肥,但P6的添加确实起到了增加土壤有效磷含量和促进小白菜生长的作用。

表4 溶磷菌P6对小白菜(B.chinensis)的促生效果评价
3 讨论
国内外关于青霉属菌株的溶磷能力研究有较多报道,涉及的种类包括草酸青霉菌(P.oxalicum)、棘孢青霉菌(P.aculeatum)以及拜莱青霉菌(P.bilaiae)等,其中拜莱青霉菌已经在国外被广泛用于作物增产研究和应用[19-21]。本文从土壤中筛选出了一株具有溶磷能力的P.brocae菌株(图1),目前尚未见该种青霉菌溶磷特性方面的相关报道。从P6菌落生长状态上看(图2),同时期的P6在Ca3(PO4)2、AlPO4和FePO4平板上的菌落直径和外观(主要是孢子产生导致的气生菌丝颜色深浅和基内菌丝色素沉积等方面)存在差异,这可能与菌株在不同磷源平板上获取生长所需磷元素的能力以及不同金属元素对菌株的毒性有关。
文中研究了溶磷菌P6在不同浓度的Ca3(PO4)2平板上溶磷圈出现时间和大小随时间的变化关系(图3),发现降低Ca3(PO4)2的浓度可以使溶磷圈出现的时间提前,且溶磷圈更明显,容易观察。因此,建议从土壤中筛选溶磷菌时可适当降低Ca3(PO4)2浓度,一方面方便溶磷圈观察,另一方面可以缩短溶磷圈出现的时间,这会降低平板上众多菌株间交叉污染的概率,节省纯化时间。此外,低浓度的Ca3(PO4)2平板可能会提高环境中溶磷菌资源发掘的概率(如一些溶磷能力稍弱的菌种)。P6不能在以AlPO4和FePO4为无机磷源的筛选平板上产生溶磷圈(图2),但是在液体培养环境下可以检测到对AlPO4和FePO4的溶解能力(表3),P6对二者的溶解能力要显著低于对Ca3(PO4)2的溶解能力,这可能是导致在AlPO4和FePO4平板上肉眼无法观察到显著溶磷圈的原因之一。叶劲松等[22]也报道了一株在固体平板上不能产生溶磷圈,但具有溶磷能力的霉菌。综合前人的研究结果来看,与青霉菌相比,黑曲霉具有更好的溶解AlPO4和FePO4的能 力[23-24]。因此,可以考虑用黑曲霉和青霉菌做成复合菌剂来使用。
Asea等[25]研究认为溶磷菌需要依靠吸收NH4+-N来分泌H+,从而达到溶磷的目的。虞伟斌等[26]阐述了一株假单胞菌以NH4+代替NO3-作为氮源能更好地溶解Ca3(PO4)2,溶磷能力提高了37倍。林英等[27]也发现一株伯克氏菌以NH4+作为氮源表现出更强的溶磷能力。此外,氮源种类也会影响菌株的代谢途径和分泌有机酸的种类和量,如范丙全等[28]发现以NH4
+代替NO3-能显著增加两株供试青霉菌分泌有机酸的种类和产量,但溶解摩洛哥磷矿粉的能力却有所降低,说明可能存在其他不依赖H+和有机酸的溶磷机理。在针对P6的溶磷特性研究中发现,利用NO3-代替NH4+的情况下,菌株对Ca3(PO4)2的溶解能力提高,但对AlPO4和FePO4溶解存在降低趋势,可能预示着P6对AlPO4和FePO4的溶解存在不一样的溶磷机理(表3)。总的来看,氮源种类对菌株溶磷能力的影响受菌株和磷源种类的影响较大,尚无确切定论[23,28]。对P6的发酵液检测和分析确实发现了pH降低和有机酸分泌的现象(图5、6和7),赵小蓉等[23]认为Ca3(PO4)2溶解可能是由于真菌分泌的质子和有机酸络合双重作用的结果,而AlPO4和FePO4的溶解可能只通过络合作用,所以一般情况下溶磷菌更易溶解Ca3(PO4)2。王光华等[24]研究表明改变碳源种类也可以提高菌株的溶磷能力,未来可以尝试通过改变碳源种类来提高P6的发酵和溶磷潜力。此外,P6在7 d内的溶磷峰值并未出现在pH最低的节点上,二者相关性并不明显,但该现象也不能排除有机酸分泌和pH降低在菌株溶磷过程中的作用,这可能是与其它未阐明的溶磷相关因素共同作用的结果。
溶磷菌能够提高土壤中有效磷含量,促进作物生长[29],有研究表明直接向土壤中添加小分子有机酸能够提高土壤有效磷含量[30]。因此,溶磷菌的促生作用可能与其分泌的有机酸有关,也有研究表明若干溶磷菌株可分泌植物生长激素IAA(吲哚乙 酸)[8]。本试验中利用小白菜作为供试植物,对溶磷菌P6的使用效果进行了量化分析。结果表明,P6除了能够提高土壤有效磷含量之外,还能提高钙镁磷肥的肥效,从而促进小白菜生物量的增加(表4)。
4 结论
从土壤中筛选出一株溶磷青霉菌,经鉴定为P.brocae,目前尚未见关于该菌株在溶磷特性方面的报道。研究表明,该菌对Ca3(PO4)2具有良好的溶解能力,对AlPO4和FePO4的溶解效果则较差,适当调节固体筛选培养基中的Ca3(PO4)2含量可改善溶磷圈的观察效果。P6的培养基随培养时间延长,pH总体呈降低趋势,并且在培养基中检测到草酸、苹果酸、乳酸和柠檬酸,溶磷能力和pH并无紧密关联。小白菜B.chinensis栽培实验表明P6能够提高根际土壤有效磷含量,也可以提高钙镁磷肥对小白菜的促生效果。
