硅和硒对镉胁迫下黄瓜幼苗光合作用和抗氧化酶系统的影响
2023-03-22于敏敏樊文华刘奋武田露丹王改玲孟庆慧
于敏敏,樊文华,刘奋武,田露丹,王改玲,孟庆慧
(1.山西农业大学 资源环境学院,山西 太谷 030801;2.山西农业大学 农业资源与环境国家级实验教学示范中心,山西 太谷 030801)
镉(Cd)是农业生态环境中广泛存在的重金属污染物,因具有不可降解的特性,所以在土壤中长期存在,土壤中的Cd 容易被植物吸收并积累[1]。被作物吸收积累的Cd会对作物产生毒害作用,对作物的生长发育、产量和品质等产生影响[2]。此外,作物中的Cd通过食物链的方式被摄入人体,对人体的健康造成损伤[3-4]。因此,缓解Cd 的毒害作用,减少植物对Cd的吸收和积累,对作物的生长发育和人类的食品安全尤为重要。
为了缓解Cd 的毒害作用,目前已有多种方法,通过降低Cd 的生物有效性进行土壤修复是近年来的研究热点[5]。其中,外源添加硅(Si)或硒(Se)被认为是缓解作物Cd 毒害效应的有效途径[6]。WANG等[7]最先发现土壤中施适量浓度的Si能够提高水稻对Cd 的抗逆性,有利于水稻的生长发育。研究表明,外源添加Si 可有效减缓Cd 对白菜、辣椒等植物的毒害作用,减少植物体内Cd 含量[8-10]。还有研究还表明,Si 浓度和Cd 浓度之间存在依赖性,缓解程度随物种、品种或生态型的不同而表现出差异[11]。贾茜茹等[12]、李二豹等[13]已就Si 对Cd 胁迫下黄瓜的影响进行了研究,结果发现,当添加5 mg/kg Cd、300 mg/kg Si时,黄瓜中的Cd 含量虽显著减少,但仍未达到食品安全国家标准。
Se 是人和动物必需的微量元素,被作为一种免疫功能增强剂[14]。此外,Se 对Cd、Pb 等重金属具有拮抗作用,适宜浓度的Se 能促进多种植物的生长,提高植物生物量、作物产量以及植物抗逆性。所以,目前对于Se 在农业上的应用研究越来越多,有结果表明,Se 对Cd 胁迫下油菜、黄瓜、水稻生长和抗氧化等具有积极作用[15-18]。
近年来,关于Si 和Se 的相互作用减轻Cd 毒性的研究逐渐增加。GAO 等[19]研究发现,叶面同时喷施Si和Se 对降低白菜地上部和地下部Cd 含量有更显著的效果。HUANG等[20]研究表明,同时施用Si和Se 显著促进水稻植株的生长,降低根和地上部丙二醛(MDA)含量,使地上部Cd 含量显著降低。然而,国内外关于Si和Se 的相互作用减轻Cd 毒性的研究大多数是在酸性土壤上进行[21-22],石灰性土壤上施用Si和Se的效果研究很少。在酸性土壤中,Si和Se都具有诱导植物抗逆性的属性,那么石灰性土壤中施用Si和Se 对Cd 毒害的缓解作用及二者同时施用效果有待进一步研究。因此,进行盆栽试验,探究了在石灰性土壤中施Si和Se 对Cd 胁迫下黄瓜幼苗光合作用及抗氧化系统的影响,为Si 和Se 在减轻Cd毒性方面的应用提供理论依据。
1 材料和方法
1.1 试验材料
采用盆栽试验,试验地点为山西农业大学资源环境学院试验站温室大棚,供试土壤为黄土状母质发育石灰性褐土,采自山西省太谷区武家堡村农田的中壤,土壤基本理化性质见表1。

表1 土壤基本理化性质Tab.1 Basic physical and chemical properties of soil
1.2 试验方法
本试验共设7 个处理:(1)空白对照(CK):不添加Cd、Si、Se;(2)Cd:添加Cd 5 mg/kg(以纯Cd 计,下同);(3)Cd+Si:添加Cd 5 mg/kg 和Si 300 mg/kg(以纯Si 计);(4)Cd+Se2:添加Cd 5 mg/kg 和Se 2 mg/kg(以纯Se 计);(5)Cd+Se4:添加Cd 5 mg/kg 和Se 4 mg/kg;(6)Cd+SS2:添加Cd 5 mg/kg、Si 300 mg/kg、Se 2 mg/kg;(7)Cd+SS4:添加Cd 5 mg/kg、Si 300 mg/kg、Se 4 mg/kg。试验所用的Cd、Si、Se 分别为氯化镉(CdCl2·2.5H2O)、硅酸钠(Na2SiO3·5H2O)、亚硒酸钠(Na2SeO3),供试黄瓜幼苗为M66。试验在内径34 cm、深36 cm的聚乙烯塑料桶中展开。
2021 年5 月3 日进行装盆,将过筛的土壤装入盆中,每桶装土14 kg,施尿素3 g、磷酸二氢钾3 g 作为底肥,施入各处理添加物,搅拌均匀,控制土壤含水量在20%左右平衡15 d。5 月19 日,移栽黄瓜苗(长势一致),每个处理3 盆,每盆2 株,为保证生长条件一致,各处理盆栽位置随机摆放,定时更换盆栽位置,定时定量浇水,使土壤含水量保持在70%左右。
2021 年6 月5 日,黄瓜幼苗移栽15 d 后,使用便携式光合仪(USA)在9:00—11:00 选取黄瓜功能叶片(从上向下数第4 个叶片),测定叶片净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)。系统光强为1 600 μmol/(m2·s),CO2浓度为300 μmol/mol,叶室温度为30 ℃。
2021 年6 月6 日对黄瓜苗期植株进行取样,取样后先用量尺测量茎粗、株高和根长,再用去离子水清洗并吸干表面残留水分,分别测定植株地上部和地下部的质量,然后将样品置105 ℃下杀青0.5 h,80 ℃下烘干,直到达到恒定质量,用烘干的样品测定地上部和地下部的干质量。
叶绿素含量采用丙酮直接浸提法测定;MDA 含量采用硫代巴比妥酸法测定;超氧化物歧化酶(SOD)活性采用NBT(氮蓝四唑)光还原法测定;过氧化物酶(POD)活性采用愈创木酚法测定;过氧化氢酶(CAT)活性采用高锰酸钾滴定法[23]测定。
1.3 数据分析
使用Excel 2019 和SPSS 23.0 软件对数据进行统计分析,对数据进行单因素方差分析,并运用Duncan’s 检验法对数据进行差异显著性水平的检验(P<0.05)。利用Origin 2019进行作图。
2 结果与分析
2.1 Si和Se对Cd胁迫下黄瓜幼苗生长的影响
如表2 所示,与CK 相比,单施Cd 处理下黄瓜的株高、地上部鲜质量、地下部鲜质量、地上部干质量及地下部干质量分别降低了9.91%、36.71%、30.19%、42.51%、37.33%,差异显著(P<0.05)。在Cd 胁迫下,与单施Cd 相比,施用Si、Se2、Se4、SS2、SS4 黄瓜的茎粗增加了31.48%~64.81%,株高增加了3.30%~8.36%,根长增加了7.67%~24.28%,地上部、地下部鲜质量增加了73.68%~106.54%、35.70%~88.10%,地上、地下部干质量分别增加了93.87%~141.38%、51.06%~100.00%。施用SS2 时的黄瓜生长状况最好,黄瓜的茎粗、株高、根长、地上部鲜质量、地下部鲜质量、地上部干质量、地下部干质量与单施Cd 相比分别增加了64.81%、8.36%、24.28%、106.54%、86.96%、141.38%、100.00%(P<0.05)。Cd 胁迫下,施用SS2 时黄瓜的地上部、地下部鲜质量以及地上部干质量显著高于单施Si 和Se2,且显著高于CK。可见,施用Si 和Se 可有效缓解Cd 对黄瓜生长的抑制,促进了黄瓜的生长发育,同时施用Si 和Se 的作用效果比单施Si 或Se 好,同时施用300 mg/kg Si和2 mg/kg Se的作用效果最好。
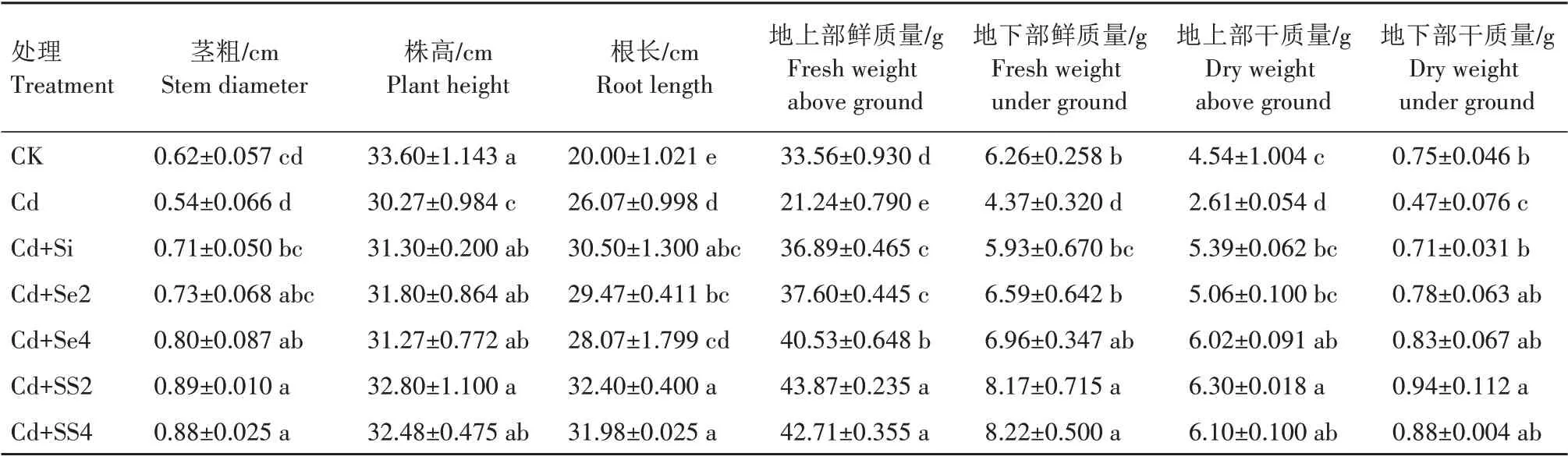
表2 Si和Se对Cd胁迫下黄瓜幼苗生长的影响Tab.2 Effects of silicon and selenium on cucumber seedling growth under cadmium stress
2.2 Si和Se对Cd胁迫下黄瓜幼苗叶片光合作用的影响
2.2.1 色素含量 由表3 可知,单施Cd 处理下黄瓜叶片叶绿素a、叶绿素b、总叶绿素以及类胡萝卜素含量与CK 相比分别降低了25.27%、26.67%、27.86%和39.68%,差异显著(P<0.05)。在Cd 胁迫下,与单施Cd 相比,施用Si、Se2、Se4、SS2、SS4 的黄瓜叶片叶绿素a 含量增加了23.74%~67.63%,总叶绿素含量增加了13.23%~57.14%,类胡萝卜素含量增加了15.79%~50.00%,差异显著(P<0.05),叶绿素b 含量增加-21.82%~25.45%,差异不显著。施用SS2、SS4的叶绿素a、叶绿素b、总叶绿素以及类胡萝卜素含量基本都高于单施Si、Se2、Se4,施用SS2 时叶绿素含量达到最高,叶绿素a、总叶绿素以及类胡萝卜素含量与单施Cd 相比分别增加了67.63%、57.14%和50.00%,差异显著(P<0.05)。可见施用Si和Se 可以有效缓解Cd 毒害,显著提高黄瓜叶片叶绿素含量,施用300 mg/kg Si 和2 mg/kgSe 的作用效果最好。
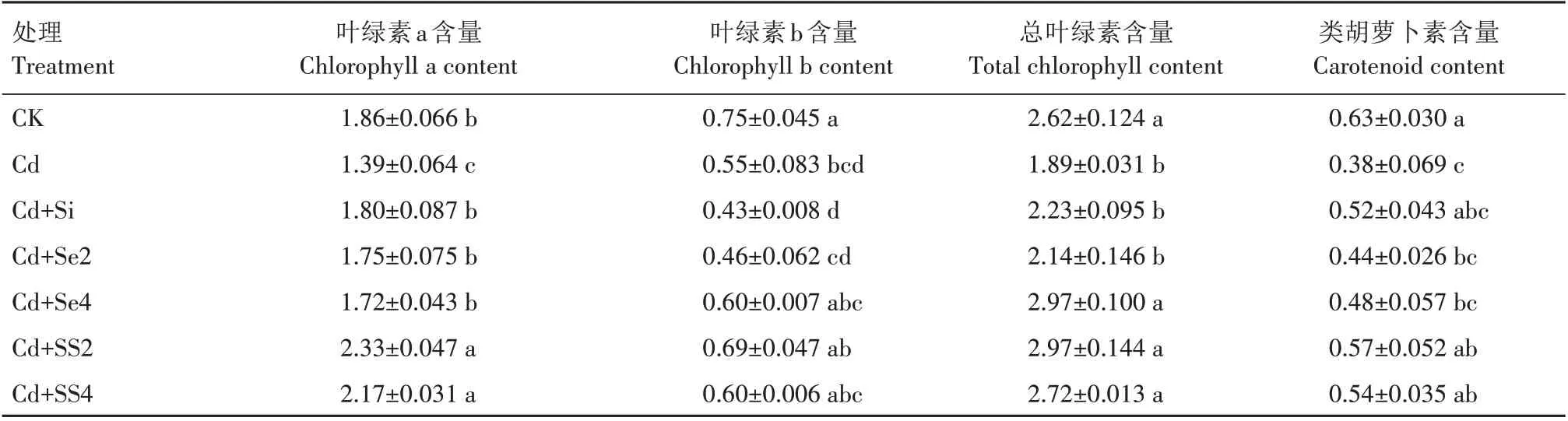
表3 Si和Se对Cd胁迫下黄瓜幼苗叶片色素含量的影响Tab.3 Effects of silicon and selenium on pigment content in cucumber seedlings under cadmium stress mg/kg
2.2.2 光合作用参数 由图1A 可以看出,Cd 胁迫显著抑制了黄瓜叶片Pn,单施Cd 处理下叶片Pn 与CK 相比降低了24.67%,差异显著(P<0.05)。在Cd胁迫下,与单施Cd 相比,单施Si 叶片Pn 提高了15.24%,差异显著(P<0.05),单施Se2 叶片Pn 提高了6.30%,差异不显著,单施Se4 叶片Pn 提高了9.74%,差异显著(P<0.05)。施用SS2 和SS4 的叶片Pn与单施Cd相比分别提高了18.53%、17.95%,差异显著(P<0.05)。施用Si、Se4、SS2、SS4 与单施Cd 相比叶片Pn 均显著提高,减轻了Cd 对黄瓜叶片Pn 的毒害,但叶片Pn 仍显著低于CK,未彻底消除Cd 的毒害。施用SS2、SS4 与单施Si相比Pn 有所提高,但差异不显著,与单施Se2、Se4相比,Pn提高且差异显著。可见Si、Se 的施用可减轻Cd 对黄瓜叶片Pn 毒害作用,且Si对提高黄瓜叶片Pn起主要作用。
从图1B 可以看出,Cd 胁迫使得黄瓜叶片Ci 显著增大,单施Cd 处理下Ci 比CK 增加了68.56%,差异显著(P<0.05)。在Cd 胁迫下,与单施Cd 相比,单施Si叶片Ci降低了9.81%,单施Se2和Se4分别降低了22.65%和22.02%,差异显著(P<0.05)。施用SS2和SS4 叶片Ci 与单施Cd 相比分别降低了35.61%和31.08%,差异显著(P<0.05)。施用Si、Se2、Se4、SS2、SS4 均使得叶片Ci 显著低于单施Cd,且施用SS2、SS4 的叶片Ci 低于单施Si、Se2、Se4,但各处理叶片Ci仍显著高于CK。说明施用Si和Se在一定程度上减轻了Cd 对黄瓜叶片Ci 的毒害,且Si 和Se 同时施用的作用效果更明显,但仍不能彻底消除Cd的毒害作用。
由图1C 可以看出,Cd 抑制了黄瓜叶片的Tr,单施Cd处理下叶片Tr与CK 相比降低了23.29%,差异显著(P<0.05)。在Cd 胁迫下,单施Si、Se2、Se4的叶片Tr 与单施Cd 相比分别增加了30.97%、28.41%和24.21%,差异显著(P<0.05)。施用SS2 和SS4 的叶片Tr 与单施Cd 相比分别增加了42.67%和34.77%,差异显著(P<0.05)。施用SS2 的叶片Tr 最高,且显著高于单施Si、Se2、Se4 和CK。说明单独或同时施用Si和Se均减轻了Cd对黄瓜叶片Tr的毒害,且同时施加300 mg/kg Si和2 mg/kg Se的效果最好。
由图1D 可知,Cd 胁迫对黄瓜叶片Gs 产生了抑制作用,单施 Cd 处理下叶片 Gs 与 CK 相比降低了56.76%,差异显著(P<0.05)。在Cd 胁迫下,与单施Cd 相比,单施Si 叶片Gs 提高了31.25%;单施Se2 叶片Gs 提高了37.5%,差异显著(P<0.05)。单施Se4叶片Gs 较单施Cd 有所提高,提高了31.25%,但差异不显著。施用SS2 和SS4 叶片Gs 与单施Cd 相比分别提高了87.50%和68.75%,差异显著(P<0.05)。施用Si、Se2、Se4、SS2、SS4 叶片的Gs 与单施Cd 相比均有所提高,但整体上Gs 仍显著低于CK。施用SS2、SS4的叶片Gs与单施Si、Se2、Se4相比均有所提高,差异显著。因此,在Cd胁迫下,单独或同时施用Si和Se在一定程度上提高了叶片Gs,但整体仍显著低于 CK,未完全消除 Cd 对黄瓜叶片 Gs 的毒害。
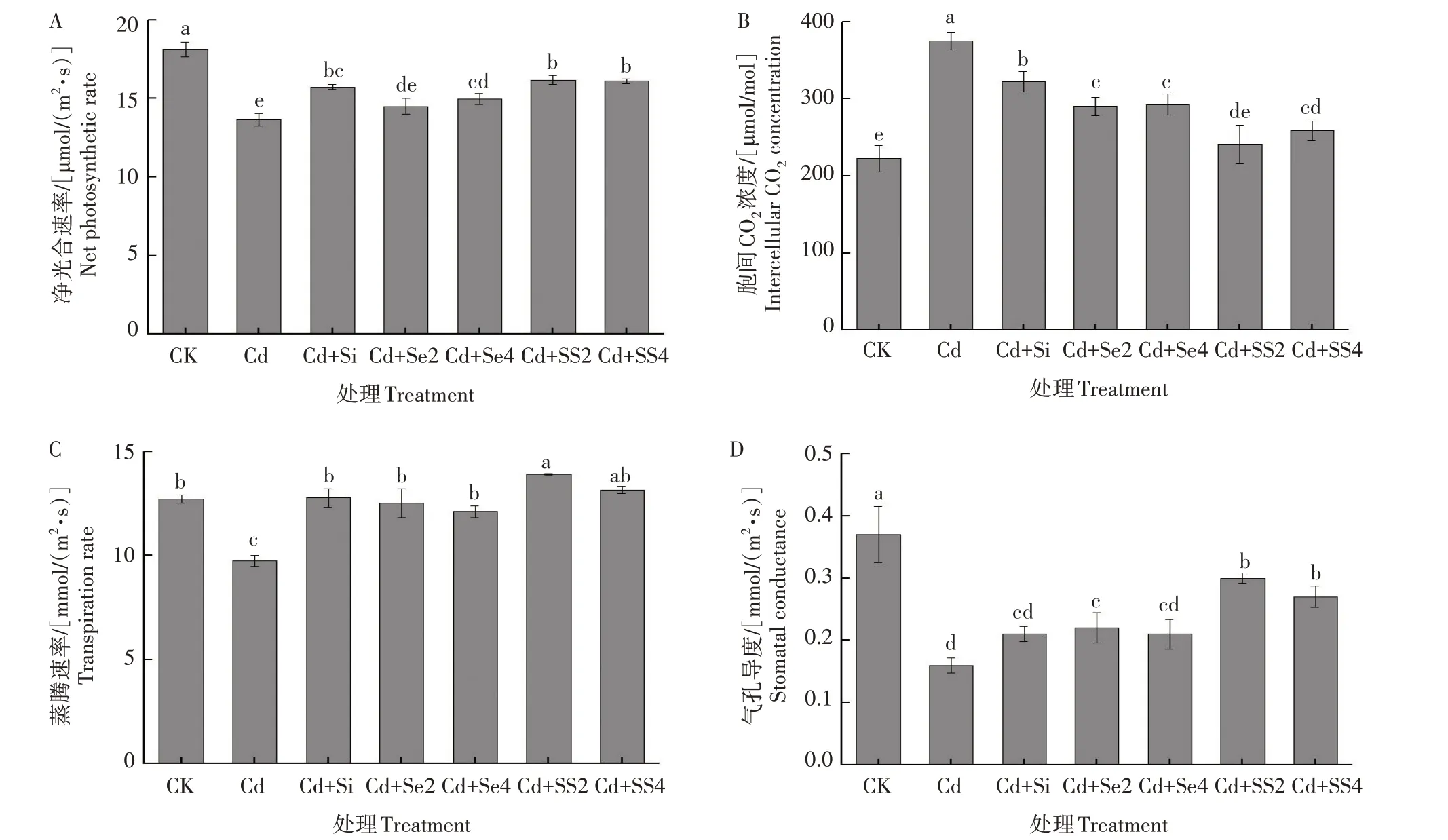
图1 Si和Se对Cd胁迫下黄瓜幼苗叶片光合作用参数的影响Fig.1 Effects of silicon and selenium on photosynthetic parameters of cucumber seedlings under cadmium stress
2.3 Si和Se对Cd胁迫下黄瓜幼苗叶片抗氧化酶系统的影响
由图2A 可知,Cd 胁迫使黄瓜叶片MDA 含量显著增加,单施Cd处理下MDA含量与CK相比增加了57.39%,差异显著(P<0.05)。在Cd胁迫下,单施Si、Se2、Se4 时MDA 含量与单施Cd 相比分别降低了13.96%、24.50%、14.40%,差异不显著。施SS2 和SS4 时叶片MDA 含量与单施Cd 相比降低了42.68%、40.61%,差异显著(P<0.05)。施SS2 的MDA 含量较单施Si 和Se2 相比降低了33.34%和24.07%,施SS4 的MDA 含量较单施Si 和Se4 分别降低了28.76%和30.54%,差异显著(P<0.05)。施用SS2和SS4的MDA含量与CK处理相比差异不显著。因此,同时施加Si 和Se 对缓解Cd 的毒害具有协同作用,显著降低了黄瓜叶片MDA含量。
如图2B 所示,Cd 毒害显著降低了苗期黄瓜POD 活性,单施Cd 处理下POD 活性与CK 相比降低了37.55%,差异显著(P<0.05)。在Cd 胁迫下,单施Si、Se2、Se4 的POD 活 性 与 单 施Cd 相 比 提 高 了35.71%、33.49%和45.28%,差异显著(P<0.05),且三者之间POD 活性差异不显著。施用SS2 和SS4 时的POD 活性与单施Cd 相比,提高了87.65% 和83.85%,差异显著(P<0.05)。施用SS2 的POD 活性最高,是单施Si和Se2的1.38倍和1.41倍,也显著高于CK。因此,单独或同时施用Si 和Se 能有效缓解Cd对黄瓜叶片POD活性的毒害,使得黄瓜叶片POD活性得以恢复,同时施加300 mg/kg Si 和2 mg/kg Se的作用效果最好。
由图2C 可知,Cd 胁迫降低了黄瓜叶片SOD 活性,单施Cd 处理下SOD 活性与CK 相比降低了21.62%,差异显著(P<0.05)。单施Si、Se2 和Se4 时,SOD 活性与单施 Cd 相比分别提高了 17.14%、19.88%和13.82%,差异显著(P<0.05),且三者之间差异不显著。施用SS2 和SS4 的SOD 活性与单施Cd 相比分别提高了32.40%和30.43%,差异显著(P<0.05),黄瓜SOD 活性得以恢复,与CK 的SOD 活性水平基本一致。施加SS2 的SOD 活性与单施Si 和Se2 相比提高了13.03%和10.45%,差异显著(P<0.05)。因此,同时施加300 mg/kg Si 和2 mg/kg Se 能有效缓解Cd对黄瓜的毒害,恢复SOD活性。
由图2D 可知,Cd 处理降低了黄瓜幼苗CAT 活性,单施Cd 的CAT 活性与CK 相比降低了11.17%,差异显著(P<0.05)。在Cd 胁迫下,单施Si、Se2 和Se4 时,CAT 活性与单施Cd 相比分别提高了13.17%、17.35%和15.19%,差异显著(P<0.05),CAT活性水平得以恢复,基本与CK 一致。施用SS2 和SS4 时CAT 活性与单施Cd 相比分别提高了23.58%和22.15%,差异显著(P<0.05),且CAT 活性高于CK,但差异不显著。施用 SS2、S S4 与单施 Si、S e2、Se4相比CAT 活性差异均不显著。说明单独或同时施用Si和Se在一定程度上缓解了Cd对黄瓜CAT 活性的毒害,使CAT活性得以恢复。
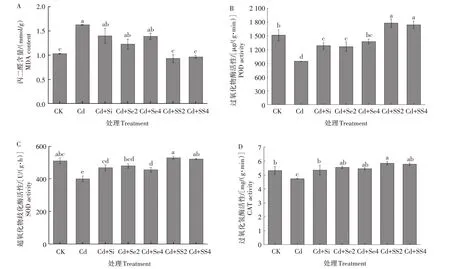
图2 Si和Se对Cd胁迫下黄瓜幼苗抗氧化酶系统的影响Fig.2 Effect of silicon and selenium on antioxidant enzyme system of cucumber seedlings under cadmium stress
3 结论与讨论
3.1 Si和Se对Cd胁迫下黄瓜幼苗生长及光合作用的影响
植物的生长状况是评估植物抗逆性最直观因素。Cd 浓度过高会抑制细胞分裂和整个植株的生长[24]。贾茜茹等[25]研究表明,Cd 抑制了黄瓜的生长发育,使得黄瓜株高和鲜质量显著降低。本研究结果表明,与CK相比,Cd处理使黄瓜株高、根长、地上及地下部的鲜质量和干质量都显著降低,这可能是因为Cd 阻碍植株从土壤中吸收必需养分或通过干扰氮代谢和代谢相关的酶活性以及碳水化合物代谢,从而抑制了植物的生长。Si和Se 对植物的生长发育有积极的作用,黄秋婵等[26]研究表明,施Si可以阻止Cd输送到叶片,减轻Cd对叶片的毒害,有利于植株的光合作用以及抗氧化等,最终使生物量得以提高。本研究也得出相同的结果,与Cd 处理相比,施加Si 或Se 都显著增加了黄瓜植株的生长和生物量,当同时添加300 mg/kgSi和2 mg/kgSe时,植株的生长状况最好,作用效果最明显,这可能是由于在石灰性土壤中Si 和低浓度的Se 配合使用产生了相互促进作用,进一步促进了植株的生长。徐向华等[27]研究也证明了叶面喷施Se 掺杂纳米硅溶胶比单独施加Se更能有效提高水稻籽粒生物量,减缓水稻砷毒害。也有研究发现,Si和Se 配施可显著增加水稻穗部Ca的积累,减少Cu和Zn的积累[28]。因此,植物对Cd 胁迫的反应以及Si 和Se 对Cd 毒害的缓解作用通常因物种而异,且取决于植物生长阶段和其他环境因素。
光合作用对重金属高度敏感,所以光合作用参数被视为评估植物抗逆性的重要指标之一。Cd 胁迫通常会通过减少光合色素、抑制光合作用中关键酶活性,影响植株的光合作用和正常生长发育。在本研究中,与CK相比,Cd处理显著降低了黄瓜叶片的叶绿素含量,同时光合参数Pn、Tr 和Gs 显著降低,Ci显著增加。在Cd 胁迫下,施用Si和Se 使得黄瓜叶片的叶绿素a、总叶绿素和类胡萝卜素含量与Cd 处理相比显著增加,以及Pn、Tr 和Gs 显著提高,Ci 显著降低,与李二豹等[13]的试验结果相似。在本试验中,与单施Si 或Se 相比,二者同时施用的作用效果更显著,这可能是因为Si 和Se 在缓解Cd 胁迫对黄瓜叶片光合作用和叶绿素含量的毒害上具有一定的协同作用。值得思考的是,外源添加的Si 和Se 虽然在一定程度上减轻了Cd 对黄瓜叶片光合作用的抑制程度,但是整体仍然低于CK,这可能是因为Cd 浓度较大,毒害程度较强,或Si和Se 的浓度配比没有达到最佳的效果,因此还有待后续进一步的研究讨论。
3.2 Si和Se对Cd胁迫下黄瓜幼苗抗氧化酶系统的影响
对于植物来说,在干旱、寒冷、热应激和重金属毒性等胁迫条件下会产生ROS(活性氧)作为有氧代谢的副产物以诱导氧化应激[29]。产生的ROS 如果没有被ROS 清除系统(酶和非酶抗氧化剂)正确清除,最终导致细胞死亡,影响植株的正常生长。所以,抗氧化酶作为第一道防御系统对ROS 清除起重要作用。植物在逆境胁迫下会产生氧化应激,MDA 是膜脂过氧化的产物,可用来评估植株受损伤的程度,SOD 在催化超氧阴离子自由基的分解中起着关键作用,而CAT 和POD 有助于清除H2O2,所以它们被视为评价植株抗氧化程度的重要指标[30]。
本试验显示,与CK相比,Cd处理显著增加了黄瓜植株中的MDA 含量,降低了SOD、POD 和CAT 活性,这可能是因为Cd 胁迫诱导了氧化应激,产生大量的ROS 对植株造成了氧化损伤。有研究表明,ROS 的过剩产生可导致DNA、基因、蛋白质的功能受损,在严重情况下,将导致细胞死亡[31]。在本试验中,Cd 胁迫下,与Cd 处理相比,单施Si 或Se 均降低了MDA 含量,提高了SOD、POD 以及CAT 活性,且Si、Se 的作用效果之间虽有差异,但差异不显著,说明了Si 和Se 都各自发挥了对Cd 的抗性机制,研究结果与贾茜茹等[12]研究一致。同时,与单施Si 或Se相比,Si 和Se 同时施用时SOD、POD 和CAT 活性均有所提高,且恢复到与CK 基本一致,这可能是因为二者对减轻Cd 的毒性具有相互促进作用。本研究结果与前人的研究也存在差异,陈平等[32]研究得出,Cd 胁迫下,添加Se 水稻幼苗的SOD 和CAT 活性提高,但POD 活性降低。这可能是因为其试验为水培试验,而本试验黄瓜的生长环境为石灰性土壤,土壤中的微生物、微量元素等均会对试验结果产生影响。因此,在石灰性土壤中外源物的添加对Cd胁迫下抗氧化系统的影响是一个复杂的过程,还有待进一步深入研究。
综上所述,在石灰性土壤上施用Si和Se可有效缓解Cd 毒害,促进苗期黄瓜生长发育,增强叶片光合作用及提高抗氧化酶活性,且Si 和Se 对缓解Cd毒害具有一定的协同作用,同时施用300 mg/kg Si和2 mg/kg Se 时对黄瓜光合作用以及抗氧化酶系统的作用效果最好。
