2018 年江西省生活污水中脊髓灰质炎病毒的检测分析
2021-01-18肖芳陆辉刘晓庆刘师文李健雄熊英
肖芳 ,陆辉 ,刘晓庆 ,刘师文 ,李健雄 ,熊英
(1.江西省疾病预防控制中心,江西 南昌 330029;2.江西省卫生健康委疾控处,江西 南昌 330006)
脊髓灰质炎又名小儿麻痹症,是由脊灰病毒引起的一种急性传染病[1]。口服脊灰减毒活疫苗( O-ral poliovirus attenuated live vaccine,OPV) 是我国消灭脊灰的重要策略之一,但由于OPV 在人体内复制增殖过程中可发生基因变异和毒力回复,从而引发疫苗相关麻痹型脊灰(Vaccine associated paralytic poliomyelitis,VAPP) 病 例[2,3]和 疫 苗 衍 生 脊 灰病毒( Vaccine -derived polio virus,VDPV) 病例[4,5]。我国所属的西太区2000 年宣布进入无脊灰状态。截至目前,仍有3 个国家(巴基斯坦、阿富汗、尼日利亚)一直有本土脊灰野病毒(Wild PV,WPV)的流行,其中有两个国家与我国接壤。2011 年,我国新疆维吾尔自治区发生源自巴基斯坦的输入1 型WPV 疫情[6],我国维持无脊灰状态形势非常严峻。脊髓灰质炎病毒主要通过粪-口途径传播,病毒可在外环境条件中存活,并在人、病毒和环境间循环,在生活污水监测脊灰病毒更能直接反映环境中脊灰病毒的存在及循环状况,为脊灰的防控工作提供更多依据[7]。
1 材料与方法
1.1 采样点的确定 青山湖区污水处理厂为南昌市日处理污水量最大的污水处理厂,每日处理污水50 万吨,选择该厂入水口作为每月固定采样点。每月月初采集500 毫升/瓶,两瓶水样,冷藏运输至江西省疾病预防控制中心疾病控制检验所脊灰实验室。
1.2 污水处理
1.2.1 前处理 对采集的1 升水样用阴离子膜吸附水中病毒浓缩技术进行处理。首先3000rpm,4℃离心30min,将上清转移至烧杯中。然后加入2.5M 的MgCl2(终浓度 0.05M),用 0.5N 的 HCl 调节 pH 值为 3.5~4.0 之间。
1.2.2 过滤 在生物安全柜中将经过前处理的污水倒入已高压的装有0.45μm 混合硝酸纤维滤膜(ADVANTEC,045A142C,10040014)的过滤器中,为防止抽滤过程中滤膜被堵住, 在0.45μm 的滤膜上方又放置了一张 10μm 的滤膜(ADVANTEC,Y100 A124A,15210012)。过滤器与正压泵相连,过滤时尽量慢点,5~10min 滤完。在生物安全柜中拆开过滤装置,将两张滤膜用无菌的镊子取出放置于无菌培养皿中。用无菌的剪刀及镊子将滤膜剪碎,放入50 mL 无菌离心管中[8]。
1.2.3 振荡及离心 在50ml 无菌离心管加入10 mL 3%的无菌牛肉浸出液,1g 无菌玻璃珠于振荡器上振荡20min, 将上清液吸出于15ml 无菌离心管中(第一次洗脱液),再向50ml 无菌离心管加入10 ml 3%的无菌牛肉浸出液,继续振荡20min,将上清液吸出于另一15ml 无菌离心管中 (第二次洗脱液)。将两次洗脱液于4℃ 3000rpm 离心15min。
1.2.4 无菌过滤及接种 用0.45μm 针式过滤器将两次离心后的上清分别过滤于5ml 的无菌冻存管中。取 200μl 抽提液接种至 24 孔板细胞上(RD、L20B、Hep-2),第一次洗提液加 5 孔,第二次洗提液加3 孔。
1.2.5 病毒的分离与鉴定 按 《脊灰实验室操作手册》(WHO 第四版)[9]及补充资料的规程对生活污水中脊灰病毒进行分离培养,对L20B 阳性分离物进行脊灰病毒型内鉴定。
1.2.6 VP1 区序列测定 用 TAKARA PrimeScript TM One Step RT-PCR Kit Ver.2(AJ21030A) 试剂盒对获得的23 株PV 株VP1 区进行扩增, 引物序列为:UG1:5′-TTTGTGTCAGCGTGAATGA-3′;UC11:5′- AAGAGGTCTCTATTCCACAT-3′[10]。扩增片段大小约 1.1kb, 反应条件为:50℃ 30min,95℃ 2min;94℃ 30s,50℃ 30s,72℃ 1min,35 个循环;72℃ 10min[11,12]。获得的 PCR 产物经1.2 % 琼脂糖凝胶电泳检测,阳性产物送生工生物工程(上海)股份有限公司进行序列测定。
1.2.7 序列整理及分子生物学信息分析 已测序的序列用DNAStar5.0 的 Seqman 进行序列的拼接,采用Mega 5.0 软件进行核苷酸和氨基酸同源性分析、 系统进化树的构建及遗传距离的分析。PV Sabin 1~3 疫苗株参考序列号为 AY184219~AY1 84221。
2 结果
2.1 病毒的分离 2018 年1 月-12 月采集了 12 份水样,除7 月及11 月份未分离出脊灰病毒其余月份均分离出了脊灰病毒,共分离脊灰病毒23 株,分离率为83.33%,见表1。
2.2 病毒的鉴定 分离的23 株脊灰毒株经ITD 及VDPV 鉴定均为疫苗相似株,其中PV 1 型2 株(8.7%),PV 2 型 0 株,PV 3 型 21 株(91.3%)。见表 2。
2.3 VP1 区序列分析及系统进化树的构建 经测序及序列拼接,23 株PV 株均获得1100bp 左右的核苷酸序列。其中 PV1 与 Sabin 1(AY184219)的同源性为 99.7~100%,PV3 与 Sabin 3 (AY184221)的同源性为99.0~100%。构建系统进化树如下图。

表1 2018 年每月分离脊灰病毒情况

表2 每月分离脊灰病毒鉴定情况

图1 系统进化发生树
2.4 突变位点分析 对分离的23 株PV 株VP1 区进行核苷酸序列比对分析发现,12 株脊灰病毒毒株在VP1 区发生了核苷酸变异,其中PV 1 型的核苷酸变异数在≤3 个,PV 3 的核苷酸变异数在≤5个。基因序列已上传至 NCBI,Genebank 为:MT3 60741~MT360743 及 MT349683~MT349703。见表3。
3 讨论
AFP 病例监测仍是目前全球消灭脊灰计划中的金标准,而环境监测可以提供一些补充信息。由于PV 是粪口途径传播,因此从生活污水中检测PV可以用来评估PV 在环境中的循环,估计环境人口中感染者的数量,因而可以将PV 环境监测结果作为某一特定人口地区无脊灰循环的指标,为中国维持无脊灰状态提供环境监测数据。2015 年WHO证实2 型脊灰病毒导致的脊灰已被消灭,2016 年5 月1 日前全球已停止使用tOPV,我们国家脊髓灰质炎疫苗的接种程序调整为1 剂次的IPV 和2 剂次的bOPV,疫苗中不再含有2 型脊灰减毒成分。脊灰疫苗接种策略调整后,一旦环境中存在2 型脊灰病毒,没有产生2 型脊灰抗体的人很有可能被感染并有传播引发病例的风险。2018 年新疆在环境污水中分离出了2 型脊灰疫苗衍生株[13],我们省环境中是否仍有脊灰2 型病毒的循环,2 型病毒是否发生变异,是我们需要解决的问题。
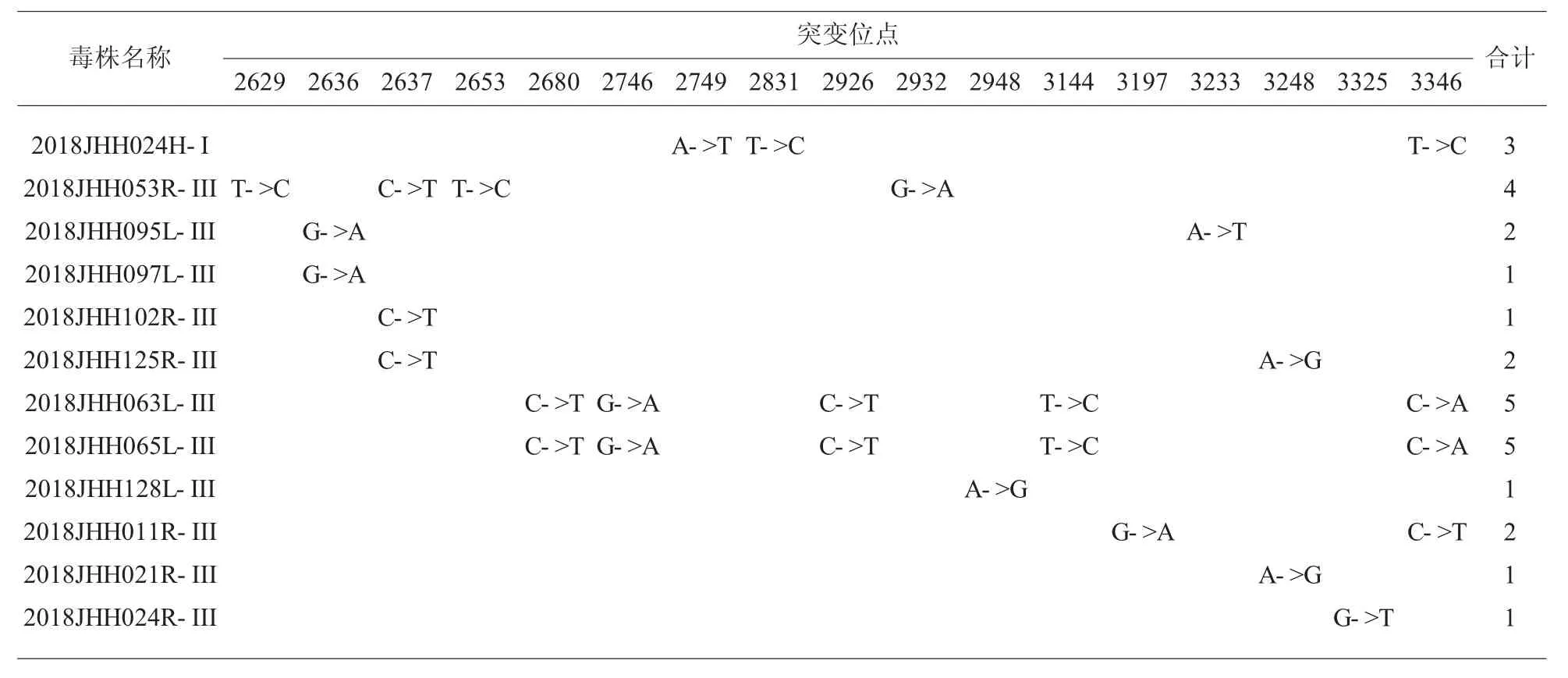
表3 毒株突变位点。
本研究2018 年对青山湖区污水处理厂入水口污水样本开展脊灰病毒监测,发现所监测污水中未分离出2 型脊灰病毒,分离出的1 型和3 型脊灰病毒均为疫苗相似株, 未监测到WPV 株和VDPV株。PV3 型的构成比为 91.3%,可见PV3 型为江西省生活污水中的PV 优势株, 这与我们过去AFP病例监测的结果是一致的[14]。
PV1 型对毒力有明显影响的突变热点是nt2747 和 nt2795[15]。2018 年在污水中分离到的 2株PV1 型疫苗株在这两个位点均无突变。有1 株(JX2018JHH024R)在 nt2749 处发生(A->G) 的突变,导致甲硫氨酸(Met)替代了异亮氨酸(Ile);在nt28 31 处发生了(T->C)及 nt3346 处发生了(T->C)碱基的变异,但其所编码的氨基酸未发生改变。PV3 型疫苗株主要突变热点位于第2636nt 处。有两株(JX2018JHH095L、JX2018JHH097L)在 nt2636 处发生了(G->A)的变异,导致了极性氨基酸替代了疏水氨基酸,需继续持续监测毒株变异情况。
当前全球流行的脊灰野病毒只有Ⅰ型,并且流行国家都是中国的邻国,野病毒输入的风险一直存在[16]。bOPV 的使用有VDPV 的出现和循环的风险。要最终消灭 VDPV,就需全面停用OPV,改为全程接种 IPV,才有可能最终消灭脊灰[17]。在无脊灰证实阶段,保持 AFP 病例监测的敏感性,并将外环境监测作为AFP 病例监测的有力补充,加强对PV 的监测,控制可能出现的VDPV 传播,对全球消灭脊灰行动最终目标的尽快实现具有重要意义。
