甜菜碱对肥胖小鼠肝脏脂质沉积的影响
2021-01-18王灵慧堵晶晶张锫文王定国杨东丽张顺华
王灵慧,吴 霜,堵晶晶,张锫文,王定国,杨东丽,张顺华,朱 砺*
(1.四川农业大学动物科技学院/禽遗传资源发掘与创新利用四川省重点实验室,成都 611130;2.成都市动物疫病预防控制中心,成都 610041;3.泸州市农业农村局,四川泸州 646000)
肝是人体重要器官,其与维生素合成与储存、胆汁分泌排泄、有毒物质代谢及血液生成密切相关[1]。此外,作为胰岛素的作用器官,肝不仅可通过糖异生作用生成葡萄糖,还可将其摄取的葡萄糖以糖原形式储存。当机体低血糖时该部分糖原分解并释放入血,维持葡萄糖代谢稳态[2]。然而,越来越多的研究证据表明,当肥胖者血液所含的游离脂肪酸水平超过肝脏代谢能力时,多余的游离脂肪酸会重新转化为甘油三酯储存于肝脏中,进而造成肝功能障碍,损伤脂肪酸代谢与脂蛋白合成,诱发系统性的胰岛素抵抗和2型糖尿病[3]。因此,发掘可预防或治疗非酒精性脂肪肝的药物、清除肝细胞内过度沉积的脂质对于发挥肝脏的正常功能和维持机体代谢稳态极为重要。
甜菜碱是一种来源于日常食物的天然小分子,能在体内稳定循环,可参与蛋白质代谢、诱食、调节机体渗透压、抗应激及抗氧化等复杂生物学过程[4]。例如,甜菜碱可显著抑制人肝癌细胞HepG2的增殖,阻滞细胞进入G2/M期,进而诱导细胞凋亡[5]。补充甜菜碱可以降低慢性肾功能衰竭患者的高同型半胱氨酸血症[6]。越来越多的研究表明,除可提高动物生产性能和改善畜产品品质外,甜菜碱还可显著减少高脂饮食诱导的白色脂肪细胞肥大和胰岛素抵抗,改善非酒精性脂肪肝炎患者的生化及组织学指标。如在患酒精性脂肪肝的大鼠的饲粮中添加甜菜碱,不仅可延缓其肝脏炎症进程,还可改善其肝脏的病理损伤[7]。然而,甜菜碱对高脂饮食诱导的肝内脂肪积累及肝损伤的影响及其具体机制尚不完全明晰。我们拟通过饮水补饲1%甜菜碱来探究甜菜碱对高脂饮食诱导的小鼠肝内脂肪积累及肝损伤的影响,以期为非酒精性脂肪肝相关疾病治疗提供理论依据和思路。
1 材料和方法
1.1 材料
1.1.1 实验动物
本试验已获得四川农业大学动物科技学院实验动物护理和使用委员会批准。6周龄雌性昆明鼠与高脂饲料购自成都达硕实验动物有限公司。试验期间,小鼠自由采食、饮水,饲养环境温度为(22±4)℃,光照规律昼夜交替。
1.1.2 主要试剂和仪器
甘油三酯试剂盒购自南京建成生物工程研究所(南京,中国);甜菜碱、油红O染液购自Sigma公司(美国);TRIzol RNA抽提试剂盒购自Invitrogen公司(美国);SYBR Premix Ex Taq试剂盒、mRNA反转录试剂盒、mRNA定量试剂盒购自TaKaRa公司(大连,中国);使用CFX96荧光定量仪、Olympus IX53荧光显微镜。
2 方法
2.1 实验动物分组饲养及样品采集
将24只6周龄雌性昆明小鼠随机均分为2组,分别饲喂高脂饲粮(HFD)、高脂饲粮+1%(m/v)甜菜碱(HFD+Bet)。饲养2个月后,采用颈椎脱臼法处死小鼠,摘取肝脏组织并称重,将样品存放于液氮中,随后转移至-80℃保存。
2.2 血清指标检测
利用眼球采血法收集小鼠血液,所得血液室温静置30 min后,3 000 g离心15 min,收集血清储存于-80℃。随后,根据ELISA试剂盒说明书对血清中谷草转氨酶(AST)及谷丙转氨酶(ALT)的含量进行检测。
2.3 甘油三酯的测定
称取(0.33±0.2)g肝组织,按重量(g):体积(mL)=1:9的比例,加入9倍体积的无水乙醇,冰水浴条件下机械匀浆,2 500 r/min,离心 10 min,取 2.5 μL上清液于96孔平底酶标板中,加入250 μL工作液,每组设置6个重复。另外取2.5 μL蒸馏水加入250 μL工作液作为空白孔;取2.5 μL标准品加入250 μL工作液作为标准孔。混匀,37℃孵育10 min;随后利用多功能酶标仪在510 nm波长处测定各孔吸光度值。根据试剂说明书,制定标准曲线,计算各组对应的甘油三酯含量。
2.4 HE和油红O染色
将小鼠部分肝脏组织用4%多聚甲醛固定,脱水,常规石蜡包埋,切片,60~65℃烤片60 min,二甲苯脱蜡,梯度酒精至水化,苏木素染液染色1~5 min,自来水洗1min,1%盐酸乙醇分化30s,自来水洗5 min,变蓝,伊红染液染色30 s~5 min,自来水洗1 min,经酒精脱水,二甲苯透明,中性树胶封固;部分经冰冻切片机切取15 μm的冰冻组织,将组织裱贴于载玻片,至切片恢复室温,蒸馏水浸洗2 s,60%异丙醇浸洗2 s,油红O染液浸染10 min,60%异丙醇浸染分色 2 s,蒸馏水洗 1 s,Mayer苏木素复染 2 min,自来水洗(蓝化)10 min,蒸馏水洗2 s,用滤纸吸干周围水分,水溶性封片剂封固并在盖玻片与载玻片交界边缘用中性树胶封闭。随后在显微镜下对切片进行观察并拍照。
2.5 脂肪酸含量检测
称取100 mg小鼠肝脏组织,匀浆后加入2 mL正己烷,50℃振摇30 min。加入3 mL KOH甲醇溶液(0.4 mol/L),50℃振摇衍生30 min。再加1 mL水、2 mL正己烷,混匀;静置,待分层后取上清液。随后,使用GC-MS 7890B-5977A气相色谱仪检对上清液中的脂肪酸含量进行检测。上述操作均由北京质朴丰科技有限公司完成。
2.6 实时荧光定量
根据Invitrogen公司 TRIzol试剂说明书,用TRIzol提取肝组织总RNA。用NanoDrop 2000超微量分光光度计和琼脂糖凝胶电泳检测纯度和完整性。而后,按照TaKaRa公司的mRNA逆转录试剂盒逆转得到相应的cDNA。随后,使用SYBR Premix Ex Taq试剂盒和CFX96荧光定量仪对脂肪酸代谢相关基因进行检测,PCR反应体系10 μL:cDNA 1 μL,上下游引物各 0.5 μL,SBYR Premix Ex Taq 5 μL,DEPC水3 μL。PCR反应条件:90℃预变性10 min,95 ℃变性 10 s,60 ℃退火 30 s,72℃延伸 15 s,共40个循环。以β-actin作为mRNA的内参基因,使用2-ΔΔCt[8]方法计算各基因的相对表达量。实验所用引物序列见表1。

表1 qRT-PCR引物序列Table 1 The primer sequences used for qRT-PCR
2.7 数据分析
所有结果均用平均值±标准差(Mean±SD)表示;实验数据采用SPSS 22.0软件进行Student's t-test分析,P<0.05为差异具有统计学意义;ns为差异不显著。
3 结果与分析
3.1 甜菜碱对HFD小鼠肝脏脂质沉积及肝变性的影响
由图1可知,HFD饲喂小鼠经甜菜碱补饲一个月后,HFD+Bet组小鼠肝重较HFD组小鼠显著减少(图1A)。HE肝组织切片染色结果显示:与HFD组小鼠相比,HFD+Bet组小鼠肝内脂肪空泡数量较少、体积较小。同时,HFD+Bet组小鼠肝内油红着色脂滴的数量和体积较HFD组小鼠显著减少(图1B)。为进一步确定甜菜碱对高脂饮食诱导的脂肪肝变性的改善效应,对血清中ALT和AST水平进行检测。结果表明:与HFD组小鼠相比,HFD+Bet组小鼠AST、ALT血清水平均显著减少(图1C),暗示甜菜碱可显著改善高脂饮食诱导的肝损伤。

图1 甜菜碱对HFD小鼠肝脏脂肪变性的影响Figure 1 The effects of betaine on fatty liver in HFD-fed mice
3.2 甜菜碱对肝甘油三酯及其调控因子的影响
由图2可知,与HFD组小鼠相比,HFD+Bet组小鼠肝脏中甘油三酯的含量显著下降。此外,对肝脏组织中的激素敏感脂肪酶(HSL)和三酰甘油脂肪酶(ATGL)进行实时荧光定量检测,结果发现HFD+Bet组小鼠肝脏中HSL、ATGL含量较HFD组小鼠极显著上升(图2)。
3.3 甜菜碱对肝脏脂肪酸组成的影响

图2 肝脏中甘油三酯的含量和ATGL、HSL表达水平检测Figure 2 Triglyceride content in liver and expression levels of ATGL and HSL
与HFD组相比,HFD+Bet组小鼠肝脏中C13:0、C14:0、C15:0、C16:0、C18:1n9c、C18:2n6c 的含量分别下降77.4%、77.7%、61.9%、60.7%、82.7%、67.7%,但差异没有达到显著水平。相似地,C12:0、C22:0含量显著下降,C20:0含量极显著下降(图3A)。为进一步探究甜菜碱对高脂饮食饲喂小鼠肝脂肪酸组成的影响,脂肪酸组成差异被进一步归类分析。结果显示,与HFD组相比,尽管饱和脂肪酸(SFA)、多不饱和脂肪酸(PUFA)、单不饱和脂肪酸(MUFA)的含量均显著下降(图3B),但HFD+Bet组小鼠肝脏中SFA及MUFA所占比例较HFD组下降,PUFA所占比例有所上升(图3C)。
3.4 甜菜碱对脂肪酸代谢相关基因表达的影响
为探究甜菜碱对肝脂肪酸代谢的调控机制,进一步利用实时荧光定量技术检验脂肪酸代谢相关基因的表达水平。结果显示:与HFD组相比,补充甜菜碱(HFD+Bet组)后,小鼠肝内负责脂肪酸转运、合成的关键调控基因 SREBP-1c、LPL、PPARγ、SCD-1、FAS的表达量显著下降,促脂肪酸β氧化的关键基因PPARa、CD36、ACSS1和ACOX2的表达量呈增加趋势,但ACOX2的表达差异没有达到显著水平(图4)。
4 讨论
超重或肥胖常伴有脂质的异位沉积。大量的研究报道,肝内脂质积累会导致患非酒精性脂肪肝的风险增加,引起胰岛素抵抗。此外,于肝内堆积的脂肪还会产生大量的致癌因子,其可诱发或促进癌症的发生[9]。
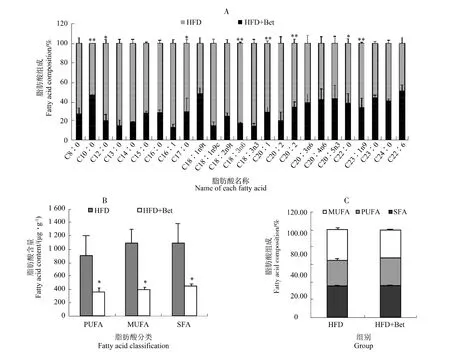
图3 肝脏中脂肪酸组成分析Figure 3 Fatty acid composition in the liver

图4 肝脂肪酸代谢相关基因表达水平Figure 4 Expression levels of genes involved in fatty acid metabolism in the liver
本研究探究了甜菜碱对高脂饮食诱导的肝内脂质积累及肝变性的影响,将甜菜碱以饮水的方式饲喂给小鼠。2个月后发现,HFD+Bet组小鼠肝脏中的脂质积累减少,与油红O和HE染色的结果一致。同时,肝内甘油三酯的含量也显著减少(P<0.01)。HSL是体内分解脂肪组织中甘油三酯释放游离脂肪酸的关键酶,在脂质沉积过程中扮演着重要角色[10]。ATGL是具有脂质水解酶活性的脂肪细胞特异性蛋白[11]。有研究发现,ATGL失活会导致脂肪数量增加,并引起甘油三酯在多个组织中沉积[12]。与上述结果一致,本研究中HFD+Bet组小鼠与HFD组小鼠相比,肝内HSL和ATGL含量显著下降(P<0.01)。证明甜菜碱可以抑制肝脏中的脂质积累。另外,与HFD组小鼠相比,HFD+Bet组小鼠肝内AST和ALT的含量显著下降(P<0.01)。已有的研究表明,肝细胞损伤后会释放出大量的酶,如AST和ALT[13]。表明补饲甜菜碱可以改善高脂饮食诱导肥胖小鼠的肝损伤。
众所周知,脂肪酸是脂质代谢的主要底物,与脂肪细胞的发育密切相关[14-15]。脂肪酸在非酒精性脂肪肝的发展进程中扮演着重要的角色,脂肪酸的积聚既是非酒精性脂肪肝的特征表现,又是引起肝细胞损伤的因素。我们用气相色谱法检测了肝内的脂肪酸组成,探究甜菜碱改善高质饮食诱导的肝内脂质沉积的机制。结果显示,补饲甜菜碱可以降低HFD+Bet组小鼠肝脏中 C12:0、C13:0、C14:0、C15:0、C16:0、C18:1n9c、C18:2n6c、C20:0、C22:0 的含量,且 SFA、PUFA、MUFA 含量也显著下降(P<0.05),但PUFA所占比例有小幅上升(P>0.05)。之前的研究报道,C12:0、C13:0、C14:0、C15:0、C16:0、C18:1n9c、C18:2n6c、C2:0、C22:0 皆与肝脏脂肪变性正相关[16]。PUFA在非酒精性脂肪肝的发病机制中发挥着负调控作用[17]。而SFA可能导致非酒精性脂肪肝的致病作用,使肝功能受损,最终导致肝功能衰竭[18]。这些结果与我们之前发现的补饲甜菜碱可以改善高脂饮食诱导的肥胖小鼠肝脏功能的结果一致。之前的研究表明,PUFA可以通过激活脂肪酸氧化中的关键调节剂(PPARα)及增强脂肪酸β-氧化,从而减少脂肪酸的合成和转运[19]。并且,PPARa在脂肪肝的发生发展中扮演着重要的角色,PPARa的敏感性下降会导致能量消耗减少,造成脂肪酸在肝脏内聚集形成脂肪肝[20]。而SREBP-1C表达量的下降能够抑制脂肪酸的合成[19]。因此,我们对肝内脂肪酸合成和代谢相关基因的表达量进行检测发现,相比HFD组小鼠,HFD+Bet组小鼠肝内PPARα表达水平显著上升,而SREBP-1C表达水平显著下降(P<0.01),同时其他脂质合成相关基因表达水平均显著下降(P<0.01)、脂肪酸代谢相关基因表达水平显著上升(P<0.01)。此前有研究发现,肝脏中脂质过度积累的根本原因主要是新的脂肪酸的合成和脂肪酸氧化的抑制[21],这与本研究的结果恰好相反。这些结果暗示,甜菜碱可以通过调控脂肪酸的组成来影响脂质代谢,进而改善高脂饮食诱导小鼠的肝脏脂质代谢功能。
综上所述,本研究表明补饲甜菜碱可预防高脂饮食诱导小鼠的非酒精性脂肪肝,其机制可能涉及肝脂肪酸代谢改变。
