绣球菌水溶性多糖的硫酸化修饰及其对鼠脾淋巴细胞体外刺激活性*
2021-01-18王宏雨林衍铨
张 迪,王宏雨,林衍铨
(福建省农业科学院食用菌研究所,福建 福州 350014)
广叶绣球菌(Sparassis latifolia) 具有很高的营养保健价值,绣球菌中含有大量的活性多糖,能够提高人体免疫力及机体造血能力,并能预防和抑制肿瘤[1-4]。前人的研究中提取的绣球菌活性多糖,多为采用碱溶液提取的,难溶性或不溶性多糖,其一级结构是具有1,6分支结构的β-1,3-葡聚糖,大约每3个主链单元中有1个分支[5]。
硫酸化修饰被认为是有效的多糖改性方法,硫酸化多糖也称多糖硫酸酯,是指多糖链上的羟基被生物体自然生成或人工合成的硫酸基团取代,而形成的改性多糖[6]。多糖硫酸化常用的方法有wolfrom法、nagsawa法、浓硫酸法、三氧化硫-吡啶法及三氧化硫-二甲基甲酰胺法等。吡喃型多糖的硫酸酯化多采用wolfrom法,用磺酰氯与吡啶的混合物作为硫酸酯化试剂对多糖进行硫酸酯化。目前的研究结果表明[7-8],多糖的硫酸化修饰常常能带来部分活性功能的提升或增加,这主要缘于硫酸基团的引入导致的多糖的物理性质和活性结构特性的改善。
目前对绣球菌活性多糖的研究,主要集中于大分子量的难溶性β-葡聚糖,对其可溶性多糖的结构和活性尚缺乏系统和深入的研究。课题组在前期研究中从绣球菌冻干品提取到一种分子量为400 KDa的可溶性多糖[9],试验以该水溶性多糖为研究对象,通过wolfrom法对其进行硫酸化修饰,并采用鼠脾淋巴细胞体外刺激试验对其硫酸化修饰前后的体外免疫调节活性进行了比较分析,以期填补相关研究工作的空白,为绣球菌多糖的修饰改性研究提供借鉴。
1 材料与方法
1.1 供试材料
绣球菌子实体鲜品由福建天益菌业有限公司提供。
1.2 试剂与仪器设备
细胞培养瓶,美国康宁公司;RPMI-1640培养基,美国赛默飞世尔科技公司;FBS50,美国依科赛生物科技有限公司;24孔细胞培养板,美国;96孔板,美国康宁股份有限公司公司;其余试剂均为国产分析纯、色谱纯;试验用水为超纯水。
Nicolet6700红外光谱仪,美国赛默飞世尔科技公司;IX51倒置显微镜,日本奥林巴斯株式会社;超净工作台,苏州净化设备有限公司;CO2培养箱,三洋电机株式会社;Centrifuge 5804-R离心机,德国艾本德股份公司;EPOCH2TC酶标仪,美国伯腾仪器有限公司;真空冷冻干燥机,北京博医康实验仪器有限公司;超纯水器,四川优普超纯科技有限公司。
1.3 试验方法
1.3.1 绣球菌水溶性多糖的制备
以冻干绣球菌为提取原料,按参考文献[9]所述方法,采用热水提取法进行水溶性多糖的提取制备。
1.3.2 绣球菌水溶性多糖的DEAE Sepharose Fast Flow柱层析分离
取20 mg·mL-1的绣球菌多糖溶液10 mL上样于DEAE Sepharose Fast Flow柱 (2.6 cm×25.0 cm) 进行分离。前15管用纯水洗脱,而后用0.05 mol·L-1的NaCl溶液洗脱。流速1 mL·min-1,分部收集器收集流份5 mL/管。以无水乙醇跟踪检测各管中多糖,绘制多糖洗脱曲线并分别收集各流份。含盐流份用透析袋流水透析48 h脱盐后冻干保藏。
1.3.3 绣球菌多糖组份的硫酸化修饰
采用氯磺酸-吡啶法对绣球菌多糖进行硫酸酯化[11]。将吡啶2 mL加入接有冷凝装置的10 mL长颈烧瓶中,将烧瓶置于冰水烧杯中预冷30 min后,在冰水浴冷却和振荡条件下,用移液器向烧瓶中缓慢滴加氯磺酸1.25 mL,约5 min内滴加结束。控制反应体系温度在常温下,反应至烧瓶中出现大量淡黄色固体,无白烟冒出时,取出烧瓶。称取多糖100 mg,二甲基甲酰胺用5 mL充分溶解后移入长颈烧瓶中。将烧瓶置于90℃的水浴锅中反应3 h,其间不时振荡摇匀。反应结束后冷却至室温,用10 mL冰水将反应物溶出至100 mL烧杯中,用2.5 mol·L-1的NaOH溶液调节pH至中性,用4倍体积无水乙醇醇沉过夜,离心收集沉淀。将沉淀溶于适量蒸馏水中,用去离子水透析72 h,透析液冷冻干燥即得到硫酸化绣球菌多糖。
1.3.4 绣球菌硫酸化多糖的硫酸基取代度测定
采用氯化钡-明胶浊度法测定硫酸基含量[10],并计算硫酸取代度。
1.3.5 绣球菌硫酸化多糖的红外光谱分析
分别称取2 mg样品与适量的KBr粉末在白炽灯下干燥研磨均匀,压片机压片,红外光谱仪在400 cm-1~4 000 cm-1区间内扫描透射光谱进行红外分析。
1.3.6 多糖样品的体外鼠脾淋巴细胞刺激试验
通过MTT法检测水溶性多糖SCG-A、SCG-N和其硫酸化产物SCG-AS、SCG-NS对大鼠活体分离的第一代脾淋巴细胞体外增殖刺激活性[11]。
脾脏淋巴细胞制备:无菌操作下取出大鼠脾脏,用冷磷酸盐缓冲液(PBS) 漂洗后将脾脏组织剪碎,冷PBS漂洗后加入0.125%胰酶+0.05%II型胶原酶进行消化;消化完成后过滤,滤液通过梯度离心收集淋巴细胞,收集的细胞经PBS清洗后于RPMI 1640培养基+10%胎牛血清中培养。
MTT法检测细胞增殖:将脾淋巴细胞消化、调整浓度为5×104个/mL的细胞悬液备用,在96孔板中每孔加入100 μL细胞悬液;然后置于37℃、5% CO2环境中培养;24 h后每孔加入含各浓度多糖的培养基100 μL,再于37℃、5% CO2环境中培养72 h;然后进行MTT染色,测定490 nm的OD值,计算各组别增殖率,每个处理设3个重复,并设阴性对照组。细胞增值率(Z,%)的计算公式为:
式中:OD为处理组OD值;COD为对照组OD值。
2 结果与分析
2.1 绣球菌多糖的DEAE Sepharose Fast Flow柱层析分离
绣球菌多糖经DEAE Sepharose Fast Flow柱层析后的洗脱曲线见图1。
由图1所示,根据绣球菌多糖的DEAE Sepharose Fast Flow凝胶层析洗脱曲线图,5管~16管为不被凝胶柱吸附的穿透峰,收集该部分流份命名为SCG-N,19-24管部分为被凝胶柱吸附的NaCl溶液洗脱峰,收集该部分流份,透析脱盐后命名为SCG-A,然后分别对其进行硫酸化修饰。
2.2 硫酸化修饰的绣球菌多糖的得率和硫酸基取代度测定
硫酸基含量标准曲线见图2。
由图2所示,以硫酸钾为硫酸基取代度测定的硫酸基标样,测定硫酸基含量标准曲线,线性回归方程计算公式为:
式中:Y为溶液中硫酸基浓度(mg·mL-1);X为360 nm波长下的吸光度。R2=0.998,线性拟合良好。硫酸基取代度(DS)计算公式为:
式中:S(%) 为硫酸基的含量(%)[10]。
计算结果见表1。
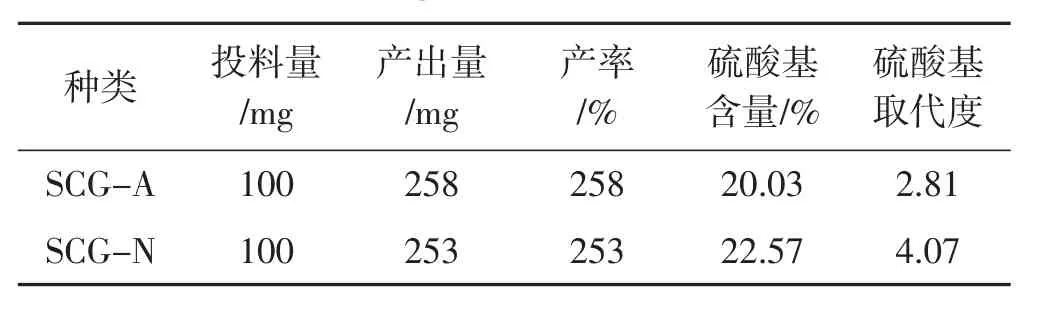
表1 绣球菌多糖的硫酸化修饰的产率及其硫酸基取代度Tab.1 The yield of sulfated modification of polysaccharide and its degree of substitution
由表1可知,通过硫酸基取代度测定发现,中性糖SCG-N硫酸化修饰后的硫酸基含量和取代度都显著高于酸性糖SCG-A。
2.3 绣球菌硫酸化多糖的红外光谱分析
SCG-A及其硫酸化衍生物SCG-AS的FT-IR图谱见图3。
由图3可知,SCG-A的吸收谱带在3 397.09 cm-1处有强且宽的吸收峰,系由多糖上的羟基产生;2 927.73 cm-1附近的肩峰为饱和C-H伸缩振动的信号,中等强度;1 647.47 cm-1处为酰胺羰基特征吸收峰,可见样品中可能有一定量的糖结合蛋白;1 154.86 cm-1、1 080.86 cm-1、1 023.46 cm-13 个峰为吡喃糖环特征吸收峰,光谱在890 cm-1附近无吸收峰,而在850 cm-1有一吸收峰表明其糖苷键构型主要为α型。从硫酸化样品SCG-AS的红外图谱可以看出,在1 235.84 cm-1处有一强的吸收峰,为S=O的伸缩振动峰,证明其已被成功硫酸化修饰。
SCG-N及其硫酸化衍生物SCGNS的FT-IR图谱见图4。
由图4可知,SCG-N的红外光谱由于多糖中羟基的伸缩振动在3 300 cm-1处有强吸收,2 926 cm-1处的吸收归因于C-H键的伸缩振动,1 000 cm-1~1 100 cm-1间为吡喃糖环的特征峰,890 cm-1与850 cm-1附近均有吸收峰,可见其中既含有β型吡喃糖苷键也含有α型吡喃糖苷键。SCG-NS的红外光谱在1 243.60 cm-1处出现了一个强吸收峰,该峰为S=O的伸缩振动峰,表明SCG-N已被成功地硫酸化修饰。
2.4 绣球菌多糖硫酸化修饰前后对鼠脾淋巴细胞体外刺激活性
经MTT法72 h处理的SCG-A和SCG-AS对大鼠脾淋巴细胞增殖率的影响见图5。
由图5、图6可知,硫酸化修饰后的SCG-AS和SCG-NS在低浓度处理下,二者促进增殖的刺激活性都有显著的提高,SCG-N硫酸化修饰后对其活性的提升较SCG-A显著,SCG-N原在50 μg·mL-1浓度下检测不到刺激活性,但经硫酸化修饰后其硫酸化产物SCG-NS细胞增殖率提高为50.22%,表现出很强的刺激活性。但在高浓度处理组,硫酸化修饰多糖SCG-AS(>200 μg·mL-1)、SCG-NS(>400 μg·mL-1)促进增殖的刺激活性并未继续提高,反而出现了下降。
3 结果与讨论
目前对绣球菌多糖的研究主要以其β-葡聚糖为研究对象,对其可溶性多糖的研究鲜有报道。试验以前期从冻干品绣球菌中提取分子量约400 KDa的可溶性多糖为研究对象[9],经DEAE Sepharose Fast Flow柱分离得到SCG-A和SCG-N多糖组份,经红外光谱分析发现SCG-A为α型酸性多糖,而中性糖组份SCG-N同时含有α、β多糖,由此可见绣球菌可溶性糖主要以α型多糖构成。通过硫酸基取代度测定发现中性糖SCG-N硫酸化修饰后的硫酸基含量和取代度都显著高于酸性糖SCG-A,这可能与其糖链中可供酯化的羟基数量更多有关。
通过大鼠脾淋巴细胞体外刺激活性测试比较了水溶性多糖SCG-A、SCG-N与其硫酸化产物SCGAS、SCG-NS的体外免疫活性差异。检测结果显示,未硫酸化前SCG-A、SCG-N均具有不同程度的促进脾淋巴细胞增殖的活性,SCG-A对大鼠脾淋巴细胞的刺激作用较好,在最低浓度50 μg·mL-1下仍可以观察到明显的促进作用,增殖率为21.78%,且在50 μg·mL-1~800 μg·mL-1的范围内存在明显剂量依赖关系;相比之下SCG-N的活性较差,在50 μg·mL-1低浓度处理时基本观察不到促进效果。硫酸化修饰后,在低浓度处理时,SCG-AS、SCG-NS对大鼠脾淋巴细胞的体外促进增殖的刺激活性都有了显著的提高,SCG-NS的提升幅度要强于SCG-AS,提升的幅度可能与硫酸化产物的硫酸基取代度有一定的关系,同时高浓度处理组刺激活性的下降,也可能与高浓度的硫酸基团的抑制或毒性作用有关,这些都有待进一步研究。
