静电纺丝制备载药纳米纤维的研究进展
2021-01-16马明珑李佳王虹
马明珑 李佳 王虹


摘要:静电纺丝制备的纳米纤维具有多孔结构、因其比表面积大,被广泛应用于防护服、过滤膜、伤口敷料等领域。随着医学领域的快速发展,静电纺丝制备的纳米纤维作为药物载体的地位日益突出。这种纳米纤维可以通过不同载药方式进行药物的有效持续释放,因此被认为是药物释放和组织工程领域的理想材料之一。本文主要论述了静电纺丝原理以及静电纺丝在药物控释方面的研究进展,为今后药控纤维的改性与应用提供理论基础。
关键词:静电纺丝;药物控释;纳米纤维
DOI:10.15938/j.jhust.2021.05.017
中图分类号:TQ340.64 文献标志码:A 文章编号:1007-2683(2021)05-0130-11
0 引言
静电纺丝最早由Formhals在1934年提出,距今已有80多年的历史[1]。静电纺丝技术是一种能够直接、连续制备聚合物纳米纤维的方法[2]。它依靠表面电荷之间的静电斥力不断地从粘弹性流体中产生纳米纤维。目前,静电纺丝技术发展迅速,引起了世界各国研究者的高度关注。由于其生产工艺简单,易于通过改变静电纺丝条件来控制纤维的表面形貌,因此目前已有多种合成高分子如聚乙二醇(PEG)、聚乳酸(PLA)、聚乳酸乙醇酸(PLGA)、聚环氧乙烷(PEO)、聚醋酸乙烯醋(PVA)等被成功电纺成纳米纤维[3]。另外将天然高分子(如胶原、蚕丝蛋白、透明质酸等)与合成高分子结合可制备生物降解型药物缓释材料[4]。
1 药物缓释的必要性
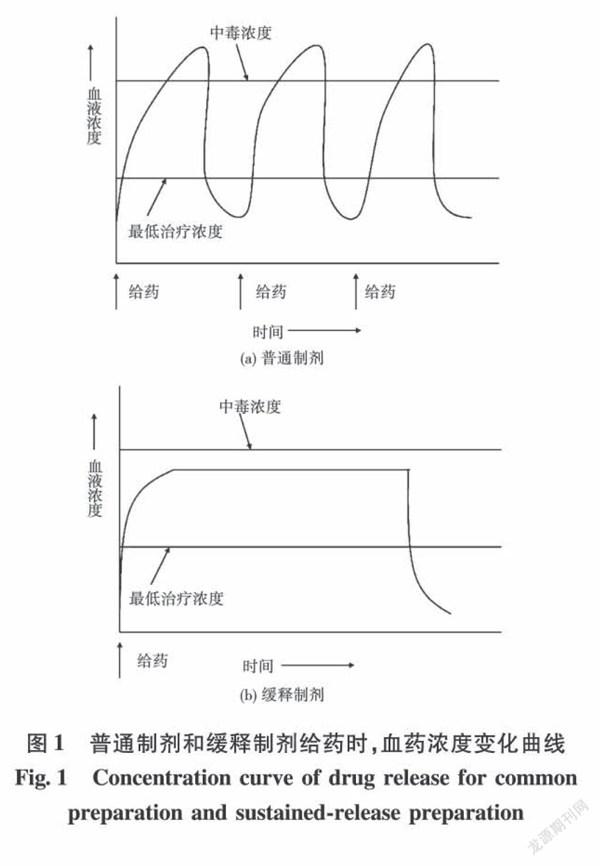
在传统药物释放体系中,药物在人体内周期释放时,浓度会忽高忽低(见图1),容易引起不良反应,而且利用率低[5]。当超过患者药物耐受的最高剂量(峰),会产生副作用甚至中毒;当低于有效剂量(谷),则无法达到疗效[6]。
为了保证血液中恒定的药物浓度进而达到安全有效的治疗效果,药物的缓释已经成为载药材料选择的首要问题。将高分子材料通过静电纺丝技术制备成纳米纤维用作药物载体,可具有一定的缓释性能,能够促进入体对药物的吸收,显著提升人体对药物的利用率[7]。
2 静电纺丝原理
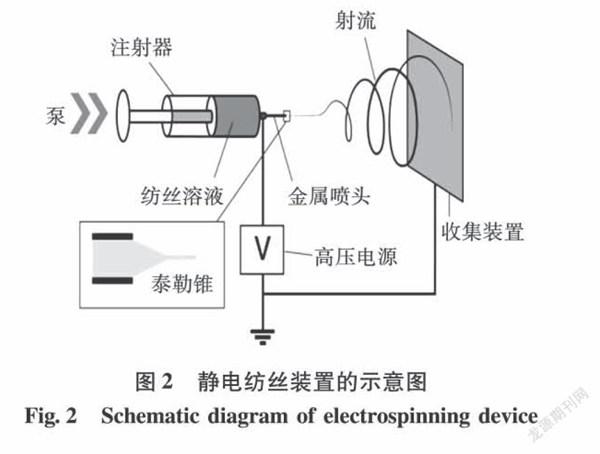
典型的静电纺丝装置主要由高压电源、液体供给装置(微量注射泵和注射器)、纤维收集装置[8]3个部分组成。注射器中的溶液是由药物与高分子聚合物配制成的黏度较高、性状均一的溶液[9]。在电场中,纺丝溶液在注射泵的作用下到达喷丝针头尖端时会形成小液滴,在高压电场的作用下变为带电液滴,小液滴所带静电力和自身表面张力之间达到平衡时在喷射头顶端会形成泰勒锥[10]。随着电场强度增加,静电排斥力会大于表面张力,泰勒锥被进一步拉长,由于其具有较大的表面积,溶剂会迅速蒸发,聚合物固化从而形成连续的固体纳米纤维。这些纳米纤维最终沉积在收集装置上[11],其装置如图2所示。
3 药物释放的影响因素
3.1 药物释放机制
在药物缓释体系中,药物本身与药物载体材料在药物缓释的研究过程都中都起着非常重要的作用,不同性质的药物也具有不同的药物释放行为。这些释放行为都可能受到纳米纤维的孔隙率、形态和几何形状的影响[12]。从药物传递学的角度,药物的释放机制分为扩散和溶解。
疏水性药物的传递机制通常是扩散,由于聚合物纤维具有一定的孔隙率,药物会从孔隙中扩散到缓冲液里,因此想要实现药物缓释,就需要从聚合物纤维膜的孔隙率入手。
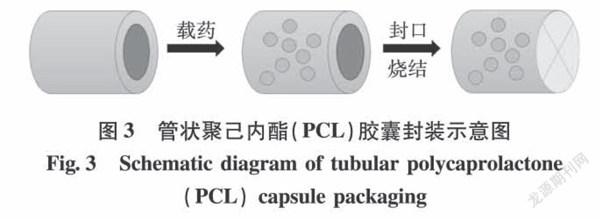
Chaparrp等[3]利用烧结电纺管状聚己内酯(PCL)胶囊来控制孔径,将药物装载到管状胶囊的空腔中(见图3),分别考察了罗丹明B(RhB)、玫瑰红(RB)和牛血清白蛋白-异硫氰酸荧光素结合物(BSA-FITC)的释放。研究发现随着烧结温度的梯度递增,孔隙收缩增加,烧结温度为56、57、58和59℃时其孔隙收缩率分别为17.67%,49.04%,79.35%,83.94%。不同温度下,其释放速率由大到小顺序为57℃、56℃、59℃、58℃,其中59℃烧结的胶囊更致密,但仍然可以看到少许纤维结构。58℃烧结的胶囊没有观察到任何纤维结构。烧结温度为58℃和59℃的胶囊在37℃条件下的前4h没有发生爆释,这归因于纤维内部存在封闭的孔隙,使得药物传递存在几何弯曲,另外封闭的孔隙会使纤维厚度增加,从而导致药物释放路径延长。谢红等[14]以聚乙烯醇和海藻酸钠为聚合物基质,以盐酸莫西沙星为药物模型,进行共混电纺,制成纤维膜后用戊二醛进行交联改性,来改善药物的缓释性能,发现交联时间越长药物缓释效果越好,未交联和交联1h、3h和20h的累积释放率分別约为67%、58%、41%和12%,这是因为交联减小了纤维之间的孔隙,从而延缓了药物的缓释速度。
亲水性药物的传递机制主要为溶解。在药物释放过程中,缓冲液会渗透到纤维膜内部,发生溶胀,水溶性药物会溶解到缓冲液中。亲水性聚合物载体可以实现药物的快速释放,而疏水性聚合物释放负载药物非常缓慢[15],这是由于疏水性聚合物会减少溶胀效应,从而可以有效地进行药物控释。
有研究表明,未处理的丝素蛋白电纺纤维毡主要以无规卷曲或α-螺旋构象结构存在,经过某些溶剂处理可促使无规卷曲或α-螺旋构象结构向β一折叠转变[16],丝素蛋白(SF)中的β片状结构会阻碍纤维膜的溶胀,对于药物释放起到阻碍作用。Choi等[17]利用常见溶剂(甘油和甲醇)成功处理了由SF/肝素(HEP)逐层组装的纳米纤维膜。结果表明SF/HEP纳米纤维膜疏水性随甘油或其他溶剂处理的添加而不同,其中甲醇处理的纤维膜含有的β片状结构最多,疏水性最好,因此减少了溶胀效应,阻碍了药物的释放。
3.2 溶剂的性质
溶剂性质会对聚合物的表面张力、粘度造成影响[18],从而会对静电纺丝纳米纤维的形貌产生影响,最终改变药物释放曲线。Boncu等[19]以PLGA为聚合物基质分别选用1,1,1,3,3,3-六氟-2-丙醇(HFIP)和由不同比例的二氯甲烷(DCM)和二甲基甲酰胺(DMF)组成的混合溶剂作为溶剂体系来探究溶剂对利奈唑胺传递的影响,结果表明用HFIP代替DCM/DMF混合溶剂可以延长药物在体外的释药时间。用DCM/DMF(50:50)作溶剂,体外释放持续16d;而用HFIP作溶剂,可将体外释放延长至28d。这可能归因于HFIP具有较低的表面张力、较高的介电常数和较好的挥发性,含HFIP的溶液粘度较高。研究表明较低的表面张力会减少喷丝上珠状物的产生,高介电常数会使静电纺丝的弯曲不稳定性增加,因此沉积范围变大,较好的挥发性会使固液两相能够很好的分离,制备的纤维较粗,并且表面光滑,相较于DCM/DMF混合溶剂能够更好的对药物进行包覆。用HFIP制备的纳米纤维膜不仅具有很好的包封率,并且HFIP与利奈唑胺和PLGA更为相容,利奈唑胺在HFIP中的溶解度更高,能够增加纤维的可纺性,这种特性对防止药物爆释同样有利。
3.3 纤维的直径
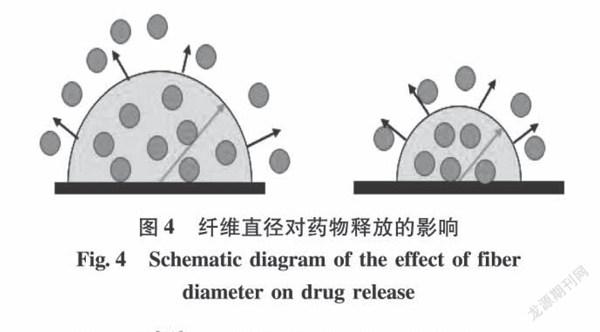
增加纤维直径会使药物释放路径延长,药物从纤维内部到达表面的时间增加,因此能够有效地减少药物的初始释放(见图4)。许多参数会影响纳米纤维的直径,包括溶剂性质、聚合物浓度、收集距离、外加电压和体积流量[20],其中溶剂性质和聚合物浓度为影响纤维直径大小的主要因素,因此增加纤维直径可以首先从这2个方面进行考虑。
Chen等[21]分别以氯仿(CF)、1,1,1,3,3,3-六氟-2-异丙醇(HFIP)为溶剂,以5-氟尿嘧啶为药物模型进行电纺。结果表明,所有的纤维在初始阶段都有一个小的爆释(17%~23%的释放量),但以CF为溶剂的载药纳米纤维直径较大(可达到2.5μm),而以HFIP为溶剂时,纤维直径急剧减少为0.7μm。但在释放的第二阶段(1h~3d)以CF为溶剂制备的纤维膜的释放速率要小于以HFIP为溶剂的纤维膜。这可能归因于直径较大的纤维药物不容易从内部扩散,第二个原因是以HFIP为溶剂的纤维直径较小,具有更高的比表面积,有利于药物释放。
Li[22]以盐酸四环素为药物模型,聚乳酸-羟基乙酸(PLGA50:50)为聚合物,通过改变纺丝液溶剂(氯仿+丙酮)的组成和聚合物浓度来控制串珠纤维的直径。研究结果表明,随着氯仿与丙酮溶剂比的降低,产生串珠所需的PLGA浓度范围也逐渐减小。在一定的浓度范围内,随着聚合物浓度的减小,串珠直径有增大趋势。药物释放结果表明,最小直径串珠纤维和最大直径串珠纤维在30min释放率分别为27.9%和11.2%,由此可见,直径较大的纤维的初始释放较小,不容易产生爆释。
由此可见,对于直径较大的纤维,其内部药物到达纤维表面的时间较长,缓冲液渗透到溶液内部的时间增加,药物溶出速度减小。而直径小的纤维具有更高的比表面积,更有利于药物的快速释放。
3.4 藥物结晶
纤维中的药物状态也是一个影响药物释放的重要因素,以结晶形式结合的药物将主要沉积在纤维外部并被快速释放,而非晶态的药物将负载在纤维内部并以持续的方式释放。
Natu等[23]以聚己内酯(PCL)和亲水性嵌段共聚物聚氧乙基-b-氧丙烯-b-氧乙烯为聚合物基质,以疏水性药物乙酰唑胺和亲水性药物马来酸噻莫洛尔为药物模型,分别制备了高载药量和低载药量双组份载药纤维。释放结果表明高载药量纤维(约90%的药物在2d后释放)比低载药量纤维(约50%的药物在52d后释放)表现出更高的爆裂程度和更短的释放时间。这归因于药物在低载药量纤维中呈无定形状态。在高载药量纤维中,部分药物呈结晶状状态。无定型药物会被包覆在纤维中,因此会有较长的持续释放。
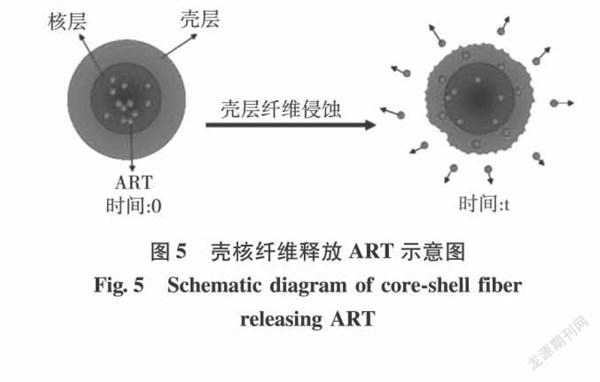
Shi等[24]通过同轴静电纺丝法将青篙素(ART)包裹在由醋酸纤维素(CA)和聚乙烯毗咯烷酮组成的壳核纤维中来抑制ART的重结晶(见图5)。ART在壳核纤维中会存在一个较小的初始释放,然后则是稳定的持续释放。在释放36h时,壳核纤维的ART释放量达到90%。壳层除了能起到药物包覆的作用,还能抑制药物的结晶,促使药物形成无定形状态,这种无定形状态更容易提供稳定的扩散通量,使药物能够持续释放。
由此可见,药物结晶与否在很大程度上影响着药物释放曲线。而结晶的产生与纤维包覆率存在着密切关系[25],因此通过控制纤维包覆率对药物结晶进行把控,从而调节药物释放。
3.5 残留溶剂
残留溶剂对于药物释放特性的影响可归结于2个方面,一是影响聚合物链之间的自由体积,溶剂的减少会使自由体积减少,而自由体积的减少将会阻碍缓冲液进入到聚合物内部,使得药物不会轻易从聚合物中游离出来,从而改变了药物释放动力学。二是溶剂会影响聚合物的结晶度,由于聚合物基质会被缓冲液水化发生水合作用,水合作用会使纤维不同区域的药物得到释放,因此增加结晶度会减少聚合物的水合作用,使药物释放时间延长。
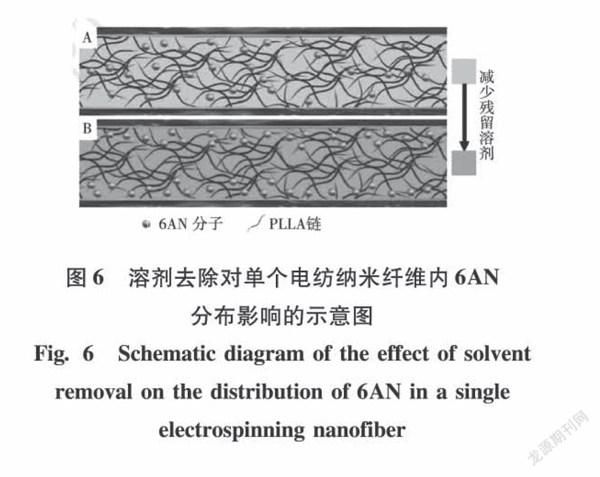
D'Amato等[26]分别以左旋聚乳酸(PLA)和6-氨基烟酰胺(6-AN)为聚合物和负载药物。将制备的载药纺丝膜分别放在室温下干燥28d或放在真空干燥箱干燥4h。真空干燥后的样品,残留溶剂下降到6%(w/w),而室温干燥后残留溶剂下降到9%(w/w)。对于未经任何处理的纤维,其6-AN的释放量在4d内存在初始释放,9d后停止释放。经真空干燥的纤维6-AN的释放量会增加,初始的爆发释放会延长2d,释放方式与未处理纤维相似。而在室温下放置28d的纤维,初始爆发释放延长至32d。
由此可见,接受长期溶剂去除的聚合物的药物释放时间最长,并且释放量增加。释放量增加可归因于在溶剂去除后,纤维深处的药物也会向表面移动(见图6)。因此,去除溶剂不仅影响了释放时间,也影响了释放量。
4 纳米纤维的载药方式
纳米纤维载药方式的不同,药物的释放结果会存在差异[27]。静电纺丝根据载药方式的不同,可以分为共混载药、同轴或三轴载药、串珠包覆药物、多层纤维包覆药物等。
4.1 共混载药
共混载药静电纺丝是将含有药物和聚合物的可混溶且稳定的混合物溶液通过共混静电纺丝制备载药纤维支架,可以一步将药物嵌人或包裹在纤维基体中,该方法已被用来制备多种药物载体,其药物释放曲线可通过调节支架的组成、直径和形态来控制,并可在2~5周内完成释放[28]。
崔志香等[29]采用共混静电纺丝法制备了聚乙烯醇(PVA)/壳聚糖(CS)复合纳米纤维,并以其为载体包覆阿莫西林。通过对其体外药物释放性能进行研究发现,随着药物含量的增加,药物释放时间延长,PVA/CS复合纳米纤维载药膜药物释放速率降低。
Li等[30]将温敏聚合物聚N-异丙基丙烯酰胺(PNIPAAm)和pH敏感共聚物甲基丙烯酸-丙烯酸乙醋共聚物A型(EL100-55)共混,以非甾体抗炎药酮洛芬(Ketoprofen,KET)为模型活性成分,制备了双敏感药物传递系统。研究结果表明复合纳米纤维结合了温度和pH响应的双重优点,尤其是该体系的温度响应性特别显著,在25℃磷酸盐缓冲液(PBS)缓冲液中释放最快,在37℃醋酸缓冲液中最慢。
4.2 同轴载药
大多数共混都是天然高分子和合成高分子药物的复合。但是,大多数简单的物理混合载药方法在几天内表现出较短的释放时间。在释药初期的药物突释现象较为严重,难以对药物实现精准的控释[31]。而同轴载药静电纺丝是使药物或载药纳米粒与高聚物的溶液进入两个同芯的喷丝头管道,壳核层液体同时经过高频拉伸,拉伸时,内外层溶液交界面能够产生剪切应力,核层在剪切应力的作用下沿着壳层同轴运动[32,33],制备出壳核结构的复合纳米纤维。与共混电纺载药纤维相比,同轴载药纤维可将药物包裹在纤维核层,而壳层材料可以起到屏障作用,从而保护核层的药物不会出现突释现象[34]。同轴静电纺丝省去了纤维的后处理过程,从而降低了工艺的复杂性,消除了后处理步骤可能造成的潜在危害。
卢杭诣等[35]采用同轴静电纺丝法制备了以盐酸四环素作为药物模型的载药玉米醇溶蛋白(Zein)/聚乙烯醇一苯乙烯基吡啶盐缩合物(PVA-SbQ)复合纳米纤维,并进行了紫外光照后处理。药物释放实验表明,同轴载药纳米纤维膜在初始5min仅释放了8%,25min后药物释放速度逐渐平缓,释药曲线总体较为平滑,说明药物释放速度较为稳定。85min后,药物的释放较为缓慢,进入药物释放稳定区,缓解了水溶性盐酸四环素初期突释的现象。He等[36]采用同轴静电纺丝技术制备具有壳核结构的双载药纤维毡。以袖皮昔负载的聚乙烯毗咯烷酮为核心纤维,以甲硝唑负载的聚乳酸一乙醇酸为壳纤维,对细菌进行抑制。体外实验表明甲硝唑有短期释放行为,而袖皮昔有长期释放行为。
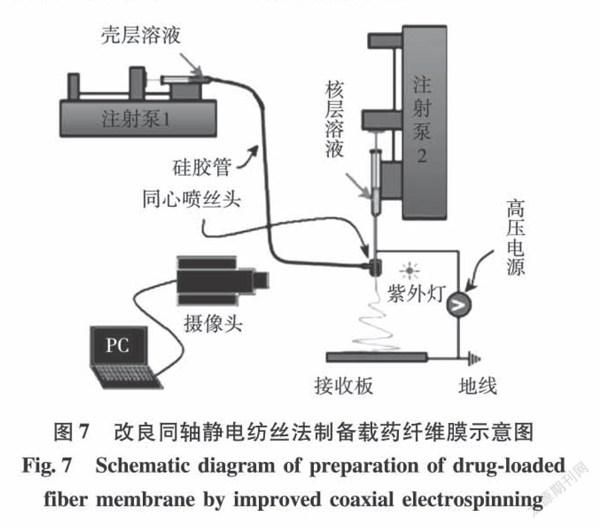
与传统同轴不同的是,改性同轴可以将可纺性差的低浓度聚合物溶液作为同轴外层溶液来制备壳核结构纤维。另外改性同轴可以实现对疏水性药物的控释作用[37]。Yu等[38]采用改良同轴静电纺丝法制备载药纤维膜。以1%(w/v)不溶性玉米醇溶蛋白溶液为壳层溶液,核层装载水溶性差的药物模型酮洛芬(KET)(见图7)。玉米醇溶蛋白包被的納米纤维不产生任何初始爆破释放效应,并能通过扩散机制使药物在16h内呈线性释放。
4.3 三轴载药
三轴电纺是在同轴工艺的基础上改进的一种电纺技术,通过改良的三轴电纺生产的壳核纳米纤维可以为构建新型功能纳米材料提供策略。其特点是使用不可纺的溶液作为最外层溶液,例如醋酸纤维素(CA)溶液[39]。相较于同轴电纺,三轴电纺具有三层结构,药物一般置于中间层和最内层,三轴电纺的壳层不仅能提供扩散屏障,减小初始释放,并且控制中间和核层药物浓度,使药物呈现梯度分布,固定释放速率从而消除了拖尾释放。
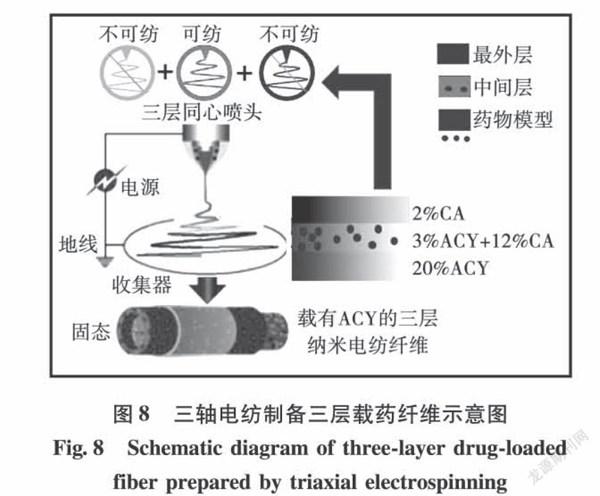
Wang等[40]以阿昔洛韦(ACY)为药物模型,醋酸纤维素(CA)作为聚合物基质,以乙醇、丙酮和DMAc为溶剂,体积比为1:4:1,制备了3种工作液,分别为壳层溶液2% CA、中间层溶液12% CA+3%ACY以及核层20% ACY,并运用三轴电纺工艺制备了三层载药纳米纤维(见图8)。由于壳层溶液不具有电纺性能,并且ACY作为一个小分子也不具有任何成丝性能,因此核层药物溶液不具有可纺性。电纺时壳层和核层溶液会与中间的可纺溶液同时凝固形成纺丝。释放结果表明三轴电纺纤维ACY在1h内的释放量(1.1%±0.6%)小于同轴电纺纤维(11.5%±2.3%),并且能提供超过28h的线性药物缓释,在拖尾释放中,三轴电纺纤维20% ACY仅在8h内释放完毕,而同轴纤维则需要22h,这种长拖尾释放对精确给药是不利的。
Wang 4E4Q以构椽酸他莫昔芬(TAM)为负载药物,壳层溶液为乙醇、丙酮和DMAc的混合溶液(体积比为1:4:1),中间层则在壳层体系中加入聚合物醋酸纤维素(CA),核层分别选取纯药物TAM溶液、药物TAM和聚乙烯毗咯烷酮(PVP)混合溶液,通过三轴电纺技术分别制备了载药纤维D1和D2。由于D1的核层溶液为纯药物溶液,纺制后得到的纤维中TAM主要以结晶态形式存在,而D2核层溶液中加人的PVP在一定程度上起到了抑制药物TAM结晶的作用。D1和D2在第1h的释放量分别为4.3%和3.6%,均小于5%,表明消除了药物的爆释。但是,它们在拖尾释放性能方面表现出显著差异。载药纤维D2在60h的溶出试验后释放了97.8%土4.4%的载药,并需要大约12h来排出整个药物。相比之下,D1在60h的溶出试验后释放出90.7%±4.2%的载药,并需要大约36h来排出所有药物。这归因于D2核层药物溶解不需要克服晶格能。无论是拖尾释放时间还是拖尾释放量,D2都表现出比D1更好的性能。
4.4 纳米颗粒包埋药物
以往的研究表明,一些具有孔状结构的纳米颗粒能够对药物进行有效的负载。介孔二氧化硅纳米粒子具有稳定性高、表面积大、孔径可调、载药量大、生物相容性好等优点[42],具有作为药物控释载体的潜力。较高的比表面积赋予了介孔二氧化硅高负载率,可达到35%[43]。当介孔二氧化硅包覆在纳米纤维膜中会产生2个屏障阻碍药物释放,一个是MSNs内部的孔,另一个是聚合物基质,因此,药物扩散路径变得更加复杂,更能有效地抑制突发性释放。
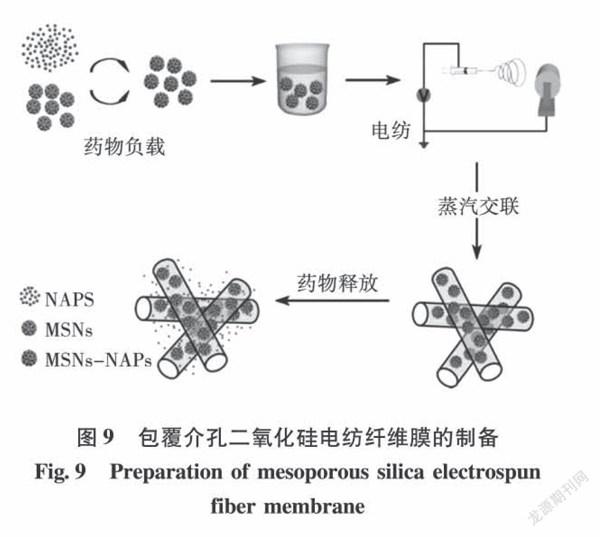
Pan等[44]引入介孔二氧化硅作为药物载体,将蔡普生(NAPS)药物负载到介孔二氧化硅中,与聚乙烯醇(PVA)进行静电纺丝(见图9),并与纯 PVA电纺载药纤维膜作对比考察药物释放性能。PVA载药纤维膜的药物在初期出现了爆释现象,释放率达到90%,而载药介孔二氧化硅掺人纳米纤维后,其爆释被有效抑制。
Gohary等[45]采用溶胶一凝胶法将盐酸阿霉素(DOX)加入到二氧化硅纳米粒子(SiO2)中。将所得DOX@SiO2纳米粒子分别加入聚己内酯(PCL)和聚环氧乙烷(PEO)共混物中,采用静电纺丝法制备了载药纤维膜。结果表明,纤维膜会有一个较小的初始释放,后期会呈现一个较长的稳定的药物释放。Hu等[28]采用聚乳酸(PLLA)和介孔二氧化硅纳米粒子共溶剂法制备了聚乳酸(PLLA)和布洛芬(IBU)修饰的介孔二氧化硅纳米粒子的电纺复合纤维。由于制备的电纺纤维表面具有疏水基,并且有一定的粗糙度,因此比一般的复合纤维膜疏水性更强,延迟了缓冲液进入复合纤维的时间,达到药物缓释的效果。释放结果表明,制备的纤维膜中大约91%的IBU在100d后释放;在最初的12h内释放量约为6%,达到了有效的缓释,并且控制介孔二氧化硅纳米粒子的含量可以有效的控制释放曲线。
4.5 串珠包埋药物
电纺串珠纤维材料具有微米级珠粒和纳米级纤维间隔分布的特点,可以完全包覆水溶性药物或固体颗粒,能有效改善电纺光滑纤维材料存在的药物外漏问题,实现药物的缓释[46]。此外,研究表明,串珠纤维具有更强的疏水性[47]。与光滑纤维相比,具有独特微珠结构的串珠纤维在药物负载和缓释方面表现出更好的应用前景。
Xi等[48]制备了丝素蛋白平滑纤维、串珠纤维和同轴串珠纤维,以盐酸阿霉素(DOX)为药物模型,比较了纤维在不同pH值下的释放行为。结果表明具有串珠结构的电纺纤维其药物释放速率比光滑纤维慢。特别是在同一释放量下,同轴串珠纤维的药物释放速率明显低于串珠纤维。
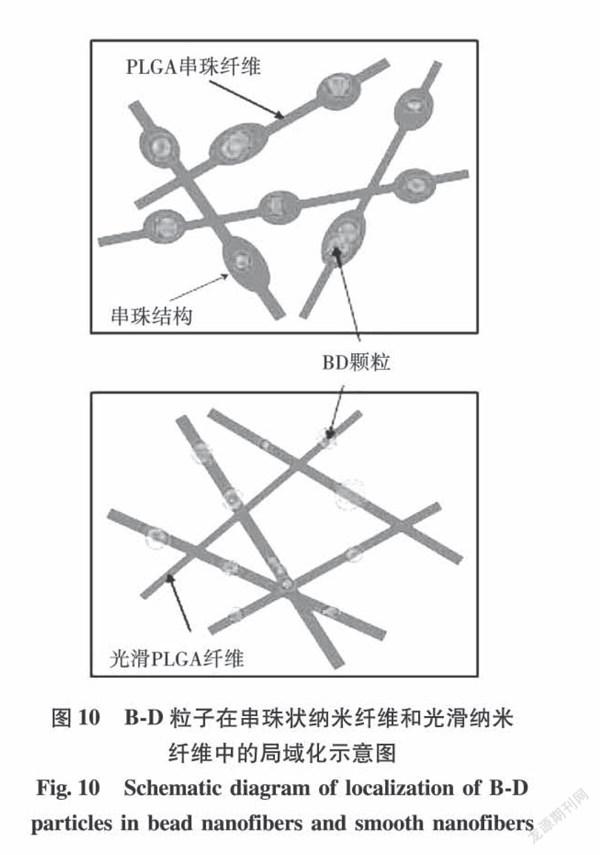
Li[49,50]制备了一种负载BSA-葡聚糖(B-D)颗粒的PLGA串珠纳米纤维,考察对BSA药物的缓释。结果表明(B-D)颗粒被成功包覆在串珠中,而光滑纤维有一部分(B-D)颗粒裸露在外面(见图10)。光滑PLGA/B-D纤维中约45%颗粒出现爆释,串珠PLGA/B-D纤维在前4h释放约30%的BSA,有效控制了药物的释放,达到持续缓释效果。
通过调整纺丝聚合物聚乳酸-乙醇酸(PLGA)的浓度和氯仿与丙酮的溶剂配比来控制静电纺丝微珠在纳米纤维上的粒径,以不同粒径的串珠状纳米纤维为模型,进一步负载盐酸四环素(TCH)微粒药物,考察了纳米纤维支架的释放行为。结果表明,适宜浓度分别为140mg/mL氯仿与丙酮的体积比为2:1),140mg/mL(氯仿与丙酮的体积比为1:1),75mg/m以氯仿与丙酮的体积比为1:2)。由于TCH颗粒被较厚的壳包裹,直径较大的串珠纳米纤维比直径小的串珠纳米纤维具有较小的爆释。另外随着PLGA的含量增加,形成的串珠直径变大,对药物缓释作用越强。Li等[51]还以牛血清白蛋白(BSA)负载的右旋糖酐为模型药物,PLGA为聚合物基质,采用静电纺丝法制备串珠纳米纤维支架。释放实验表明串珠纤维在最初的24h内只释放了总蛋白的14.03%,比光滑纤维的23.92%低了近60%。串珠结构释放50%蛋白需要13d,而光滑纤维仅需4d。
4.6 多层纤维包埋药物
近来,多层电纺纤维膜受到了广泛的关注,相比于单层电纺纤维膜,多层电纺纤维膜具有三维立体结构,比单层膜更厚,阻碍药物扩散屏障不仅有中间层的聚合物基质,还有最外层的聚合物基质,这大大延长了药物释放的路径,在药物释放方面具有良好的应用前景。
Li等[52]运用静电纺丝和静电喷雾的方法制备了含有姜黄素(Cur)和氟喹诺酮类抗生素恩诺沙星(Enro)药物分子的三明治结构复合膜。3层组成分别为聚偏氟乙烯(PVDF)纤维表面层Enro/聚乳酸(PLA)纤维表面层和Cur/PLA微球中间层组成。上层为疏水层,下层为亲水层。当纤维膜作为创面敷料时,亲水性的Enro/PLA纤维表面层可直接与创面接触,释放药物促进创面愈合。而疏水性的PVDF纤维表面层可防止外界水分渗人创面,从而促进创面愈合。最初的24h内纤维膜表现出爆释行为,这可能是由于一些药物暴露在纤维膜的表面,但随后Enro和Cur分别持续释放80h和200h,表面层的药物相较于中间层呈现了一个较短的释放时间。
Hassanin等[53]以盐酸环丙沙星(Cipro)为药物模型,采用静电纺丝法制备了三层夹心结构的纳米复合多层纤维膜(见图11)。内层为载药的聚己内酸胺(PCL),外两层为不同比例的壳聚糖(CS)和PCL复合体。释放实验表明,由于制备的多层纤维具有三维立体结构,相较于单层膜而言,夹芯结构很大程度上延缓了药物的释放,并且随着外层中CS含量的增加,外两层表面的亲水性增大,会加快纤维膜的溶胀,加快药物释放。
Yoon等[54]制备了三层药物控释纳米纤维膜,分别由两层聚己内酯(PCL)纳米纤维作为外层和一层聚环氧乙烷(PEO)/罗丹明B(RM)纳米纤维作为内层组成,并以最外层堆积时间来考察对药物释放的影响,结果表明,随着堆积时间的延长,纤维膜的厚度增加,有效地减小了药物的爆释。
Kimna等[55]研究设计了一种新型的庆大霉素载玉米醇溶蛋白双层膜,具有可控的抗生素释放特性,以防止伤口愈合过程中的感染。采用溶剂浇铸法获得上层,用静电纺丝法以玉米醇溶蛋白纤维包裹硫酸庆大霉素(GS),获得双层结构。该研究比较了单层膜和双层膜的药物释放曲线,结果表明,48h后单层膜和双层膜的累积释放率分别为83%和94%。单层膜在45min内释放50%以上的药物,这种双层纤维结构延长了纤维膜的药物释放时间。
4.7 药物的表面包覆
金属氧化物颗粒因其自身的独特性质在药物载体的研究中得到了广泛的应用。金属氧化物颗粒可以对一些超分子药物进行包覆来达到缓释效果。
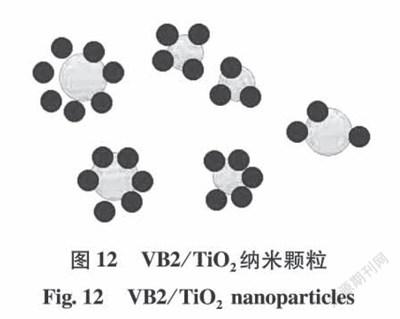
Lou等[56]以维生素B2(VB2)为药物模型,通过对涂层表面改性和改变VB2与TiO2质量比的方法来制备载药电纺纤维膜来控制药物释放,通过在VB2表面涂覆TiO2(见图12)来改善药物的爆释。释放实验结果表明,TiO2可以有效地包覆VB2。其中,mTiO2:mVB2分别为18:1和9:1的PVA/VB2/TiO2纳米纤维网可以有效地消除“爆释效应”。
4.8 特殊结构超分子负载药物
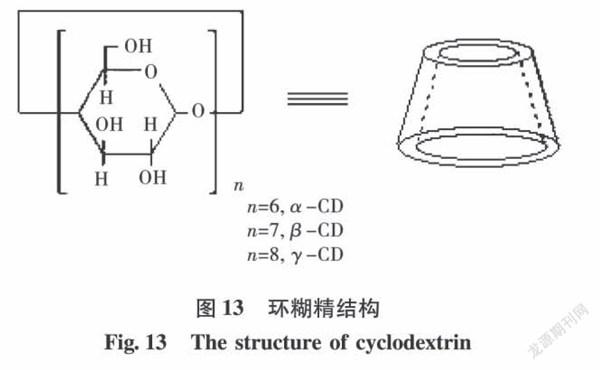
一些天然超分子例如环糊精,其具有外缘亲水而内腔疏水的结构,可以提供疏水结合的部位[57](见图13),药物可以进入空腔中,内疏水腔会增加与疏水性药物作用力,这样不仅会延长药物的释放路径,药物还不会轻易脱离空腔,从而有效地减小了药物的爆释,并且环糊精可以进行重复包埋释放,时间上几乎没有限制。
Mehraz等[58]用静电纺丝法制备了β-环糊精(β-CD)接枝丝素蛋白(SF)纳米纤维。为此,首先通过β-CD与柠檬酸(CA)的酯化反应合成β-环糊精柠檬酸(β-CDCA),然后在β-CDCA与SF之间形成酯键。将接枝产物SF-g-β-CDCA电纺成纳米纤维应用于药物传递系统。将环丙沙星作为药物分子裝入所制备的纳米纤维中,研究其药物释放行为。结果表明,SF-g-β-CDCA纤维的释放曲线较慢且稳定,在56h后达到平衡,而纯SF纳米纤维在5h内释放了90%药物。SF-g-β-CDCA纳米纤维的缓慢释放,可能是由于环丙沙星的小分子存在于β-CDs空腔中,不容易被释放。
Seon-lutz等[59]以蔡普生(NAP)为药物模型,聚乙烯醇(PVA)、透明质酸(HA)为载体聚合物,加入经丙基-β-环糊精(HPPCD)。采用纯水静电纺丝法和原位交联法制备了具有良好生物相容性和水不溶性的HA-PVA-HPRCD纳米纤维膜,发现HPPCD的加入稳定了静电纺丝过程。结果表明,功能性纳米纤维膜在48h以上表现出持续的药物释放行为。
4.9 水凝胶负载药物
水凝胶是一种极为亲水的三维网络凝胶。这种结构使它们能够在其三维网络中保留大量的水而不溶于水。由于其与天然细胞外基质的相似性,因此作为药物载体在组织工程中得到了廣泛的应用[60]。值得指出的是,在水凝胶核表面包覆聚合物壳可以减少早期分子的释放。
Pawlowska等[61]以罗丹明B(RhB)为药物模型,采用同轴静电纺丝技术制备了核-壳交联共聚物聚(N-异丙基丙烯酰胺和-N-异丙基甲基丙烯酸胺的共聚物)水凝胶基纳米纤维。所制备的纳米纤维核层由一个含有药物模型的热响应性水凝胶核构成,壳层由聚-1-丙交酯-己内酯(PLCL)制成(见图14)。在同样的温度下,12h内纯PLCL纤维释放了80%的药物,而制备的核壳纤维释放了大约27%的药物。水凝胶核心的作用在调节机制中至关重要,这种体系可通过热诱导来实现药物释放的自我调节。
5 总结与展望
静电纺丝技术是为数不多的几种制备高分子纳米或微米长纤维的方法之一,具有广阔的应用前景和巨大的市场潜力。同时,电纺纤维制品具有比表面积大、形态设计灵活、与细胞外基质结构相似等特点,作为药物载体和组织工程支架也受到了广泛的关注。通过构造结构不同的药物载体或改变纤维孔隙率、直径和溶胀效应等因素,能够达到不同的缓释效果。对于一些临床上难以掌握给药时间和患者依从性较差的药物,考虑如何将药物进行很好的包覆是控制药物释放的关键,同时也要考虑聚合物的溶剂,药物释放机理和药物状态等因素。
参考文献:
[1]FORMHALS A.Process and Apparatusfor Preparing ArtificialThreads[P].US Patent,1975504.1934.
[2]朱慧敏,高文元,闫爽,等.静电纺丝技术制备无机功能复合纳米纤维的研究进展[J].中国陶瓷工业,2017,24(4):53.
[3]LI A D,SUN Z Z,ZHOU M,et al.Electrospun Chitosan-graft-PLGA Nanofibres with Significantly Enhanced Hydrophilicity andImproved Mechanical Property[J].Colloids and Surfaces B:Biointerfaces,2013,102:674.
[4]刘呈坤.静电纺丝技术的研究进展[J].合成纤维工业,2012,35(2):53.
[5]王香梅,魏兴,张志军,等.同轴静电纺丝技术制备药物缓释载体的研究进展[J].高分子通报,2011,11:巧.
[6]金丽霞.药物缓释载体材料在医药领域中的研究及应用[J].中国组织工程研究与临床康复,2011,15(25):4699.
[7]邹爽,赵金松,陈驰.静电纺丝技术的影响因素及其应用研究综述[J].河南科技,2019,5:76.
[8]刘力菲,李伟,黄潇楠.静电纺丝纳米纤维的制备与应用[J]·首都师范大学学报(自然科学版),2017,38(l):58.
[9]李京晗,潘昊,陈建亭,等.静电纺丝技术在药物递送系统中的应用[J].沈阳药科大学学报,2019,36(1):85
[10]桑青青,吕瑶,李赫宇,等‘静电纺制备负载环丙沙星聚乳酸己内酯纳米纤维膜[J].化工新型材料,2017,45(12);176.
[11]KAJDIC S,PLANINSEK 0,GASPERLIN M,et al.ElectrospunNanofibers for Customized Drug-delivery Systems[J].Journal ofDrug Delivery Science and Technology,2019,51:672.
[12]TUCU-DEMIRZ F,SAAR S,TORT S,et al.Electrospun Metron-idazole-loaded Nanofibers for Vaginal Drug Delivery[J].Drug De-velopment and Industrial Pharmacy,2020,46(6):1.
[13]CHAPARRP F J,PREISEY K F,COUTINHO D S M A,et al.Sintered Electrospun Polycaprolactone for Controlled Model DrugDelivery[J].Materials Science&Engineering C-Materials for Bio-logical Applications,2019,99(6):112.
[14]谢红,卢华,黄华,等.载药聚乙烯醇/海藻酸钠静电纺丝纤维的改性及其药物体外释放研究[J].第三军医大学学报,2011,33(23).2485.
[15]WUJE,ZHANG Z x,GU JG,et al.Mechanism of a Long-termControlled Drug Release System Based on Simple Blended Electrn-spun Fibers[J].Journal of Controlled Release,2020,320:337.
[16]李慧君,朱晶心,陈松,等.载药电纺丝素蛋白纤维毡的结晶含量对其药物释放的影响[J].高分子材料科学与工程,2017,33(9):46.
[17]CHOI M,CH01 D,HONG J,et al.Multilayered Controlled DrugRelease Silk Fibroin Nano-film by Manipulating Secondary Struc-ture[J].Biomacromolecules,2018,19(7):3096.
[18]黄燕,敖日格勒.溶液性质对静电纺醋酸纤维素的影响[J].造纸科学与技术,2011,30(4):24.
[19]BONCU T E,OZDEMIR N,GUCLU A U.Electrospinning of Lin-ezolid Loaded PLGA Nanofibers:Effect of Solvents on Its Spinna-bility,Drug Delivery,Mechanical Properties,and AntibacterialActivities[J].Drug Development and Industrial Pharmacy,2020,46(1):109.
[20]NGADIMAN N H A,NOORDIN M Y,IDRIS A,et al.Effect ofElectrospinning Parameters Setting Towards Fiber Diameter[J].Advanced Materials Research,2014,845;985.
[21]CHEN S C,HUANG X R,CAI X M,et al.The Influence of Fi-ber Diameter of Electrospun Poly(lactic acid)on Drug Delivery[J].Fibers and Polymers,2012,13(9):1120.
[22]Ll T X,DING X,TIAN L L,et al.The Control of Beads Diame-ter of Bead-on-string Electrospun Nanofibers and the CorrespondingRelease Behaviors of Embedded Drugs[J].Materials Science andEngineering C-Materials for Biological Applications,2017,74(74);471.
[23]NATU M V,SOUSA H C,GIL M H.Effects of Drug Solubility,State and Loading on Controlled Release in Bicomponent Electro-spun Fibers[J].International Journal of Pharmaceutics,2010,397(1):50.
[24]SHI Y L,ZHANG J H,XUSX,et al.Electrospinning of Arte-misinin-loaded Core-shell Fibers for Inhibiting Drug Recrystalliza-tion.[J].Journal of Biomaterials Science Polymer Edition,2013,24(5):551.
[25]SELF S,FRANZEN L,WINDBERGS M.Overcoming Drug Crys-tallization in Electrospun Fibers-Elucidating Key Parameters andDeveloping Strategies for Drug Delivery[J].International Journalof Pharmaceutics,2015,478(1):390.
[26]D'AMATO^R,SCHAUB N J,CARDENASJM,et al.Removalof Retained Electrospinning Solvent Prolongs Drug Release fromElectrospun PLLA Fibers[J].Polymer,2017,123:121.
[27]SON YJ,KIM W J,Y00 H S.Therapeutic Applications of Elec-trospun Nanofibers for Drug Delivery Systems[J].Archives ofPharmacal Research,2013,37(1):69.
[28]HUCM,CUI W G.Hierarchical Structure of Electrospun Com-posite Fibers for Long-term Controlled Drug Release Carriers[J].Advanced Healthcare Materials,2015,1(6):809.
[29]崔志香,司軍辉,宋来瑞,等.聚乙烯醇/壳聚糖复合纳米纤维载药体系制备及释药性能[J].高分子材料科学与工程,2015,31(8):185.
[30]LIHY,SANG Q Q,WUJZ,et al.Dual-responsive Drug Deliv-ery Systems Prepared by Blend Electrospinning(J].InternationalJournal of Pharmaceutics,2018,543(3):I.
[31]常怀云,熊杰.同轴静电纺丝制备聚丙烯腈多孔中空超细纤维[J].纺织学报,2012,33(11):7.
[32]SILL T J,RECUM H A V.Electrospinning:Applications in DrugDelivery and Tissue Engineering[J].Biomaterials,2008,29(13):2004.
[33]梁梦迪,吕邵娃,李永吉.静电纺丝技术在药物领域的研究进展[J].合成纤维,2020,49(3):35.
[34]YARIN A L.Coaxial Electrospinning and Emulsion Electrospin-ning of Core-shell Fibers[J].Polymers for Advanced Technolo-gies,2010,22(3):314.
[35]卢杭诣,崔静,王清清,等.载药同轴静电纺玉米醇溶蛋白/聚乙烯醇-苯乙烯基吡啶盐缩合物复合纳米纤维的制备及性能[J].高分子材料科学与工程,2016,32(8):131.
[36]HE P,ZHONG Q,GE Y,et al.Dual Drug Loaded Coaxial Elec-trospun PLGA/PYP Fiber for Guided Tissue Regeneration UnderControl of Infection[J].Materials Science&Engineering C Mate-rials for Biological Applications,2018,90(9):549.
[37]SULTANOYA Z,KALELI G,KABAY G,et al.Controlled Re-lease of a Hydrophilic Drug from Coaxially Electrospun Polycapro-tactone Nanofibers[J].International Journal of Pharmaceutics,2016,505(1/2):l33.
[38]YUDG,CHIAN W,WANG X,et al.Linear Drug Release Mem-brane Prepared by a Modified Coaxial Electrospinning Process[J].Journal of Membrane Science,2013,428(3):150.
[39]YANG G Z,LIJJ,YUDG,et al.Nanosized Sustained-releaseDrug Depots Fabricated Using Modified Tri-axial Electrospinning[J].Acta Biomaterialia,2017,53:234.
[40]WANG M L,HOUJS,YUDG,et al.Electrospun Tri-layer Na-nodepots for Sustained Release of Acyclovir[J],Journal of Alloysand Compounds,2020,846:1.
[41]WANG K,WANG P,WANG M L,et al.Comparative Study ofElectrospun Crystal-based and Composite-based Drug Nano Depots[J].Materials Science&Engineering C-Materials for BiologicalApplications,2020,113(8):1.
[42]张舒婷,吴华悦.纳米药物载体研究概述[J].辽宁化工,2020,49(10):1267.ZHANG Shuting,WU Huayue.Overview of Research on Nanome-ter Drug Carriers[J].Liaoning Chemical Industry,2020,49(10):1267.
[43]MANZANO M,VALLE-REGI M.Mesoporous Silica Nanoparticlesfor Drug Delivery[1].Advanced Functional Materials,2019,19(2):2.
[44]PAN N,QIN J R,FAN Y W,et al.Long Time Release of WaterSoluble Drug from Hydrophilic Nanofibrous Material[J].Journalof Applied Polymer Science,2019,136(36):1.
[45]GOHARY M,HADY B M A,SAEED A A,et al.Electrospinningof Doxorubicin Loaded Silica/Poly(s-caprolactone)Hybrid FiberMats for Sustained Drug Release[J].Advances in Natural Sci-ences Nanoscience &Nanotechnology,2018,9(2):2.
[46]郗煥杰,赵荟菁.丝素蛋白/聚环氧乙烷电纺串珠纤维材料的可控制备[J].东华大学学报(自然科学版),2019,45(6):812.
[47]YOON Y I,MOON H S,LY00 W S,et al.Superhydrophobicityof PHBV Fibrous Surface with Bead-on-string Structure[J].Jour-nal of Colloid&Interface Science,2008,320(1):91.
[48]XI HJ,ZHAO H J.Silk Fibroin Coaxial Bead-on-string Fiber Ma-terials and Their Drug Release Behaviors in Different pH[J].Journal of Materials Science,2019,54(5):4246.
[49]LITX,DING X,TIAN L L,et al.Engineering BSA-dextran Par-ticles Encapsulated Bead-on-string Nanofiber Scaffold for TissueEngineering Applications[J].Journal of Materials Science,2017,52(18):10661.
[50]LITX,DING X,SUI X,et al.Sustained Release of Protein-par-ticle Encapsulated in Bead-on-string Electrospun Nanofibers[J].Journal of Macromolecular Science,2015,54(8):887.
[51]LITX,DING X,TIAN L L,et al.The Control of Beads Diame-ter of Bead-on-string Electrospun Nanofibers and the CorrespondingRelease Behaviors of Embedded Drugs[J].Materials Science&Engineering C Materials for Biological Applications,2017,74(5):471.
[52]LIJZ,HU Y,HE T,et al.Electrospun Sandwich-structure Com-posite Membranes for Wound Dressing Scaffolds with High Antioxi-dant and Antibacterial Activity[J].Macromolecular Materials andEngineering,2017,303(2):1.
[53]HASSANIN A,MONIIM A A,GHANIEM M,et al.Nanocompos-ite Multilayer Fibrous Membrane for Sustained Drug Release[J].Advanced Materials Research,2014,894:364.
[54]YOON H,KIM G H.Layer-by-layered Electrospun Micro/Nanofi-brous Mats for Drug Delivery System[J].Macromolecular Re-search,2012,20(4):402.
[55]KIMNA C,TAMBURACI S,TIHMINLIOGLU F.Novel Zein-based Multilayer Wound Dressing Membranes with Controlled Re-lease of Gentamicin[J].Journal of Biomedical Materials ResearchPart B:Applied Biomaterials,2019,107(6):2057.
[56]LOU LH,SUBBIAH S,SMITH E,et al.Functional PVA/VB2/TiO2 Nanofiber Webs for Controlled Drug Delivery[J].ACS Ap-plied Bio Materials,2019,2(12):5916.
[57]吳佩华,徐山青,仇群仁.静电纺聚丙烯腈/β-环糊精纳米纤维的制备及形貌[J].南通大学学报(自然科学版),2015,14(1):66.
[58]MEHRAZ L,NOURI M,NAMAZI H,et al.Electrospun Silk Fi-broin/β-cyclodextrin Citrate Nanofibers as a Novel Biomaterial forApplication in Controlled Drug Release[J].International Journalof Polymeric Materials and Polymeric Biomaterials,2020,69(4):211.
[59]SEON-LUTZ M,COUFFIN A C,VIGNOUD S,et al.Electro-spinning in Water and in Situ Crosslinking of Hyaluronic Acid/Cy-clodextrin Nanofibers:Towards Wound Dressing with ControlledDrug Release[J].Carbohydrate Polymers,2019,207:276.
[60]HAN N,JOHNSON J,LANNUTTI J J,et al.Hydrogel-electro-spun Fiber Composite Materials for Hydrophilic Protein Release.[J].Journal of Controlled Release,2012,158(1):165.
[61]PAWLOWSKA S,RINOLDI C,NAKIELSKI P,et al.UltravioletLight-assisted Electrospinning of Core-shell Fully Cross-linked P(NIPAAm-co-NIPMAAm)Hydrogel-based Nanofibers for Ther-mally Induced Drug Delivery Self-egulation[J].Advanced Materi-als Interfaces,2020,7(12):1.
(编辑:温泽宇)
收稿日期:2020-08-19
基金项目:国家自然科学基金(21706943).
作者简介:马明珑(1996-),女,硕士研究生;王虹(1961-),女,教授,硕士研究生导师.
通信作者:李佳(1978-),女,博士,副教授,硕士研究生导师,E-mail:lijia@hrbust.edu.cn.
