青少年肥胖非酒精性脂肪肝患者血清外泌体源性miRNA表达谱的初步研究*
2021-01-16章建伟吴若雅潘海滔
章建伟,吴若雅,潘海滔
浙江省绍兴市妇幼保健院儿保科,浙江绍兴 312000
非酒精性脂肪肝(NAFLD)为除饮酒和其他病理因素外引起过多脂肪在肝脏堆积导致的慢性疾病,是常见的慢性肝病[1],容易发生在肥胖患者中,可增加心血管病的发生率[2]。据报道,65%~85%的肥胖患者易发生NAFLD[3],其机制尚未完全了解。近年来,研究发现外泌体微小RNA(miRNA)在NAFLD发病机制中发挥重要作用[4]。外泌体是一种运载miRNAs 等重要分子的微小囊泡,发挥细胞间联络作用。肝脏细胞,尤其是肝细胞和胆管上皮细胞,既可释放外泌体,又是肝脏内源性外泌体和其他器官细胞来源的外泌体作用的靶细胞。miRNAs为非编码单链RNA分子,参与脂肪细胞分化、肝脏脂肪酸和胆固醇代谢、胰岛素抵抗、线粒体损伤等过程的调节。有研究发现小鼠脂肪组织巨噬细胞的外泌体miRNAs可以增加胰岛素抵抗[5]。另一项研究也表明外泌体miRNAs可作为病毒性肝炎、酒精性脂肪肝、NAFLD和肝细胞癌的潜在生物标记物,外泌体miRNAs或蛋白的表达随着NAFLD的进展改变[6]。因此监测外泌体miRNAs对探索NAFLD的发病机制具有重要意义。
1 资料与方法
1.1一般资料 经绍兴市妇幼保健院伦理委员会批准,收集2019年7-12月来本院儿童内分泌科就诊并收住入院的NAFLD患者5例(男3例,女2例)作为NAFLD组,根据性别、年龄配对5例单纯肥胖患者作为对照组。本研究获得受试者家属知情同意并签署知情同意书。10例研究对象年龄10~13岁。青少年NAFLD的诊断标准:参照中华医学会儿科分会内分泌学组于2018年发布的专家共识[7]中彩色超声诊断标准。肥胖判断体质量指数(BMI)标准基于中国儿童的生长发育标准[8]。
1.2方法 所有患者均为住院患者,均于上午7点采集外周血5 mL,提取血清。采用外泌体提取试剂盒提取法提取外泌体,试剂盒由SBI公司提供。对提取的外泌体使用总RNA提取法提取总RNA,用微量核酸蛋白浓度测定仪(美国Thermo公司)测定标本总RNA浓度和纯度。miRNA表达谱测序在每个标本总RNA的3′端和5′端添加RNA 接头,PCR富集8% PAGE胶片段分选,根据Qubit定量结果,按数据比例混合文库,进行桥式PCR扩增,簇生长,在Illumina测序平台(美国Illumina公司)进行 2×150 bp测序。计算两组样品间各miRNA 的差异倍数,把当倍值设定1.5倍作为区别两组间差异表达阈值,筛选当倍比值>2.0且P<0.05的差异性miRNA。测序过程由上海英拜生物科技有限公司完成。实时荧光定量PCR对显著差异表达miRNA进行验证。通过TargetScan、miRDB、miRanda靶基因预测软件,对差异表达miRNA进行靶基因预测。应用DAVID数据库对预测的靶基因进行GO功能富集分析。利用超几何分布方法进行统计分析,计算出最为显著的功能,并以P<0.05作为显著富集基因的阈值。
2 结 果
2.1miRNA 表达谱结果通过高通量测序 成功构建NAFLD组和对照组血清外泌体源性miRNA 表达谱,共筛选出表达差异较高(>1.5倍)的已知miRNA30种,见表1。其中5种miRNA(miR-122-5p,miR-3591-3p,miR-335-5p,let-7g-3p和miR-27a-5p)较对照组差异表达且显著升高2.0倍以上,4种miRNA(miR-6753-3p,miR-129-2-3p,miR-6760-5p,miR-6516)较对照组差异表达且显著降低2.0倍以上,差异均有统计学意义(P<0.01),见表2。
2.2显著差异表达miRNA的实时荧光定量PCR验证 为验证高通量测序结果的准确性,选取3个miRNA(miR-122-5p、miR-335-5p、miR-27a-5p)在两组标本中进行验证,两组标本中miRNA的实时荧光定量PCR结果与高通量测序结果一致,见图1。
2.3预测的靶基因及其GO功能富集分析 预测的差异表达miRNA的靶基因的生物学功能比较广泛,包括葡萄糖稳态、脂质代谢、肝脏发育。大多数显著富集的GO过程集中于调节葡萄糖稳态、脂质代谢、肝脏发育等病理生理功能,见表3。以P<0.05为显著富集基因的阈值。
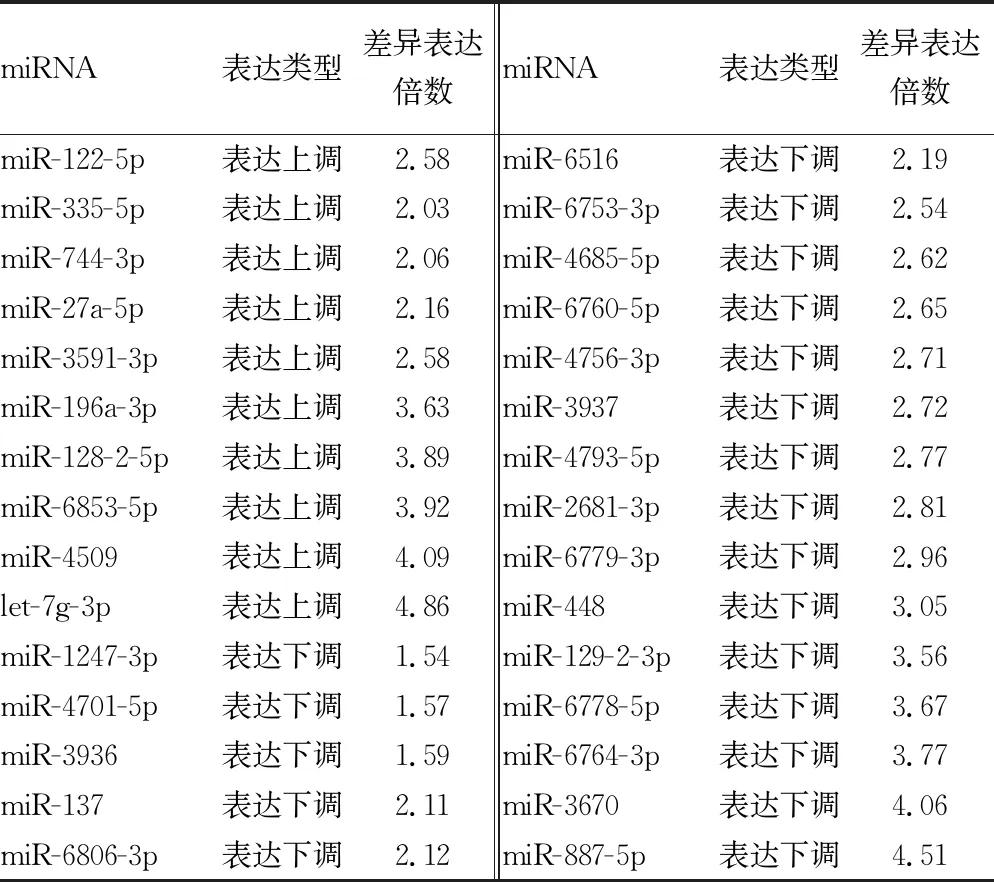
表1 30种差异表达的miRNA

表2 NAFLD组较对照组显著差异表达的miRNA
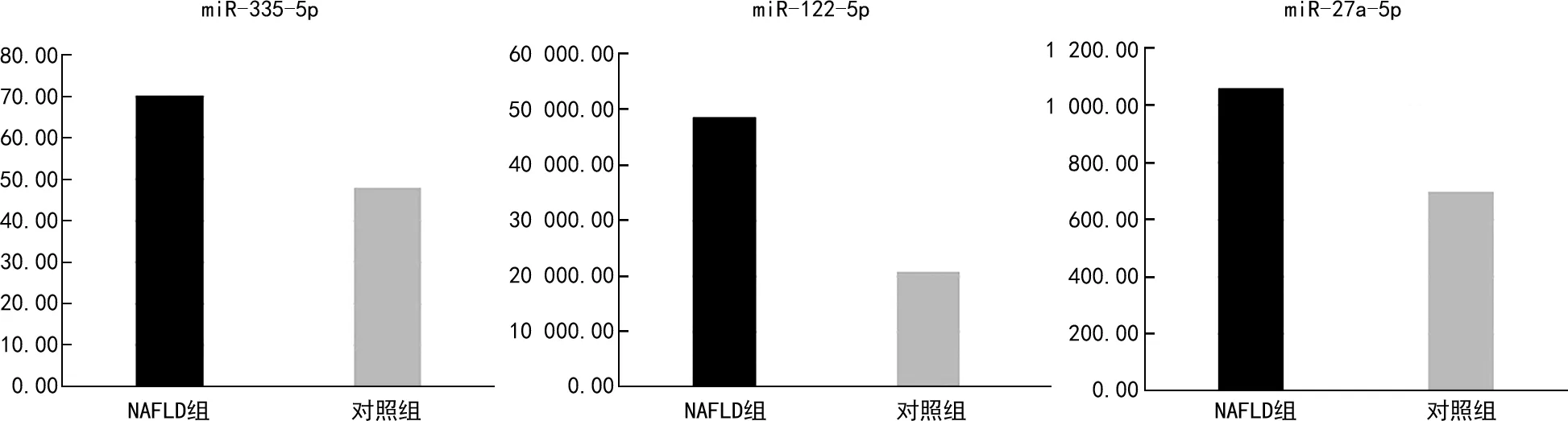
图1 miR-122-5p、miR-335-5p、miR-27a-5p在不同组别的表达验证

表3 差异表达的miRNA预测的靶基因GO功能富集分析
3 讨 论
青少年NAFLD发病率较高,达3%~10%,成年后并发症较多,如肝硬化、2型糖尿病、代谢综合征和心血管疾病等。青少年NAFLD发生机制尚不明确,“多次打击”学说被大多数学者推荐[9],包括高胰岛素血症和胰岛素抵抗引起单纯肝脏细胞脂肪变性,游离脂肪酸脂毒性作用、氧化应激、线粒体功能障碍等激活相关炎性细胞因子致肝细胞坏死,引起非酒精性脂肪性肝炎,激活肝星状细胞合成大量细胞外基质进一步发生肝纤维化。miRNAs作为一种基因表达的调控因子,在肥胖、NAFLD、动脉粥样硬化和糖尿病等代谢疾病的发生、发展中起重要作用,在肝脏疾病中作用更为明显。已有众多研究提示miRNAs 参与NAFLD病理生理的调控[10-11],主要表现在脂肪细胞分化、肝脏脂肪酸和胆固醇代谢、胰岛素抵抗、线粒体损伤等过程的调控。外泌体是一种细胞特殊小分子如miRNA的运输载体,肝脏细胞既可释放外泌体,又是肝脏内源性外泌体和其他器官细胞来源的外泌体作用的靶细胞。
miR-122是肝脏中表达量最丰富的miRNA,参与三酰甘油、胆固醇、游离脂肪酸的代谢。普遍认为,miR-122与脂肪肝发病密切相关。本项目中笔者发现NAFLD患者血清外泌体源性miR-122-5p表达显著增加。SALVOZA等[12]也发现NAFLD 患者的血清miR-122水平明显高于健康对照组,而CSAK等[13]在饮食诱导的脂肪性肝炎大鼠中发现肝脏组织miR-122降低。因此,本研究推测肝脏组织miR-122表达降低参与了非酒精性脂肪性肝炎相关肝纤维化的发生,其他组织分泌miR-122,并由外泌体携带至肝脏代偿以保护肝脏。
miR-27是一种与脂质代谢相关性最高的miRNA。有研究表明在人类和啮齿类动物脂肪细胞脂质代谢中miR-27a过度表达可以加速脂肪释放、三酰甘油水解,释放出更多的游离脂肪酸,肝脏游离脂肪酸的超负荷是导致脂肪肝变性的重要原因[14]。研究证实miR-27基因家族在成脂分化过程中表达下调,过表达miR-27会特异性抑制脂肪细胞的形成,而不影响肌源性分化[15]。此外,还发现miR-27可与过氧化物酶体增殖物激活受体γ(PPARγ)结合并影响其表达,调节脂质分解以及合成代谢效率,miR-27a可能在肥胖NAFLD的病理发展中发挥作用。此外,有研究发现,miR-335在肥胖小鼠的白色脂肪组织和肝脏中表达上调,这可能与肥胖的病理生理机制相关[16]。在饮食诱导小鼠NAFLD的肝脏中发现miR-335-5p上调,而miR-21有所降低,这些miR-335的靶标分子在调控脂类和碳水化合物代谢、信号传导以及凋亡中都有重要作用,这对饮食引起肥胖、脂肪肝、肝纤维化甚至肝硬化的发生、发展具有重要作用[17]。
综上所述,青少年NAFLD患者血清差异性表达的miRNA可能与疾病的发病机制有关,但仍需深入研究,miR-122-5p、miR-335-5p、miR-27a-5p可能可以作为肥胖NAFLD早期诊断的标记物。
