三种子宫内膜增生大鼠模型的建立和评价*
2021-01-16钟海涛高婷丽袁丽君
张 燕,吕 饶,钟海涛,高婷丽,袁丽君,涂 星,3△
1.湖北民族大学医学部,湖北恩施 445000;2.湖北民族大学附属民大医院病理科,湖北恩施 445000;3.武陵山中药材检验检测中心,湖北恩施 445000
子宫内膜增生症(EH)是一种临床上妇科常见疾病,其发病是由于受到多种因素刺激,导致机体内雌激素增加,而无相应的孕激素拮抗作用,从而促使子宫内膜腺体增生、腺体间质比例失调、腺体的数量增多和腺体扩大,产生子宫内膜增厚等一系列病理改变[1-2],常分为不典型增生和无不典型增生两类[3],该疾病对患者的身心健康和日常生活带来了极大的危害[4]。目前认为EH与体内雌激素变化关系密切,抑制雌激素分泌的药物都可能导致子宫内膜增生甚至癌变[5]。
EH动物模型主要是通过去势法、雌激素负荷法或者两者联合的方法来建立,但缺乏较为客观的评价体系[6]。本研究拟以上述3种方法建立EH的大鼠模型,并从子宫病理组织形态和血清中相关激素[雌激素(E2)、泌乳素(prol)、孕激素(P)、黄体生成素(LH)和卵泡刺激素(FSH)]水平进行评价和分析,为子宫内膜增生动物模型的建立和评价提供参考。
1 材料与方法
1.1实验动物 SPF级SD雌性大鼠60只,6周龄,体质量(180±18)g,均购于三峡大学实验动物中心,许可证号:SCXK(鄂)2017-0012,饲养环境20~26 ℃,湿度50%~60%,自然通风,自由进食、进水。
1.2药物与试剂 高压灭菌大豆油(供注射用,浙江田雨山药用油有限公司);苯甲酸雌二醇注射液(剂量:2 mL∶4 mg,10支/盒,杭州动物药品厂,批号:190422);左炔诺孕酮(剂量:0.75 mg×2片/盒,华润紫山竹药业有限公司,批号:43190405);大鼠E2、prol、P、LH的ELISA试剂盒均购于上海哈灵生物科技有限公司;大鼠FSH ELISA试剂盒购于上海信凡生物科技有限公司。
1.3主要实验仪器 5810R高速冷冻离心机(德国Eppendorf公司);酶标定量测定仪(德国Thermo公司);Milli-Q超纯水机(贝莱美生物科技有限公司);智能程控生物组织自动脱水机(型号:TC-120,泰维科技实业股份有限公司);生物组织自动包埋机(型号:TB-718E,泰维科技实业股份有限公司);轮转式切片机(型号:R139,泰维科技实业股份有限公司);摊片机(型号:TK-218Ⅱ,泰维科技实业股份有限公司);显微镜(日本Nikon);海尔立式超低温冰箱。
1.4方法
1.4.1实验动物分组、造模 将60只大鼠随机分为假手术组(A组)、去势组(B组)、雌激素负荷组(C组)和去势联合雌激素负荷组(D组),每组15只。所有大鼠在造模前3 d行腹部备皮,进行手术前禁食不禁水12 h。B组和D组大鼠采用10%水合氯醛以0.3 mL/kg的剂量腹腔注射麻醉,仰卧位固定,腹部行侧横切口,找到卵巢组织,用手术线结扎后摘除双侧卵巢,分层缝合切口;A组同法在腹部行切口后切除卵巢周围组织与双侧卵巢质量相近的脂肪组织;术后大鼠给予腹腔注射青霉素钠注射液8万单位,连续注射3 d。C组、B组与D组大鼠以0.15 mL/100 g的剂量肌肉注射1 mg/mL高压灭菌麻油稀释的苯甲酸雌二醇注射液混合液,共14次;A组术后同法等剂量注射高压灭菌麻油,共14次。
1.4.2模型的评价与筛选 在给药后第10天开始,隔1天1次,连续20 d取B组和D组大鼠阴道分泌物进行阴道涂片后用吉姆萨溶液染色,并于镜下观察大鼠阴道上皮角化情况,剔除角化者。最终,筛选A组大鼠15只、B组大鼠14只,C组大鼠15只,D组大鼠14只。
1.4.3指标检测
1.4.3.1各组大鼠子宫指数测定 末次给药后第2天,每组随机选取大鼠6只,称重并记录体质量,麻醉后取腹主动脉血,离心分离血清,置于冰箱保存备用。迅速取下各组大鼠完整子宫,并精密称子宫湿重(g),根据公式(子宫指数=子宫湿重/大鼠体质量)计算子宫指数。
1.4.3.2HE染色观察各组大鼠子宫病理情况 将取出的子宫以4%多聚甲醛固定液固定48 h,截取Y型子宫交叉处横截面子宫组织,常规脱水、浸蜡、包埋、切片后进行HE染色,并固定封片。每组选取染色效果佳、组织较完整的切片2张,在40倍和100倍镜下分别在子宫内膜四边视野采集图片各3张。采用Image J 1.51软件进行图像分析,观察子宫内膜形态。
1.4.3.3ELISA检测其血清中性激素水平 取上述1.4.3.1中的待测血清,根据试剂盒上的说明书进行操作,检测血清中E2、prol、P、LH和FSH的水平。

2 结 果
2.1各组大鼠子宫形态学指标测定 各组大鼠子宫形态学指标测定结果见表1。与A组比较:B组大鼠子宫指数、内膜厚度和内膜面积均明显下降(P<0.05);C组和D组子宫指数、内膜厚度均明显增加(P<0.05),内膜面积明显下降(P<0.05),且C组各指标改变更为明显(P<0.05)。

表1 各组大鼠子宫形态学指标测定结果
2.2各组大鼠子宫病理切片观察 A组大鼠子宫肌纤维细长,内环外纵,排列规则,内膜上皮细胞和腺上皮细胞呈高柱形,腺体排列较密集,腺腔大小不等,细胞底部可见分泌空泡,肌层纤维形态规则,浆膜层较光滑(图1A、图2A);B组大鼠子宫体积明显缩小,子宫内膜明显萎缩,腺体细胞多为低柱状,腺体明显增多且拥挤,肌层变薄,肌纤维排列较紊乱,浆膜层萎缩,不光滑(图1B、图2B);C组肉眼可见部分大鼠子宫出现明显的积水、淤血和大小不一的脓肿,显微镜下可见内膜上皮细胞和腺上皮细胞呈低柱状,腺体呈单层或复层柱状,较A组数量明显增多且拥挤,偶见脓肿形成,大部分大鼠子宫内膜有明显的嗜酸性粒细胞浸润,肌层纤维轻度肥大,排列稍紊乱,浆膜层萎缩,不光滑(图1C、图2C);D组大鼠子宫体积明显增大,偶见积水和淤血,未见脓肿,显微镜下可见内膜细胞和腺上皮细胞呈低柱状,偶见假复层现象,腺体呈单层或复层柱状,数量明显增多,内膜层有明显的嗜酸性粒细胞浸润,肌层排列较整齐(图1D、图2D)。
2.3各组大鼠血清性激素水平比较 与A组比较:B组大鼠prol、LH和FSH明显升高(P<0.05),而E2、P明显降低(P<0.05);C组大鼠E2、LH和FSH明显升高(P<0.05),而P明显降低(P<0.05);D组大鼠prol、LH和FSH明显升高(P<0.05),而E2、P明显降低(P<0.05)。与B组比较:C组大鼠prol、LH明显升高(P<0.05),FSH明显降低(P<0.05);D组大鼠E2及LH明显升高(P<0.05),其他指标差异无统计学意义(P>0.05)。与C组比较:D组大鼠E2及prol明显降低(P<0.05),P明显增加(P<0.05),其他指标差异无统计学意义(P>0.05)。见表2。
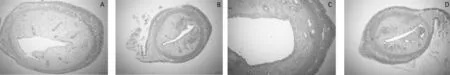
注:A为A组;B为B组;C为C组;D为D组。
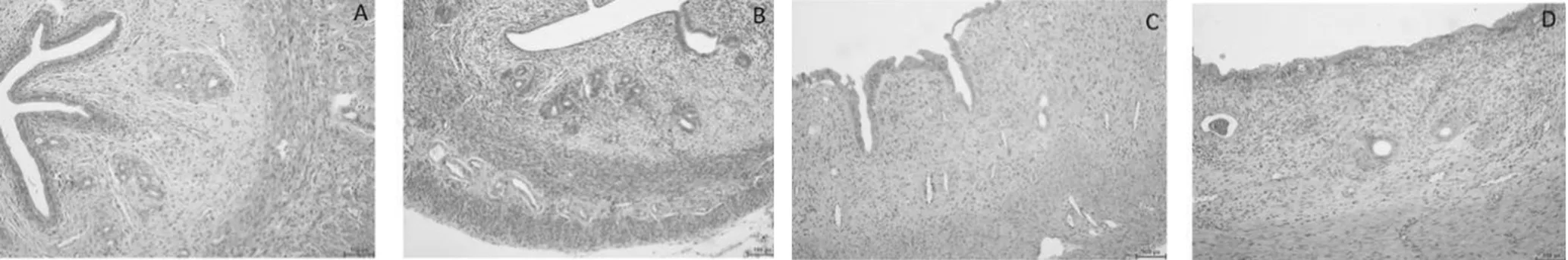
注:A为A组;B为B组;C为C组;D为D组。

表2 各组大鼠血清激素水平测定结果
3 讨 论
子宫内膜是哺乳类动物体内对雌激素最为敏感的组织,正常情况下,卵巢周期性地分泌雌激素,维持正常的月经周期;病理情况下,在来源于体外或体内的雌激素持续性地过度刺激下,且无孕酮对抗,子宫内膜发生突破性或撤退性出血、两种类型混合性出血,进而引起子宫内膜增生、间质血管以及腺体扩张、炎细胞浸润、子宫脏器系数下降等一系列病理改变[7-8]。本研究结果表明,采用去势法、雌激素负荷法和去势联合雌激素负荷法均可引起子宫内膜增生病理改变,如水肿和少量上皮细胞变性和坏死,孕激素均处于较低水平,提示这3种方法均可建立子宫内膜增生的大鼠模型。
雌激素孕激素维持在一定的水平对于女性建立正常月经周期十分重要,也是女性性成熟和生殖的重要标志。在性激素作用下,子宫内膜发生周期性脱落、生成,因此检测性激素的水平,是目前妇科疾病临床与实验研究的重要手段,一方面可以了解性激素在体内的周期性变化规律,另一方面对于寻找EH发生、发展的原因,寻求合适的治疗方法具有重要意义[9]。有研究发现,雌激素诱导的子宫内膜增生大鼠模型出现了腺体的数量明显减少,上皮细胞和腺体增生,子宫内膜厚度和内径明显升高等病理改变[10],与本研究结果相似。 张丽萍等[11]以高效孕激素治疗EH,通过检测患者子宫内膜组织中TRIM22在治疗前后的表达情况,表明孕激素可以升高TRIM22的表达,抑制子宫内膜腺体的增殖,从而可以治疗EH。本研究发现,所建立的这3种模型prol、LH和FSH的分泌量均明显增加,E2和P均明显下降(C组有外源性雌激素的干扰),提示本研究所建立的这3种模型也可应用于子宫内膜增生所致不孕症的相关研究。
此外,从研究结果上看,雌激素负荷法和去势联合雌激素负荷法所建立的子宫内膜增生大鼠模型的子宫指数明显增大,其原因可能与子宫内膜炎性浸润引起的水肿有关,提示采用这两种方法所建立的模型可能具有子宫内膜炎的特征。
