肾移植术后Ⅰ型原发性高草酸尿症复发致移植肾功能不全的多学科综合诊疗
2021-01-16王於尘严紫嫣邓文锋夏仁飞曾文利罗佳徐健苗芸
王於尘 严紫嫣 邓文锋 夏仁飞 曾文利 罗佳 徐健 苗芸
原发性高草酸尿症(primary hyperoxaluria,PH)是一种罕见的常染色体隐性遗传病,起病隐匿,无干预情况下肾脏作为首要受累器官会快速出现肾损害至终末期肾病(end stage renal disease,ESRD),且单纯肾移植术后复发率高[1]。当前,临床医师对PH的认识还不足,约20%~50%的患者在进展至慢性肾病或ESRD时才得以诊断[2-3],甚至有10%的患者直到肾移植术后病情复发时才被诊断[4]。本文报道了1例肾移植术后Ⅰ型PH复发导致移植肾失功的多学科综合诊疗(multi-disciplinary team,MDT)经验,旨在提高临床医师对PH的认识和重申肾移植术前遗传性疾病筛查的重要性。
1 一般资料
患者,女,57岁。1999年因肾结石行右侧肾盂切开取石术;2009年再次因肾结石就诊于当地医院,血清肌酐(serum creatinine,Scr)约200 μmol/L,接受护肾排毒的中药治疗;2014年5月复查Scr约1 600 μmol/L,遂留置右侧颈静脉长期透析管,在当地医院开始规律血液透析。
2015年3月,患者因Scr升高6年,规律血液透析9个月入院。同年8月在南方医院行同种异体肾移植手术,术前肾脏超声示双肾萎缩、结石,其中右肾多发性结石。供肾为心脏死亡器官捐献男性供者的左肾。采用兔抗人胸腺细胞免疫球蛋白+巴利昔单抗+甲泼尼龙进行诱导治疗,他克莫司(tacrolimus,Tac)+吗替麦考酚酯(mycophenolate mofetil,MMF)+泼尼松龙(prednisolone,Pred)进行免疫抑制维持治疗。术后Scr下降缓慢(图1),移植肾超声示移植肾锥体肿胀(图1A),肾内各级动脉血流阻力指数增高,考虑移植肾急性排斥反应,多次予甲泼尼龙冲击治疗,效果不佳。术后3个月,Scr进行性升高至519 μmol/L(图1B),行移植肾动脉造影术未发现移植肾动脉血管狭窄,遂调整免疫抑制方案为环孢素+MMF+西罗莫司+Pred。术后4个月,Scr为576 μmol/L,移植肾超声示肾内多发小结石和实质回声增强(图1C);移植肾病理学活组织检查(活检)示肾小管上皮细胞灶状坏死、脱落,部分空泡样变性,弥漫性中度萎缩,可见针状或无定形结晶样管型(图2A),偏振光下呈现明显双折射现象(图2B),肾间质弥漫性中度萎缩纤维化,提示高草酸尿症肾病;遗传病全外显子组检测证实受者AGXT基因2个致病性杂合突变。
2 MDT讨论
2.1 超声医学科
动态观察移植肾超声影像学改变:移植肾被膜始终完整、形态正常,但是实质回声逐渐增强,皮髓质界限模糊欠清晰;早期锥体肿胀,肾内各级动脉系统阻力指数增高,需要与排斥反应相鉴别。但经过增强抗排斥治疗后,受者病情及移植肾影像学所见并未得到改善。随着疾病进展,移植肾集合系统开始有小结晶聚集,逐渐呈现强回声,随后结石影像相对明显,至移植术后3个月,可测及最大结石约0.4 cm×0.4 cm。各个肾小盏内透声均越来越差,逐渐见“砂粒”样点状强回声。考虑移植肾多发小结石、移植肾功能不全,但具体诊断还请结合临床。
2.2 医学遗传学教研室
经外周血基因检测,Exon6:c.679_680+2delAAGT杂合突变、Exon7:c.740T>G(p.Leu247Arg)杂合突变,符合Ⅰ型PH遗传学改变。由于AGXT基因的转录过程中存在微小RNA(microRNA,miRNA)表观调控的个体差异,Ⅰ型PH临床表型与基因型高度异质[5]。即丙氨酸乙醛酸转氨酶(alanine glyoxylate aminotransferase,AGT)活性可因miRNA表观调控的个体差异性和时间差异性而不同,具有相同基因型的不同个体或同一个体在不同年龄段表现出的临床症状可能存在差异,因此需结合临床对疾病作出准确诊断。Ⅰ型PH在任何年龄段均有可能发病,建议患者的一级亲属同时行Ⅰ型PH筛查,同时争取最大程度改善患者预后。
2.3 肾脏内科
移植肾穿刺活检组织中可见肾小管弥漫性中度萎缩,管腔内可见针状或无定形结晶样管型,偏振光下呈现明显双折射现象,提示无色草酸盐结晶;肾小管上皮细胞灶状坏死、脱落,部分空泡样变性,肾间质弥漫性中度萎缩纤维化,提示小管及间质病变导致肾功能不全,拟诊断为高草酸尿症肾病。因此,受者快速出现移植肾功能不全可能为Ⅰ型PH复发。治疗方面可尝试通过给予优质蛋白和低磷饮食、大量饮水以减少草酸盐结晶析出;补充维生素B6以加快乙醛酸旁路途径代谢并减少向草酸转化;辅以钙剂以抑制肠道内外源性草酸的摄入等保守治疗方案,延缓移植肾功能恶化。需密切关注受者病情进展,必要时恢复透析。
2.4 内分泌代谢科
考虑受者为肾移植术后Ⅰ型PH复发,可能由于免疫抑制剂的附加作用,全身乙醛酸代谢异常和草酸盐快速沉积的风险较高,病情进展较快。应尽可能控制血草酸盐水平,并定期评估骨骼、关节、视网膜、心肌、皮肤、血管壁、骨髓等草酸盐沉积好发部位,警惕全身多系统并发症。
2.5 泌尿外科
该受者可能为肾移植术后Ⅰ型PH复发,现阶段未发现尿路梗阻,暂不建议行外科治疗。若后期因多发性结石导致尿路反复感染或移植肾输尿管梗阻,可在感染控制后行内镜取石。
2.6 器官移植科
根据各科的意见,目前受者确诊为肾移植术后Ⅰ型PH复发,感谢各科室对本病例的关注和辅助诊断过程中作出的指导和帮助。由于先前考虑为排斥反应而给予免疫抑制剂加量,现恢复Tac+MMF+Pred三联免疫抑制方案。移植肾功能仍处于可逆转阶段,拟先行保守治疗以减少外源性草酸吸收、降低血草酸盐水平和减少移植肾内草酸盐沉积,延缓移植肾功能恶化。在此期间积极防治感染,密切关注受者病情进展,必要时恢复透析。
受者后期可能长期带低功能移植物生存,且免疫抑制剂的使用和尿路结石的存在会增加反复感染和其他并发症的风险,应予以针对性预防,加强对受者的随访,增强对疾病风险的认识,尽可能延长移植物存活时间和改善受者的生存质量。若考虑再次移植,应行肝肾联合移植。
草酸盐沉积导致原肾失功的病程长达十年或数十年,而移植肾可在数月内失功。其原因可能为多因素相互叠加,如移植肾为单肾,其肾单位不足;免疫抑制剂在肝内竞争代谢酶,导致草酸代谢受阻等,但尚未有明确定论。因此受者的免疫抑制剂可适当减量,但不可停药,避免产生供体特异性抗体,影响受者后续肝肾联合移植。
3 治疗经过
受者确诊为Ⅰ型PH后,免疫抑制方案重新调整为Tac+MMF+Pred;口服维生素B6和葡萄糖酸钙;经饮食调整,包括给予优质蛋白和低磷饮食、避免高钾饮食以及大量饮水等方案治疗1个月后,Scr维持在480~570 μmol/L,每日尿量2 000~2 500 mL,此时受者明确诊断为移植肾多发性结石和移植肾功能不全肾衰竭期(图1C)。随后,受者出现纳差、腹泻等症状,考虑体内毒素积累,开始恢复每周1次血液透析治疗。此后,受者出现全心衰竭症状并在影像学呈现尿毒症心肌改变,调整血液透析频次为每周3次,持续3周后病情改善,恢复每周1次。
受者移植术后20个月出现尿道口灼热。移植肾超声示移植肾多发性结石(图1D);血生化示Scr为418 μmol/L,二氧化碳总量(total carbon dioxide,TCO2)为14.8 mmol/L;尿常规示尿红细胞为22.20/μL,尿白细胞(-)。结合实验室检查结果,诊断意见:(1)尿道口灼热并非尿路感染,考虑为结石导致血尿,血尿排出时尿道口不适;(2)代谢性酸中毒,予碳酸氢钠静脉滴注及嘱受者多饮水,纠正酸碱失衡并缓解尿道口灼热症状。肾移植术后22个月,受者出现中度贫血和低蛋白血症,分别予皮下注射促红细胞生成素和静脉滴注人血白蛋白注射液治疗,必要时增加血液透析频次。
肾移植术后36个月(图1E),受者反复出现尿频、尿急等泌尿道感染症状,中段尿培养提示大肠埃希菌感染,尿蛋白(++),尿白细胞(+++),经哌拉西林钠-他唑巴坦钠治疗后,尿细菌培养结果转阴,尿蛋白(-),尿白细胞(-)。肾移植术后53个月,超声示移植肾多发性结石(图1F),维持血液透析治疗每周1次至投稿日,受者生存情况良好,未出现草酸盐沉积相关的全身并发症。
4 讨 论
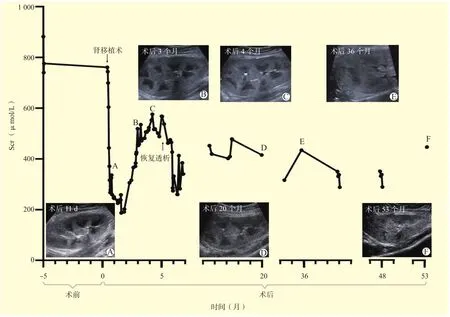
图1 肾移植受者Scr水平和移植肾超声图像变化趋势Figure 1 The variation trend of Scr levels and sonographic images of the transplant kidney in the renal transplant recipient

图2 移植肾组织病理学表现(苏木素-伊红,×400)Figure 2 Histopathological findings of transplant kidney
PH与乙醛酸代谢异常相关,临床上可分为3种类型,其中Ⅰ型最为常见[6]。Ⅰ型PH的发病机制主要为肝脏过氧化物酶体中AGXT基因突变导致患者肝脏AGT的缺乏,乙醛酸盐向甘氨酸转化受限而积蓄,从而引发后续症状,发病率约每年每12万人1例,约占总PH的68.4%[4];Ⅱ型PH是由于乙醛酸还原酶/羟基丙酮酸还原酶(glyoxalate reductase/hydroxy pyruvate reductase,GRHPR)基因突变,导致GRHPR缺乏,乙醛酸盐向乙醇酸盐转化受限而积蓄[7];Ⅲ型PH可能为肝细胞线粒体中4-羟基-2-酮戊二酸醛缩酶(4-hydroxy-2-oxoglutarate aldolase,HOGA)基因突变导致,临床症状较轻[8]。过量的乙醛酸盐在乳酸脱氢酶(lactate dehydrogenase,LDH)的作用下氧化为大量草酸盐,原尿和尿液中过量的草酸钙晶体在薄壁组织中沉着,直接损伤或诱发炎症反应间接损害肾小管,造成肾结石和肾钙化,并最终进展至ESRD[4,9]。
PH患者发病初期临床表现差异性大,易发生漏诊和误诊[10-11]。对于反复发作双肾多发性结石或者复杂性尿路感染的年轻患者,应考虑PH的可能。PH的诊断应着重于结石成分和生理代谢情况的分析。24 h尿草酸盐>5 mmol/1.73 m2和血草酸盐>50 μmol/L可用于PH的初步诊断,若行取石手术则应对结石进行成分分析。超声检查是肾钙化和肾结石首选的影像学检查方法,前者主要显示为皮质弥漫性高回声,并伴有使肾脏其余部分模糊的较大声影;后者主要在彩色多普勒超声下显示快速交替的彩色信号[12]。当超声检查结果不明时,CT检查诊断PH具有更高的灵敏度,多表现为双肾肾实质密度增高、轮廓僵硬、皮髓质分界不清和多发显影性结石,晚期可见肾瘢痕[13]。肾穿刺活检可见分布于皮质区肾小管上皮细胞胞浆或管腔内呈簇状、放射状或玫瑰花结样排列的透明或淡黄色结晶[14],可行肝活检组织的AGT活性检测及免疫反应性的测定[15]。PH的确诊有赖于分子遗传学检测有否相关基因的突变。
PH的基因测序辅助分型对后续治疗方案的拟定起到决定性作用[16]。AGXT是迄今为止发现的唯一与Ⅰ型PH直接相关的基因,目前已发现近200种不同的突变[17]。尽管大多数突变仅限于单个家族,但也有一些突变频率较高,如突变的AGXT等位基因中p.Gly170Arg占30%[18]。本病例所出现的c.679_680+2delAAGT外显子突变在中国人群中较常见[19]。患者的一级亲属也应同时进行PH筛查,早期诊断和干预对改善疾病的预后有重要意义。
PH患者应在慢性肾病3b期或全身草酸盐沉积症状出现前接受移植手术,且移植前应接受包括基因检测在内的全面评估。Ⅱ型PH患者仅需接受单纯肾移植手术,但由于肝脏是AGT介导乙醛酸降解的唯一器官,Ⅰ型PH患者需接受肝肾联合移植手术[20]。与本病例相似,接受单纯肾移植的Ⅰ型PH患者多表现为临床预后不良,移植术后3年内约44%的受者发生移植物失功,其发生率高于肝肾联合移植受者(5%)[21]。Ⅰ型PH型患者应在围移植期维持饮水>3 L/d、维生素B6补充摄入20~40 mg/d、口服钙剂600~1 200 mg/d、枸橼酸钾100~150 mg/(kg·d)的内科治疗方案,以加速外周组织草酸盐沉积的清除,并避免PH复发。
肾移植术后Ⅰ型PH复发应严格把握外科手术指征,除非存在尿路梗阻、反复感染或多发性尿石症,不建议对未合并尿路结石的Ⅰ型PH患者进行任何外科手术干预[22]。当手术不可避免时,首选内镜取石。当移植肾功能发生不可逆损伤并恢复规律血液透析后,应长期监测好发于软骨、心肌、视网膜、骨髓、淋巴结、脾脏等肾外组织的草酸盐沉积[23]。免疫抑制剂的使用和尿路结石会大大增加感染和并发症发生风险,应增强随访、密切观察,避免严重的全身并发症。
综上所述,肾移植术后Ⅰ型PH复发较为罕见。本病例术前未确诊PH,也说明由于PH罕见,存在延迟诊断和漏诊的情况,提示对复发性肾结石和反复尿路感染的患者,应考虑到PH的可能性,术前应行分子遗传学筛查。此类患者肾移植术后并发症多样、个体差异性大、预后较差,通过MDT讨论可尽量避免漏诊、误诊,制定最佳治疗方案,从而延缓病情进展,提高患者长期生存率。
