促红细胞生成素预处理增强大鼠骨髓间充质干细胞定向归巢能力的初步研究
2021-01-16乔禹铭周松张亚刘永光赵明
乔禹铭 周松 张亚 刘永光 赵明
骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSC)是当下热点研究对象之一[1],其广泛应用于组织工程、细胞移植、基因治疗及器官移植等领域[2]。国内外多项研究将外源BMSC移植到不同的动物模型体内,探究其对神经系统、心血管系统的多种疾病的治疗效果。然而,BMSC的治疗效果受到较多因素的限制,例如BMSC向受损组织归巢率、局部缺氧和炎症微环境下BMSC的存活率等。且BMSC的最佳移植剂量和移植方式仍有争议。目前研究表明BMSC经静脉、动脉、局部注射途径时,仅有一小部分BMSC能到达损伤组织,且存活率较低[3]。以激素、内源性物质、细胞因子等预处理BMSC或改良BMSC的应用可以提高BMSC治疗效果,是一种新的治疗策略[4-6]。
促红细胞生成素(erythropoietin,EPO)可通过EPO受体促进骨髓中红细胞的生成,在临床上广泛应用于各种贫血的治疗。研究证实EPO具有部分非造血功能,其受体在肾脏细胞、内皮细胞、血管平滑肌细胞广泛表达,表明EPO还可以起到广泛的器官保护作用[7-10]。EPO预处理BMSC能否提高移植干细胞的治疗效果成为了新的研究热点。本研究通过体外细胞实验探讨EPO对大鼠BMSC增殖分化及迁移归巢能力的影响。
1 材料与方法
1.1 实验材料与试剂
Sprague-Dawley(SD)大鼠BMSC购自中国赛业生物公司,EPO购自沈阳三生制药有限责任公司。四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)试剂盒购自美国Sigma公司,CXC趋化因子受体(CXC chemokine receptor,CXCR)4购自美国Abcam公司。CXCR4蛋白的一抗为兔多克隆抗体,β-actin的一抗为兔单克隆抗体,二抗均为山羊抗兔多克隆抗体。
1.2 细胞培养及分组
将BMSC接种到培养皿中,加入足量完全培养基,放入37 ℃、5% CO2培养箱中培养,传代至第5代BMSC用于后续试验。增殖率测定、划痕实验、CXCR4蛋白测定:将第5代BMSC分为5组,分别为对照组(不加EPO)及10、100、500、1 000 IU/mL EPO组,加入EPO达到相应的终浓度后共培养。表面标志物测定、成脂分化和成骨分化、细胞骨架染色:将第5代BMSC分为BMSC组和EPO-BMSC组,EPO-BMSC组在BMSC培养液中加入EPO使之终浓度为500 IU/mL,BMSC组加入等量的磷酸盐缓冲液(phosphate buffer saline,PBS),培养相应时间。
1.3 研究方法
1.3.1 增殖率的测定 5组BMSC培养24 h和48 h后分别接种于6孔板中,每孔中加入20 μL MTT溶液孵育4 h,测定各孔的光密度(optical density,OD)值。
1.3.2 划痕实验 将5组BMSC培养48 h后接种于6孔板中,当BMSC汇合达到80%~90%时,用移液枪枪头在6孔板底部划痕1次。倒置显微镜观察BMSC的迁移情况。
1.3.3 CXCR4蛋白的测定 将5组BMSC培养48 h后接种于6孔板中,采用蛋白免疫印迹(Western blot)检测各组BMSC中CXCR4蛋白的表达情况。因CXCR4与β-actin蛋白分子量接近,本研究采取先孵育CXCR4蛋白,洗脱之后再孵育β-actin的方法。
1.3.4 表面标志物测定 将EPO-BMSC组和BMSC组的BMSC培养48 h后,两组均分别加入藻红蛋白(phycoerythrin,PE)标记CD45、异硫氰酸荧光素( fluorescein isothiocyanate,FITC) 标 记 CD90、CD44抗体,混匀后室温孵育30 min,流式细胞仪检测表面标志物的表达情况。
1.3.5 成脂分化和成骨分化 EPO-BMSC组和BMSC组BMSC培养48 h后,添加成脂诱导培养基进行成脂分化,分化12 d,待脂滴形成后进行油红O染色,苏木素染液浸染1 min,倒置显微镜下观察拍照;添加成骨诱导培养基进行成骨分化,分化15 d,待矿化结节形成后,进行硝酸银染色,倒置显微镜下观察拍照。
1.3.6 细胞骨架染色 EPO-BMSC组和BMSC组BMSC培养48 h后,3%多聚甲醛溶液固定,加入抗微管蛋白的一抗37 ℃孵育45 min,PBS冲洗后加入荧光标记的二抗,荧光显微镜观察微管染色情况;加入罗丹明-鬼笔环肽室温避光反应30 min后,显微镜下观察微丝染色情况。
1.4 统计学方法
采用SPSS 20.0软件进行统计学分析。对于符合正态分布的计量资料以均数±标准差表示,比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 EPO对BMSC增殖率的影响
培养24 h和48 h后,EPO对BMSC增殖率的影响见图1。培养24 h后,对照组与10、100和500 IU/mL EPO组间BMSC的增殖率比较,差异均无统计学意义(均为P>0.05)。培养48 h后,与对照组比较,100 IU/mL和500 IU/mL EPO组BMSC的增殖率均提高(均为P<0.05);与100 IU/mL EPO组比较,500 IU/mL EPO组BMSC的增殖率更高(P<0.05)。与对照组比较,1 000 IU/mL EPO组培养24 h和48 h后BMSC增殖率均降低(均为P<0.05)。

图1 EPO对BMSC增殖率的影响Figure 1 Effects of EPO on proliferation rate of BMSC
2.2 EPO对BMSC迁移能力的影响
培养48 h后,EPO对BMSC迁移能力的影响见图2。与对照组比较,100 IU/mL和500 IU/mL EPO组划痕的距离明显被修复,提示BMSC的迁移能力增强。
2.3 EPO对BMSC中CXCR4蛋白表达的影响
培养48 h后,EPO对BMSC中CXCR4蛋白表达的影响见图3。与对照组比较,100 IU/mL和500 IU/mL EPO组中BMSC的CXCR4蛋白表达量升高,1 000 IU/mL EPO组BMSC中CXCR4蛋白表达量降低(均为P<0.05)。与100 IU/mL EPO组比较,500 IU/mL EPO组BMSC中CXCR4蛋白表达量更高(P<0.05)。
2.4 EPO对BMSC表面标志物表达的影响
培养48 h后,EPO对BMSC表面标志物表达情况的影响见图4。结果显示BMSC组和EPO-BMSC组BMSC均高表达CD90和CD44,不表达CD45。表明EPO不会影响BMSC表面标志物的表达。
2.5 EPO对BMSC定向分化的影响

图2 EPO对BMSC迁移能力的影响(×100)Figure 2 Effects of EPO on migration of BMSC
EPO对BMSC定向分化的影响见图5。BMSC组和EPO-BMSC组BMSC经成骨诱导15 d后,均可见红色的矿化结节;经成脂诱导12 d后,细胞中均出现较为明显的圆形小脂滴,经油红O染色,可见红色脂滴。表明EPO不会影响BMSC的定向分化。
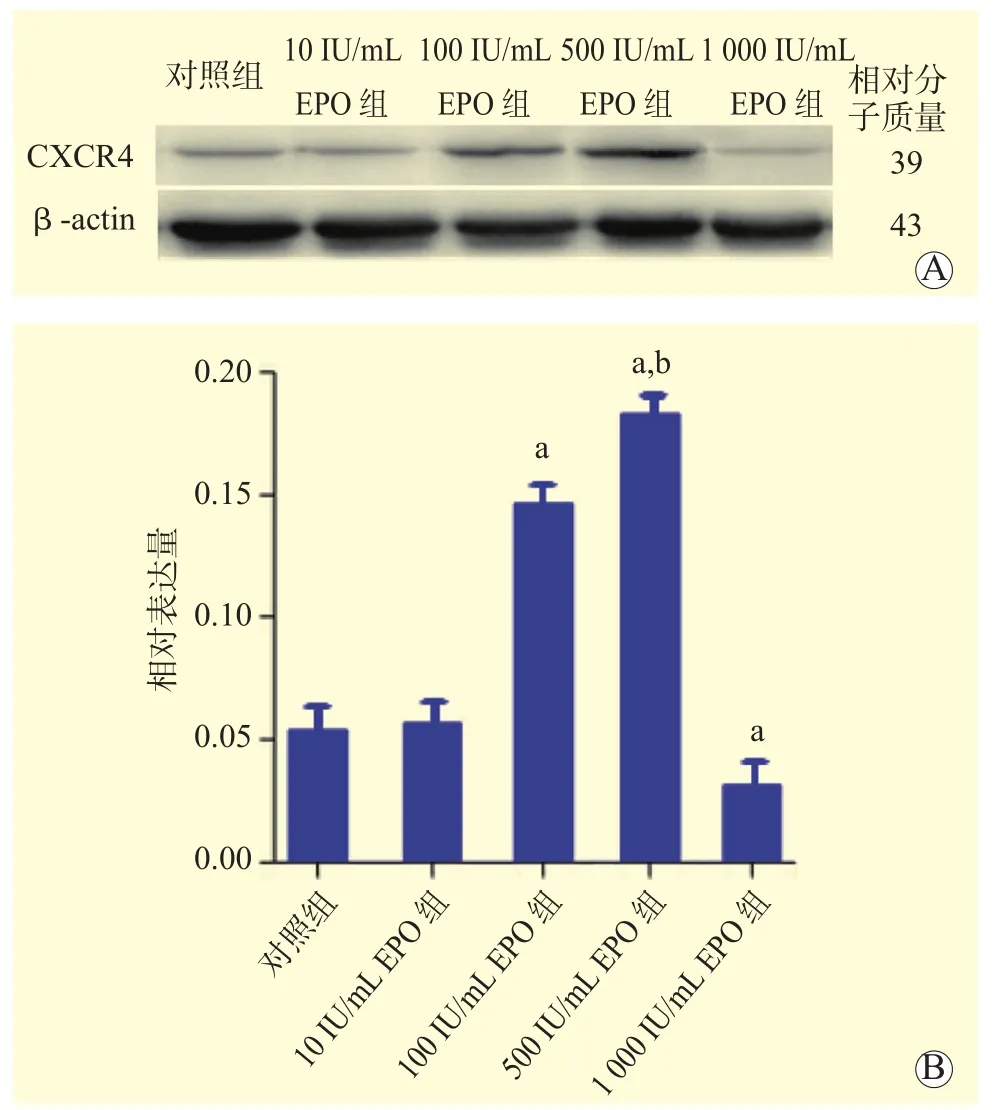
图3 EPO对BMSC中CXCR4表达水平的影响Figure 3 Effects of EPO on CXCR4 expression level in BMSC
2.6 EPO对BMSC细胞骨架形态的影响
培养48 h后,EPO对BMSC细胞骨架形态的影响见图6。BMSC组中,大多数细胞的细胞骨架杂乱排列,无固定模式;但在EPO-BMSC组,大多数细胞的纤维骨架沿细胞的长轴排列,呈平行状。
3 讨 论
在不同的培养条件下,BMSC能够高度增殖,并且通过诱导可以分化为骨、软骨、脂肪、肌肉、神经等组织细胞[11]。从骨髓中提取的BMSC集合了多种细胞的细胞群,即使来源一致,仍无法明确所提取的细胞中BMSC所占比例。因此,在实验过程中,对BMSC进行鉴定较为重要[12]。BMSC的鉴定内容主要包括对其形态学特征、表面抗原、超微结构及多向分化能力等的检验[13]。人类BMSC的鉴定标准包括:(1)在标准培养条件下具有贴壁可塑性;(2)表达 CD105、CD73、CD90,不表达 CD45、CD34、CD14、CD11b、CD19和人类白细胞抗原(human leukocyte antigen,HLA)-DR表面分子;(3)具有在体外分化为骨细胞、脂肪细胞和成软骨细胞的能力[14]。本实验中,EPO-BMSC组和BMSC组BMSC的表面标志物表达情况均为CD90和CD44阳性,CD45阴性;在成骨诱导中,两组BMSC均可见红色的致密结节出现,成脂诱导12 d后,可见红色脂滴,表明EPO与BMSC共培养后,EPO并没有影响BMSC的定向分化。

图4 EPO对BMSC表面标志物表达的影响Figure 4 Effects of EPO on expression of surface markers of BMSC
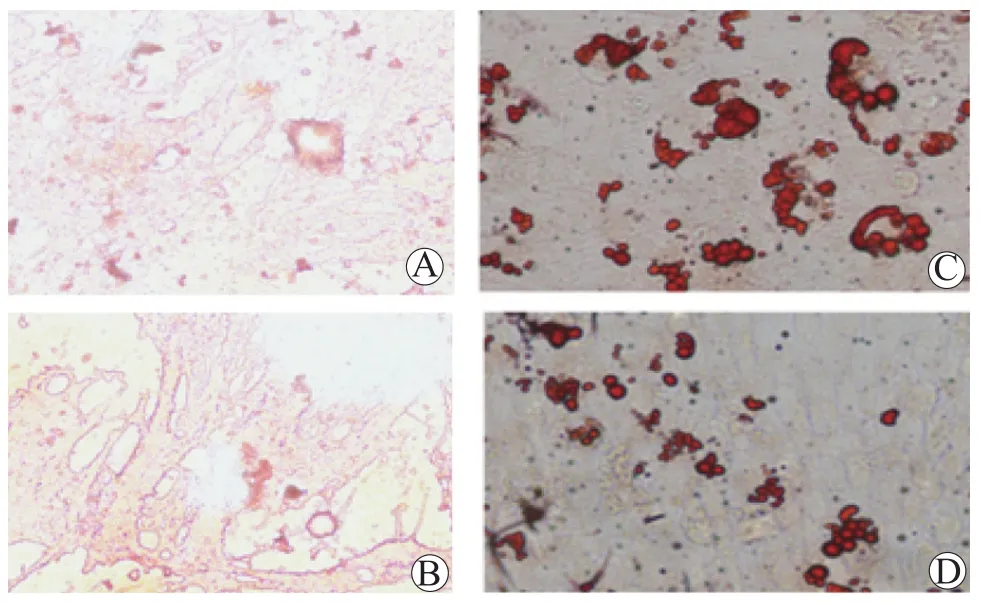
图5 EPO对BMSC定向分化的影响Figure 5 Effects of EPO on directional differentiation of BMSC
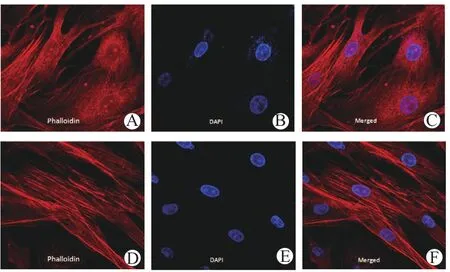
图6 EPO对BMSC细胞骨架形态的影响(免疫荧光,×400)Figure 6 Effects of EPO on cytoskeletal morphology of BMSC
越来越多的研究证实了BMSC移植治疗各种疾病的安全性、可行性和有效性。国内已经有学者在肾移植手术过程中经移植肾动脉输注BMSC,手术顺利,术后未发生栓塞、感染等并发症,并且受者术后均采用低剂量免疫抑制方案,也未发生排斥反应,术后移植肾功能恢复良好[15]。但BMSC移植治疗的效果仍受到较多因素限制,如BMSC向受损组织归巢率、局部缺氧和炎症微环境下BMSC的存活率等[16]。有研究者将间充质干细胞的归巢作用定义为间充质干细胞在目标组织的脉管系统中被捕获,穿过血管内皮细胞迁移至目标组织的过程[17]。许多学者认为,间充质干细胞的归巢作用类似于白细胞向炎症组织迁移的过程,与细胞表面表达趋化因子和生长因子等受体有关,目前研究最多的是基质细胞衍生因子1(stromal cell derived factor 1,SDF-1)、CXCR、黏附因子等[18-22]。CXCR4是一种重要的趋化因子受体,可与配体SDF-1结合,是参与BMSC迁移归巢的主要信号通路[23]。Liu等[24]将BMSC输注到急性肾损伤小鼠体内,结合EPO皮下注射,可使受损肾组织SDF-1蛋白表达升高,并且BMSC在肾脏组织聚积的数量也增加。也有研究显示在一定浓度范围内,EPO可促进BMSC增殖,且与浓度大小呈依赖关系[25]。本实验结果显示,EPO与BMSC共培养48 h后,100、500 IU/mL EPO可促进BMSC增殖。此外,我们发现与对照组比较,100、500 IU/mL EPO组中BMSC的CXCR4表达量增加;EPO处理后的BMSC纤维骨架沿细胞的长轴排列,呈平行状,该细胞骨架形态表明BMSC迁移能力增强[26]。
综上所述,EPO可提高BMSC的迁移率、增殖能力和组织修复治疗能力,可能通过增加CXCR4的表达促进其向损伤器官组织的定向归巢。EPO作为BMSC的预处理因素具有良好的应用前景,这仍需进一步的动物模型,甚至大规模的临床实验进行探索。
