双能量CT与多层螺旋CT评估胃癌分化程度的对照研究
2021-01-15吉玉刚卢定友
吉玉刚,卢定友,温 竞
1. 盐城市第一人民医院CT室,江苏 盐城 224000;
2. 江苏医药职业学院影像学院,江苏 盐城 224006
胃癌是常见的消化系统恶性肿瘤之一,2018年全球癌症报告指出,胃癌的发病率和死亡率位居恶性肿瘤前列[1]。不同病理学分化类型的胃癌患者生物学行为及预后不尽相同,术前准确评估分化程度对胃癌患者的治疗及预后具有重大意义。相关文献报道多层螺旋CT(multi-slice spiral CT,MSCT)在术前初步判断胃癌的病理学分化类型有一定的价值[2-3]。双能量CT(dual energy CT,DECT)具有多个定量参数的优势,但其在胃癌分化程度方面的研究尚少。本研究将选取的胃癌患者随机采用MSCT或DECT检查,旨在分析比较两者评估胃癌分化程度的价值。
1 资料和方法
1.1 研究对象
前瞻性选取2018年9月—2019年10月盐城市第一人民医院胃镜提示胃癌、术前行CT增强扫描的患者130例,随机采用MSCT或DECT检查(影像号末位奇数使用MSCT,偶数使用DECT),排除图像质量不佳或病灶太小无法良好显示者4例,已发生远处转移或不同意接受外科手术者11例。最终115例患者纳入研究,行MSCT增强模式55例[男性37例,女性18例,年龄(65.09±10.02)岁],行DECT增强模式60例[男性45例,女性15例,年龄(64.18±12.01)岁],以手术后病理学检查为金标准,分为低分化胃癌组和中高分化胃癌组。本研究获得了医院伦理委员会批准,全部受检者于检查前均已签署碘增强知情同意书。
1.2 检查方法
患者禁食6~8 h,检查前15~20 min口服阴性对比剂800~1 200 mL,肌内注射20 mg盐酸山莨菪碱(6 5 4-2),扫描前进行呼吸屏气训练,扫描范围自膈顶至盆腔。按1.5 mL/kg剂量,以3 mL/s流速经肘正中静脉注射碘增强造影剂[双北碘海醇注射液,100 mL∶35 g(I)]。行常规平扫后,动脉期扫描采用PreMonitoring自动触发模式:当同层面腹主动脉CT值达100 Hu时,延时12 s后行动脉期扫描,动脉期扫描结束后,延迟30 s行静脉期扫描。DECT模式采用德国Siemens公司SOMATOM Definition Flash CT机,同时使用A、B两球管,其中A球管100 kV,B球管Sn140 kV(Sn表示加了锡板过滤),自动管电流;MSCT模式增强仅使用该设备A球管(120 kV),自动管电流。以5 mm层厚及层间距重建图像用于常规影像学诊断,以1 mm层厚及层间距重建图像并传送至Syngo.via工作站。
1.3 图像分析及数据测量
1.3.1 MSCT增强模式
用德国Siemens公司的Syngo.via工作站MMreading软件打开MSCT模式的55例图像,在病灶最大层面勾画圆形感兴趣区(region of interest,ROI),ROI选取病灶内强化区,避开肉眼可见的血管、坏死及钙化,ROI直径大于病灶厚度的1/2,平扫、动脉期及静脉期选取同层面同位置同大小的ROI,均测量3次取其平均值,分别测量平扫CT值、动脉期CT值、静脉期CT值,并计算动脉期强化增加值CTa(动脉期CT值-平扫CT值)和静脉期强化增加值CTv(静脉期CT值-平扫CT值)。
1.3.2 DECT增强模式
用Syngo.via工作站Dual-Energy软件打开DECT模式的60例图像,病灶勾画ROI方法同上,另选取同层面主动脉做标准化处理,计算出动、静脉期标准化碘浓度(normalized iodine concentration in arterial /venous phase,NICa/NICv);重建动、静脉期40 keV及70 keV的单能量图像并测得病灶的CT值,计算能谱曲线40~70 keV区间的动脉期斜率λa和静脉期斜率λv计算公式:λ=(CT40keV-CT70keV)/(40-70)。
1.4 统计学处理
应用SPSS 16.0软件进行数据处理。对计量资料采用Shapiro-Wilk进行正态性检验,符合正态分布、方差齐的采用独立样本t检验,方差不齐的采用近似t检验;有统计学意义的指标绘制受试者工作特征(receiver operating characteristic,ROC)曲线,比较曲线下面积(area under curve,AUC)。采用二元logistic回归模型联合NICv和λv两指标,绘制ROC曲线并分析。P<0.05为差异有统计学意义。
2 结 果
MSCT模式检查的55例患者中,低分化组胃癌26例,最大径(4.52±1.6)cm,其中T1期2例,T2期8例,T3期10例,T4期6例;中高分化组胃癌29例,最大径(4.13±1.23)cm,其中T1期3例,T2期11例,T3期13例,T4期2例。平扫CT值、动脉期CT值、静脉期CT值、动脉期增加值CTa、静脉期增加值CTv,低分化组均高于中高分化组,但只有静脉期CT值及CTv在两组间差异有统计学意义(表1)。
DECT模式检查的60例患者中,低分化组胃癌29例,病灶最大径(4.92±2.03)cm,其中T1期1例,T2期9例,T3期11例,T4期8例;中高分化组胃癌31例,病灶最大径(4.33±1.72)cm,其中T1期2例,T2期11例,T3期13例,T4期5例。组内比较,动脉期参数NICa和λa均低于静脉期参数NICv和λv。组间比较,低分化组的NICa、NICv、λa、λv均高于中高分化组,差异有统计学意义(图1、2,表2)。
通过对两种模式下有统计学意义的参数绘制鉴别低分化组与中高分化组胃癌的ROC曲线。DECT的4个参数AUC均大于MSCT,DECT参数的内部比较中,静脉期指标的AUC大于动脉期(表3,图3、4)。联合DECT静脉期参数NICv和λv,AUC最大,选取合适的阈值时,灵敏度为0.862,特异度为0.871(表3,图5)。

图1 典型病例1(患者,女性,56岁,贲门-胃小弯低分化腺癌)影像及病理学表现

图2 典型病例2(患者,男性,72岁,胃小弯中高分化腺癌)影像及病理学表现

表2 低分化组及中高分化组胃癌能谱参数定量分析
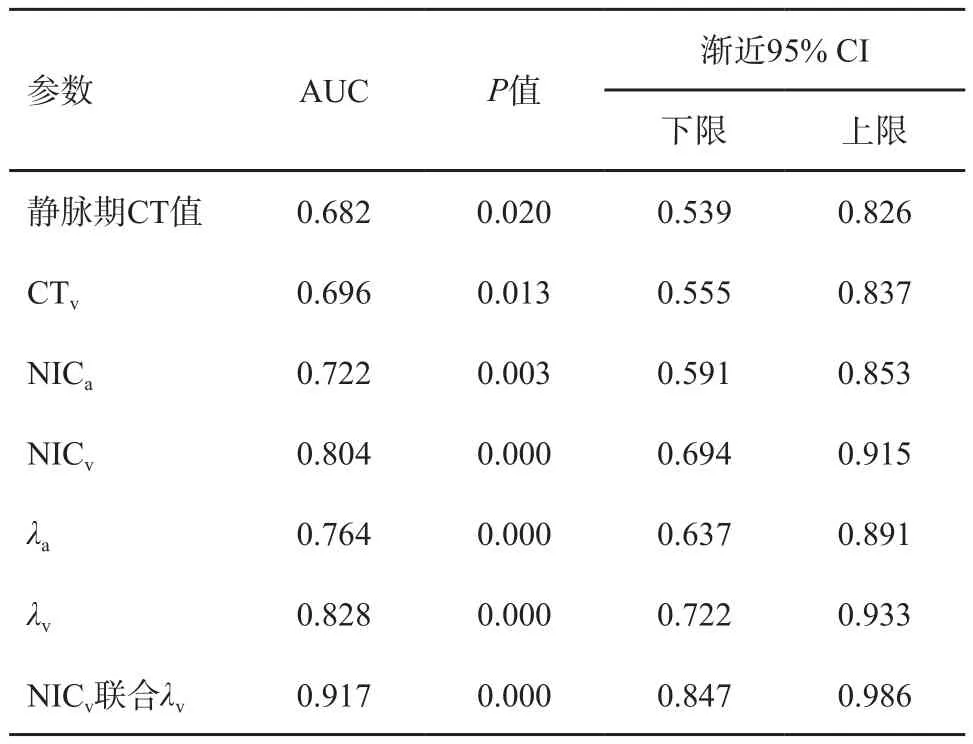
表3 两种增强模式下多个参数AUC比较

图3 MSCT增强模式静脉期CT及CTv鉴别低分化与中高分化胃腺癌的ROC曲线
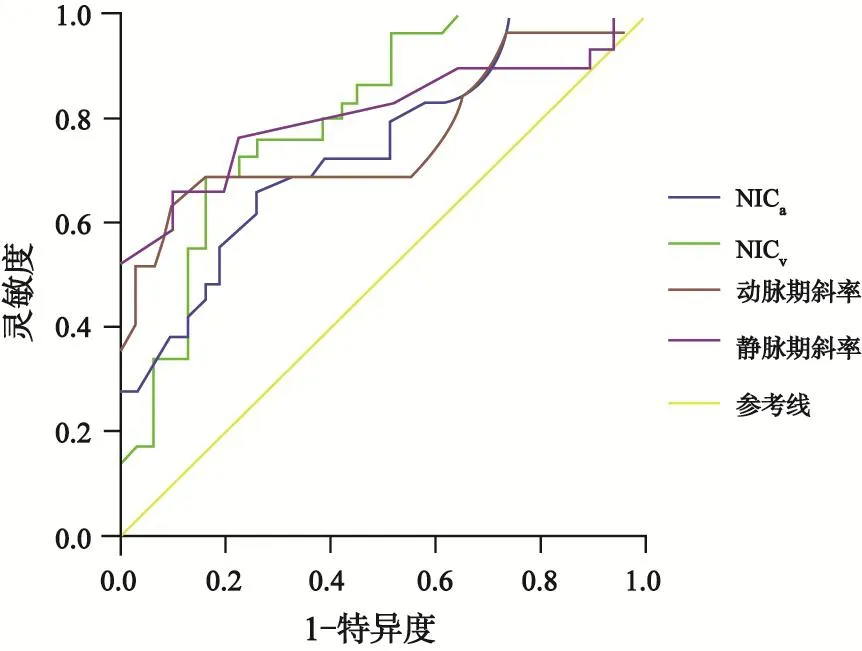
图4 双源CT能谱参数NICa、NICv、λa、λv鉴别低分化与中高分化胃腺癌的ROC曲线
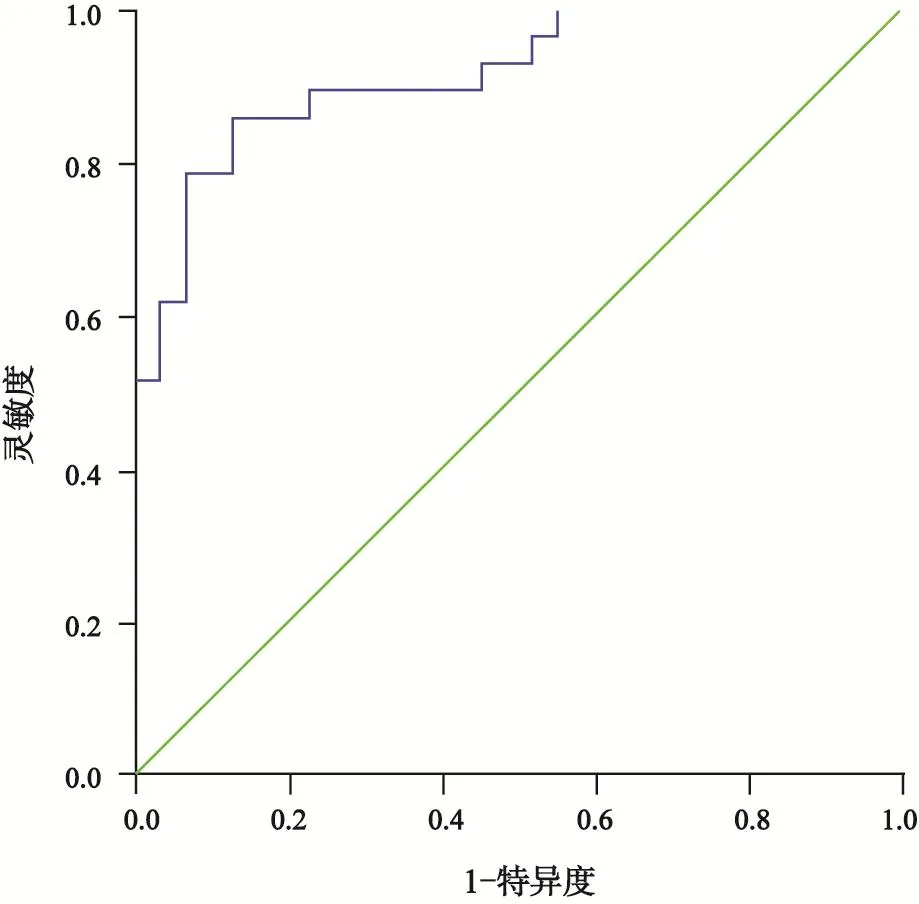
图5 联合NICv与λv鉴别低分化与中高分化胃腺癌的ROC曲线
3 讨 论
MSCT检查简便快捷,空间分辨率高,已经成为术前评估胃癌的常规检查方法[4]。本研究发现低分化组胃癌静脉期CT值(97.81±8.94)高于中高分化组(92.00±8.00),低分化组胃癌CTv(61.88±7.50)高于中高分化组(56.52±6.86);而平扫CT值、动脉期CT值及CTa在两组胃癌中的差异无统计学意义,原因可能是相对于中高分化组胃癌,低分化组胃癌呈弥漫浸润性生长,其肿瘤新生毛细血管密集、扭曲,增强后静脉期造影剂充分填充肿瘤新生血管床且部分造影剂扩散至血管周围间隙,病灶内碘造影剂含量更高,对X线的衰减更明显,表现出的CT值更大,低分化组胃癌与中高分化组胃癌的这种差异能够在静脉期充分显示出来,而动脉期成像过早,造影剂尚不能完全进入病灶内,平扫图像不能反映两组胃癌肿瘤血管密度的差异,这与白利杰等[2]及马轶等[5]的研究结果基本一致。
本研究发现低分化组胃癌NICa和NICv均高于中高分化组。Liang等[6]研究证实了NIC与微血管密度呈显著正相关,NIC可以作为肿瘤微血管的量化指标。以往的研究[7]发现肿瘤血管生成程度与病理学分级密切相关,即肿瘤分化越差,微血管密度值越高。本研究取同层面腹主动脉作归一化处理,将得出的百分数进行比较,很大程度上减少了因个体循环时间、个人血容量等差异产生的误差。低分化胃癌组织新生血管丰富,肿瘤微血管通透性高,因此测得的NIC高;中高分化胃癌新生毛细血管密度偏低,因此测量出的NIC较低。Sun等[8]及刘洋等[9]研究胃癌灌注得出的结果支持了本研究的结论,他们的研究结果表明低分化腺癌微血管血容量、微血管表面通透性显著高于中高分化腺癌。CT灌注成像(CT perfusion imaging,CTP)可以量化肿瘤微血管生成情况,并结合多个灌注参数辅助判断病灶的性质。CTP采用摇篮式重复扫描采集数据,其辐射剂量高、扫描时间长,而腹部脏器易受呼吸及胃肠蠕动的影响,这些缺点限制了其在腹部的广泛使用,双能量扫描碘图可以弥补这些不足。本研究结果同杜江华等[10]的研究存在差异,其研究结果显示动脉期NIC在低分化组与中高分化组间差异无统计学意义,可能原因是其样本量过少(每组仅10例),造成结果偏倚。
本研究发现,两组胃癌的能谱曲线均随着虚拟单能X线keV的增加而下降,这符合X线与物质相互作用的规律:碘的K边界值为33.2 keV,X线的能量越接近边界值,光电吸收就越明显,量化表现出来的CT值就越高。不同组织随keV变化时对射线衰减的变化程度不一样,因此每一种组织都有其特定的能谱曲线[11]。两组曲线均表现为低keV水平曲线走行陡峭,高keV水平曲线走行相对平缓。这一规律表明低keV时可以将不同组织间的细微差别加以放大,从而有利于不同组织的鉴别。本研究发现40~70 keV低分化组胃癌曲线陡峭,中高分化组曲线相对平缓,即40~70 keV低分化组胃癌斜率大于中高分化组,这与唐浩等[12]的研究结果基本一致。
MSCT增强模式下静脉期CT值及静脉期CT增加值(CTv)鉴别低分化组胃癌与中高分化组胃癌的AUC为0.682、0.696,低于DECT参数的AUC,表明前者诊断效能较低,原因可能是MSCT的X射线是混合能量射线,在射线传播过程中会因为射线的硬化效应,导致CT值偏移,不能精确地反映不同组织间的差异。另外,在传统的混合能量图像中,用单一的CT值参数往往难以全面揭示这些病变的内在特征,这也印证了常规MSCT主要反映病变的形态学特征,在显示肿瘤微观结构及功能学方面还存在局限性。本研究得出DECT静脉期能谱参数NICv、λv所对应的AUC大于动脉期能谱参数NICa、λa,表明评估胃癌分化程度时,静脉期能谱参数优于动脉期,这与血流动力学机制相符,静脉期低分化组胃癌的新生毛细血管充盈更加充分,伴部分造影剂外渗至血管外间隙,同时间质纤维组织的明显增加降低了造影剂的流出速度,郑玉飞等[13]的发现支持本研究的结果。联合静脉期参数NICv与λv,鉴别低分化组与中高分化组胃癌的AUC达0.917,均高于单一参数,也体现了DECT多定量参数的优势。
综上所述,双能量CT的NIC及低keV水平的能谱曲线斜率有助于鉴别低分化胃癌与中高分化胃癌,且静脉期参数更具优势,诊断效能优于常规MSCT。本研究存在一定的局限性,由于样本量的限制,未能在不同分化胃癌组内根据病灶的不同分期、不同大小再分组,也未能与病理学检查进行深入对照,仍有待扩大样本量进一步研究。
