基于双参数磁共振成像PI-RADS v2的列线图模型对前列腺临床显著癌的诊断价值分析
2021-01-15王志兵陆应军
王 钧,王志兵,陆应军
1. 淮安市淮安医院影像科,江苏 淮安 223200;
2. 阜宁县人民医院影像科,江苏 盐城 224400
前列腺癌(prostate cancer,PCa)是老年男性常见的恶性肿瘤之一,在欧美发达国家,其死亡率位于第二位,仅次于支气管肺癌。根据2019年美国癌症协会(American Cancer Society,ACS)统计数据显示,PCa新发例数居于首位(约174 650例),占所有肿瘤新发例数的20%[1]。中国PCa发病率虽低于欧美发达国家,但近年来由于人口老龄化、饮食习惯和生活方式的改变,PCa发病率逐年上升。另外,中国PCa患者临床就诊时病情往往处于中、晚期阶段,临床治疗效果和预后不佳[2]。目前,血清前列腺特异性抗原(prostate-specific antigen,PSA)水平检测是临床PCa筛查的常用方法,其诊断灵敏度高,但特异度低。近年来,基于血清PSA水平而衍生出的血清游离PSA比值(percent free PSA,f/t-PSA)、PSA密度(PSA density,PSAD)等多项临床指标可不同程度地提高对PCa的诊断能力[3-4]。
PCa和非癌病变(尤其是良性前列腺增生症)的临床表现常相似,有时难以准确鉴别。磁共振成像(magnetic resonance imaging,MRI)因其无创性检查、良好的空间分辨率及多参数成像等优势,在前列腺病变的诊断和鉴别诊断中发挥着重要作用。目前,前列腺MRI检查常用多参数MRI(multiparametric MRI,mp-MRI)序列,主要包括T2加权成像(T2-weighted imaging,T2WI)、扩散加权成像(diffusionweighted imaging,DWI)和动态对比增强MRI成像(dynamic contrast-enhanced MRI,DCEMRI)。基于多参数MRI的前列腺影像报告和数据系统第二版(Prostate Imaging Reporting and Data System version 2,PI-RADS v2)评分对前列腺病变的诊断和疗效监测具有重要作用,现已广泛应用于临床[5-6]。PI-RADS v2评分主要针对临床显著癌[7](即Gleason评分≥7分,和/或体积≥0.5cm3,和/或包膜外侵犯)。然而,DCE-MRI对PCa的检出价值存在诸多争议。近年来,由T2WI和DWI序列组成的双参数MRI(biparametric MRI,bp-MRI)检查方案被提出并应用于PCa的诊断。简化的bp-MRI不仅对PCa的诊断效能与mp-MRI相当,而且还可解决mp-MRI检查费用高、检查时间长且对比剂应用潜在风险等问题[8-10]。因此,简化的bp-MRI可作为优选MRI扫描方案应用于临床。
目前,尚无任何一种无创性检查方法在诊断PCa上能同时兼顾灵敏度和特异度,因此需将影像学检查与临床指标进行联合诊断,可提高对PCa,尤其是临床显著癌的诊断效能。列线图是一种基于逻辑回归或Cox回归而建立的统计学模型,可用于临床事件的预测分析。该模型可将各预测指标进行量化并以图形化呈现,能够更为直观地对临床事件的风险进行评估和预测,现已广泛应用于多种肿瘤,比如乳腺癌和PCa等[11-12]。本研究旨在应用基于bp-MRI PI-RADS v2评分联合临床指标建立的列线图模型预测前列腺临床显著癌发生风险,并与各独立预测指标单独应用的诊断效能进行比较、分析。
1 资料和方法
1.1 研究对象
本回顾性研究经伦理委员会同意,知情同意书舍弃。分析2015年1月—2019年12月在淮安市淮安医院及阜宁县人民医院进行前列腺MRI检查的患者资料,按照下述纳入和排除标准最终入组251例患者。纳入标准:① 血清总PSA水平升高(>4 ng/mL);② 进行bp-MRI(T2WI+DWI)扫描,检查序列均包括横断位和矢状位T2WI、横断位DWI;③ 患者信息及临床资料完整、准确;④ 前列腺MRI图像清晰,能够准确辨认各解剖结构;⑤ 前列腺MRI检查4周内获得病理学检查结果,且均为穿刺活检所得。排除标准:① 前列腺MRI检查前2周内行穿刺或其他治疗;② 病理学检查结果为非腺泡腺癌、上皮内瘤变或其他。
1.2 检测方法
MRI检查:应用德国Siemens公司的MAGNETOM Avanto 1.5 T磁共振扫描仪,体部相控阵线圈作为接收线圈。扫描参数按照PI-RADS v2推荐标准进行(表1),检查序列包括横断位和矢状位T2WI、横断位DWI,DWI(b=0、100、1 400 s/mm2)序列扫描完成后,图像后处理软件自动重建出表观扩散系数(apparent diffusion coefficient,ADC)。MRI扫描范围包括前列腺和精囊腺。
病理学标本来源:所有入组患者均行超声引导下经直肠穿刺活检明确病理学诊断。前列腺穿刺活检采用“10+X”系统穿刺法,将前列腺由上到下平均分为基底部、体部、尖部3部分,各部分再分为左、右两个区,基底部、体部左右两个区再细分为内、外侧部,整个前列腺共被分为10区,每区各穿刺1针。对于MRI异常的病灶由影像科医师与超声科操作医师沟通确认所在区位,并于超声见异常回声区,进行额外靶向穿刺X针(一般2~4针),穿刺标本病理学检查由超声科操作医师记录穿刺位置及进针深度,并分瓶存放、做好标签,以便将MRI异常发现与活检病理位置相匹配。取出的前列腺组织经甲醛固定、H-E染色后,由病理科医师观察并报告结果。
1.3 图像分析
由2名在前列腺MRI方面有5年以上工作经验的影像科医师共同阅片,并达成一致意见。bp-MRI评分基于2014年发布的PI-RADS v2评分标准进行,并进行少许更改[13]。即前列腺外周带以DWI序列为主,对于DWI序列3分病灶,由T2WI替代DCE-MRI进行评分;前列腺移行带评分则按照PI-RADS v2评分标准,详见表2。
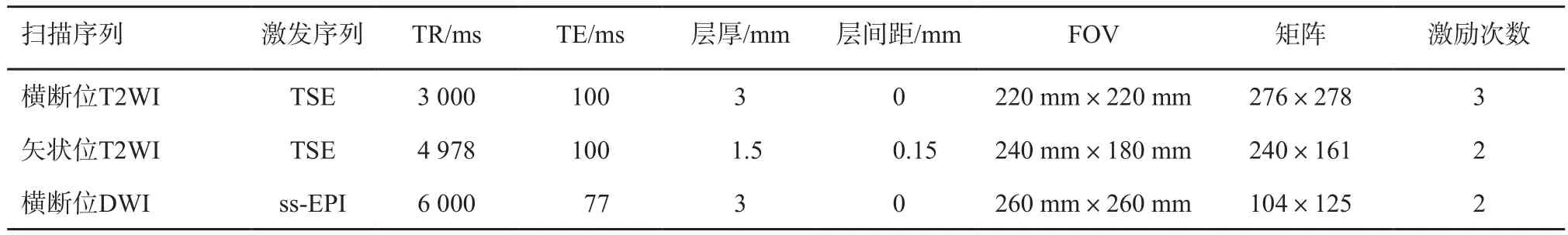
表1 前列腺bp-MRI扫描序列及参数

表2 前列腺bp-MRI评分标准
1.4 前列腺体积(prostate volume,PV)和PSAD计算
横断位T2WI图像上选择前列腺最大层面测量出前列腺最大左右径(transverse diameter,LR)和最大前后径(anteroposterior diameter,AP),矢状位T2WI图像上测量前列腺最大上下径(superoinferior diameter,SI),根据公式计算出相应的PV。根据PV和血清总PSA值(total PSA,t-PSA),计算出PSAD值。即PV=LR×AP×SI×0.52;PSAD=t-PSA/PV。
1.5 统计学处理
以穿刺标本病理学检查结果作为金标准,应用SPSS 22.0和Medcalc1 5.2.2软件对数据进行分析。符合正态分布的连续变量应用独立样本t检验,采用±s表示;不符合正态分布的连续变量或分类变量应用非参数检验(Mann-WhitneyU检验),采用四分位数(quartile)表示,即M(Q1,Q3)。多因素logistic回归分析确定前列腺临床显著癌的独立预测指标,应用R 3.6.2软件建立列线图模型(http://www.r-project.org/),采用Bootstrap自抽样方法对该模型进行内部验证,通过一致性指数(C-index)和校准曲线评价该模型的预测准确度和一致性。绘制受试者工作特征(receiver operating characteristic,ROC)曲线评价各独立预测指标和预测模型对前列腺临床显著癌的诊断效能,计算曲线下面积(area under curve,AUC),应用Z检验评价以上指标AUC是否存在差异。P<0.05为差异有统计学意义。
2 结 果
2.1 患者一般资料
本研究入组251例前列腺疾病患者,包括PCa 89例,其中临床显著性癌62例,低危癌(Gleason评分3+3)27例;非癌病变162例(包括良性前列腺增生症118例,前列腺炎性反应44例)。除了年龄指标符合正态分布外,其余指标(t-PSA、f/t-PSA、PV、PSAD和PI-RADS v2评分)不符合正态分布。临床显著癌组患者年龄58~88岁,平均年龄(73.24±7.12)岁;t-PSA中位数为20.06(10.48,44.54)ng/mL;f/t-PSA中位数0.10(0.07,0.14);PV中位数36.30(26.66,51.75)mL;PSAD中位数0.57(0.27,1.20)ng·mL-1·mL-1。低危癌及非癌病变组患者年龄41~95岁,平均年龄(68.05±8.66)岁;t-PSA中位数10.28(7.44,17.03)ng/mL;f/t-PSA中位数0.14(0.10,0.19);PV中位数58.97(42.46,82.09)mL;PSAD中位数0.20(0.13,0.30)ng·mL-1·mL-1。如表3所示,两组的患者年龄、t-PSA、f/t-PSA、PV、PSAD和PI-RADS v2评分比较,差异均有统计学意义(P<0.05)。
2.2 多因素logistic回归分析
应用logistic回归方法对诊断临床显著癌有统计学意义的指标(年龄、t-PSA、f/t-PSA、PV、PSAD和PI-RADS v2评分)进行多因素分析,确定独立预测指标(P<0.05);建立预测回归模型。如表4所示,年龄、PV和PI-RADS v2评分是诊断临床显著癌的独立预测指标(P<0.05)。

表3 患者一般资料

表4 各指标多因素logistic回归分析
2.3 预测前列腺临床显著癌风险的列线图模型建立和验证
根据多因素logistic回归分析确定的独立预测指标(年龄、PV和PI-RADS v2评分),应用R软件建立预测前列腺临床显著癌风险的列线图模型,如图1所示。列线图模型使用方法:在列线图模型中的各个独立预测指标,其取值是分别通过垂直投射在各自积分线上得到相应的分值,将所有预测指标的分值相加得到最终分值,垂直对应于总分线上即可获得相应的预测罹患前列腺临床显著癌的概率。经过Bootstrap自抽样方法重复抽样100次后,该列线图模型的C-index为0.920,具有良好的预测准确度。校准曲线显示列线图模型对预测临床显著癌的发生风险表现出较好的预测一致性(图2),其中当临床显著癌风险预测概率处于0.40~0.60,其预测概率与实际概率基本吻合。典型病例图像见图3、4。
2.4 预测模型对前列腺临床显著癌的诊断效能分析
以穿刺标本病理学检查结果为金标准,应用各独立预测指标和预测模型分析对临床显著癌的诊断效能见表5。应用独立预测指标诊断临床显著癌的AUC分别为0.864(PI-RADS v2评分)、0.754(PV)和0.676(年龄),而应用预测模型诊断临床显著癌AUC为0.932,显著高于各独立预测指标单独应用(图5)。PI-RADS v2评分、PV和年龄的AUC分别与预测模型的AUC进行比较,差异均有统计学意义[表5,Z值分别为3.322(P<0.001)、5.521(P<0.001)和6.490(P<0.001)]。各独立预测指标以及联合建立的预测模型,对临床显著癌诊断效能结果详见表5,其中预测模型对临床显著癌的诊断灵敏度为90.3%,特异度为85.2%,均高于各独立预测指标。将各独立预测指标之间的诊断效能进行比较,应用PI-RADS v2评分对临床显著癌的诊断灵敏度和特异度分别为85.5%、76.2%,均高于PV和年龄。该结果表明,在基于bp-MRI序列的PIRADS v2评分基础上,联合临床指标(PV和年龄)能提高对临床显著癌的诊断效能。

图1 预测前列腺临床显著癌风险的列线图模型

图2 列线图模型校准曲线

图3 前列腺癌bp-MRI图像

图4 良性前列腺增生症bp-MRI图像

表5 独立预测指标对临床显著癌的诊断效能分析
3 讨 论
2014年PI-RADS v2发布,推荐由T2WI、DWI和DCE-MRI组成的多参数MRI用于前列腺癌的诊断[10]。根据PI-RADS v2评分标准,在前列腺多参数MRI扫描方案中,T2WI和DWI处于主要地位。关于DCE-MRI对前列腺癌的诊断价值存在诸多争议。近年来,有研究[14]表明,由T2WI和DWI组成的bp-MRI能够检出约80%前列腺癌,而DCE-MRI对于前列腺癌的检出价值有限。最新研究[7,13]提出的bp-MRI评分体系是基于PI-RADS v2评分标准,但两者存在一些差异,即bp-MRI评分对于外周带DWI评分为3分的病灶,由T2WI代替DCE-MRI进行评分(若T2WI≤3分,则总分仍为3分;若T2WI≥4分,则总分上升至4分)。而移行带仍按照PI-RADSv2评分标准执行。张跃跃等[15]的研究表明,基于bp-MRI序列的PI-RADS v2评分对前列腺癌的诊断效能不低于基于多参数MRI序列的PI-RADS v2评分,运用多参数MRI与bp-MRI检出PCa的AUC值之间的差异均无统计学意义(Z值分别为0.816、1.687,P值分别为0.415、0.092)。另外,相较于前列腺多参数MRI扫描方案,应用bp-MRI扫描可缩短MRI检查时间、降低患者检查成本和消除钆对比剂使用所存在的潜在风险等。以上诸多优势使bp-MRI有望成为前列腺MRI检查的首选扫描方案。本研究结果显示,应用基于bp-MRI序列的PI-RADS v2评分诊断临床显著癌的灵敏度和特异度分别为85.5%和76.2%,与Niu等[16]研究结果(应用bp-MRI检出前列腺癌的灵敏度、特异度分别为81%、77%)基本一致;但稍低于沈钧康等[17]的研究结果(联合应用T2WI和DWI对早期前列腺癌的诊断灵敏度和特异度分别为85.71%和88.73%),主要原因在于本研究者对前列腺病变的MRI表现认识不够,对类似前列腺癌的非癌病变(如前列腺炎)难以准确鉴别。
PSA作为前列腺组织的特异性标志物,对前列腺癌的诊断灵敏度高,已广泛应用于前列腺癌的临床早期筛查。然而,由于良性前列腺增生症、前列腺炎性反应患者中血清总PSA水平也会出现不同程度的升高,造成PSA检测对前列腺癌的诊断特异度低下。Abdrabo等[18]的研究表明,血清总PSA水平对前列腺癌的诊断灵敏度为91.6%,而特异度仅为24%。因此,仅根据血清总PSA水平诊断前列腺癌会造成过多“假阳性”。近年来,多项临床指标,如f/t-PSA、PSAD、PV等得到应用以提高对前列腺癌的诊断。本研究表明,基于bp-MRI序列的PI-RADS v2评分、患者年龄和PV是临床显著癌的独立预测指标,而PSAD不是独立预测指标。该研究结果与牛翔科等[19]的结论基本一致,不同之处在于其文中提及的PI-RADS v2评分是基于多参数MRI序列,而本研究是针对bp-MRI序列。Tang等[20]也得出类似结论,即患者年龄、PSA水平、PV和直肠指检这4个独立预测指标可用于前列腺癌风险的评估。关于PSAD对前列腺癌的预测价值存在诸多争议。Distler等[21]认为,将PSAD与PI-RADS v2评分进行联合诊断,可显著提高前列腺癌诊断准确度。然而,也有一些学者得出截然不同的结论。Cuocolo等[22]的研究表明,联合PSAD并未提高基于bp-MRI的PI-RADS v2评分对临床显著癌的检出能力。
本研究是根据3个独立预测指标,即基于bp-MRI序列的PI-RADS v2评分、患者年龄和PV建立相应的列线图模型来预测临床显著癌的发生风险。近年来,多种预测模型被用于疾病诊断的研究。与其他预测方法相比,列线图更为直观、具体,能将多种指标进行整合,赋予各指标具体分值,通过将各指标的分值进行相加来推测临床事件发生的概率和风险。列线图预测模型建立后,通过内部验证和外部验证来评价该模型。内部验证主要通过一致性指数(C-index)评价该模型的预测准确度,应用校准曲线和决策曲线评价模型的预测一致性和临床应用价值。外部验证则主要是收集一定数量的新数据对已建立的模型进行验证。本研究应用R软件建立的列线图预测模型并通过内部验证表明,该模型具有良好的预测准确度(C-index=0.920)和一致性。另外,该预测模型对临床显著癌的诊断效能(灵敏度90.3%,特异度85.2%)优于各独立预测指标单独应用。此外,对各独立预测指标的诊断效能进行比较时发现,单独应用PI-RADS v2评分对临床显著癌的诊断灵敏度和特异度均高于患者年龄和PV。目前,我国老年男性数量日益增加,而罹患前列腺疾病的患者数量亦逐年递增,对前列腺MRI检查的需求越来越多,急需一种高效且可靠的检查方案来满足上述需求。本研究认为,基于bp-MRI的PI-RADS v2评分可作为临床显著癌的主要诊断指标。在此基础上,联合患者年龄和PV可显著提高对临床显著癌的诊断能力,具有良好的临床实用价值。
本研究不足之处:① 为单中心研究且样本量较少,下一步需扩大样本量进行验证以增加结果的可靠性;② 病理学标本均采用超声引导下的系统穿刺活检,可能会造成穿刺结果存在一定的误差;③ 列线图模型仅通过内部验证,还需通过外部验证来进一步明确该模型的预测能力。
综上所述,基于bp-MRI的PI-RADS v2评分、年龄和PV建立的列线图模型具有较高的预测价值,相较于上述各独立预测指标能显著提高对前列腺临床显著癌的诊断能力,具有一定的临床应用前景。
