miR-204抑制感染幽门螺杆菌的胃上皮细胞迁移和侵袭的机制研究
2021-01-15王婷婷朱晓轩裴小红
王婷婷,朱晓轩,裴小红
中国人民解放军联勤保障部队904医院苏州院区消化内科,江苏 苏州 215000
幽门螺杆菌(Helicobacter pylori,H.pylori)是最常见的人类病原体之一,它定植在全球约50%人口的胃壁上皮。H.pylori感染是引起胃萎缩和癌变的重要因素[1]。H.pylori被世界卫生组织列为I类致癌物,研究已经证实了H.pylori与胃癌之间的关系[2]。此外,研究发现H.pylori与胃癌转移和侵袭有关,也有研究发现H.pylori会促进胃癌细胞的迁移和侵袭[3]。最新研究显示,H.pylori会影响胃上皮细胞间的黏附,引起上皮-间充质转化(epithlial mesenchymal transition, EMT),破坏胃黏膜屏障,但其具体影响机制尚不清楚[4]。微小RNA(microRNA,miRNA)可在转录后调控基因的表达,这种功能是通过特异性的与靶基因的信使RNA结合(message RNA,mRNA)诱导mRNA降解和翻译抑制,并且在调控胃癌细胞迁移和侵袭中起到重要作用,miR-204可通过直接靶向EMT相关蛋白发挥抑制胃癌细胞迁移和侵袭的作用[5]。本文主要分析H.pylori对胃上皮细胞迁移和侵袭的影响以及miR-204在其中的作用。
1 材料与方法
1.1 主要材料和仪器人胃上皮细胞(GES1)和H.pylori(#26695)购自美国ATCC公司。DMEM培养基购自美国Invitrogen公司。miR-204类似物(mimic)以及相应的阴性对照(negative control,NC)购自美国Thermo Fisher公司(#MC11116)。Lipofectamine 2000购自美国Invitrogen公司。细胞计数试剂盒-8(cell counting Kit-8,CCK-8)试剂盒购自中国Beyotime生物技术研究所。Transwell小室以及基质凝胶购自美国BD Biosciences公司。PCR引物购自中国Genewiz公司。Trizol试剂购自美国Invitrogen公司。逆转录cDNA试剂盒和SYBR Green PCR Master Mix qPCR试剂盒购自瑞士Roche公司。ABI 7500 PCR检测系统购自美国Life Technology公司。RIPA裂解缓冲液购自中国Beyotime公司。anti-E-cadherin(#ab1416)、anti-N-cadherin(ab18203)、anti-Vimentin(ab92547)、GAPDH(ab181602)以及对应的二抗购自美国Abcam公司。PVDF膜购自美国Bio-Rad公司。BCA蛋白测定试剂盒和ECL试剂盒购自中国Applygen公司。IX71显微镜购自日本Olympus公司。
1.2 细胞培养、分组将GES1细胞在DMEM培养基中培养,37 ℃,体积分数为5%的CO2,相对湿度100%。将细胞分为3组,即对照组、H.pylori组和H.pylori+mimic组。
1.3H.pylori感染H.pylori组和H.pylori+mimic组细胞与H.pylori进行共培养。将GES1细胞培养至贴壁生长至80%,倒出培养基,按照H.pylori与GES1细胞100∶1的比例进行共培养7 d,37 ℃,体积分数为5%的CO2。感染后使用显微镜观察细胞形态。
1.4 细胞转染H.pylori+mimic组细胞在与H.pylori共培养之前转染miR-204 mimic。使用Lipofectamine 2000试剂盒进行瞬时转染,对照组和H.pylori组细胞转染等量的NC作为对照,在转染24 h后收集细胞进行后续实验。
1.5 qPCR实验通过Trizol获得细胞中总RNA,然后检测RNA的纯度和浓度。使用cDNA试剂盒将1 μg RNA逆转录合成cDNA(42 ℃,60 min,70 ℃,5 min,然后4 ℃保存)。使用SYBR Green PCR Master Mix进行qPCR实验(反应条件如下:95 ℃,10 min,60 ℃ 30 s,72 ℃ 1.5 min,40个循环,72 ℃ 10 min,延伸,-20 ℃保存)。U6作为miRNA的内参,通过比较循环阈值(ΔΔCt)分析miR-204的表达。
1.6 细胞划痕实验检测迁移能力将细胞消化后分别接种在6孔板中,每孔1×106个,然后在37 ℃、体积分数为5% 的CO2、相对湿度100%条件下培养直至90%汇合。然后使用200 μl移液枪头从上至下做划痕,将划掉的细胞洗去。然后在相同条件下继续培养24 h。使用倒置显微镜观察并获得图像,测量细胞前缘移动距离的百分比(两端前缘移动距离/划痕宽度×100%)。
1.7 Transwell实验检测侵袭能力在Transwell小室的上室加入基质胶,底室加入完全培养基,然后将3×104个细胞加入至上室培养48 h。48 h后洗去未侵入底室的细胞。然后将细胞使用20%甲醇固定,并用0.2%结晶紫染色。在倒置显微镜下计数每个视野侵入底部室的细胞数目。
1.8 Western blotting检测EMT相关蛋白在液氮下将细胞研磨,在液氮保护下使用RIPA裂解缓冲液裂解,并使用BCA蛋白测定试剂盒测量总蛋白含量。然后使用SDS-PAGE分离等量的总蛋白(120 V下电泳90 min),然后将蛋白转移到PVDF膜上(50 V,120 min),在含有质量浓度为50 g/L的脱脂牛奶的封闭溶液中封闭。然后将PDVF膜与E-cadherin、N-cadherin、Vimentin抗体(1∶500稀释)在4 ℃孵育过夜,然后加入1∶5 000稀释的HRP偶联二抗在室温下孵育1 h。使用ECL试剂盒可视化蛋白条带,并使用ImagePD软件使用GAPDH作为内参对蛋白条带的灰度进行定量。

2 结果
2.1 感染H.pylori对GES1细胞miR-204的影响通过显微镜可观察到感染H.pylori后的GES1细胞,且感染H.pylori后细胞边界不清晰(见图1)。根据qPCR的检测结果,感染H.pylori后,GES1细胞中的miR-204水平比正常GES1细胞显著降低,差异有统计学意义(t=27.962,P=0.000)。

图1 显微镜观察与H.pylori共培养后GES1细胞形态(100×)
2.2 各组细胞中miR-204水平H.pylori组的miR-204水平为0.36±0.04,显著低于对照组的1.00±0.07,差异有统计学意义(P<0.05);H.pylori+mimic组的miR-204水平为5.86±0.39,显著高于对照组和H.pylori组,差异有统计学意义(P<0.05)。
2.3 各组细胞迁移和侵袭能力比较H.pylori组的细胞迁移和侵袭能力显著高于对照组(P<0.05);H.pylori+mimic组的迁移和侵袭能力显著低于H.pylori组(P<0.05)(见表1、图2~3)。

表1 各组划痕前沿迁移百分比和侵袭细胞数目比较Tab 1 Comparison of scratch front migration percentage and number of invading cells in each group

图2 细胞划痕实验检测H.pylori和miR-204 mimic对GES1细胞迁移能力的影响(100×)Fig 2 Cell scratch test to detect the effects of H.pylori and miR-204 mimic on the migration ability of GES1 cells (100×)
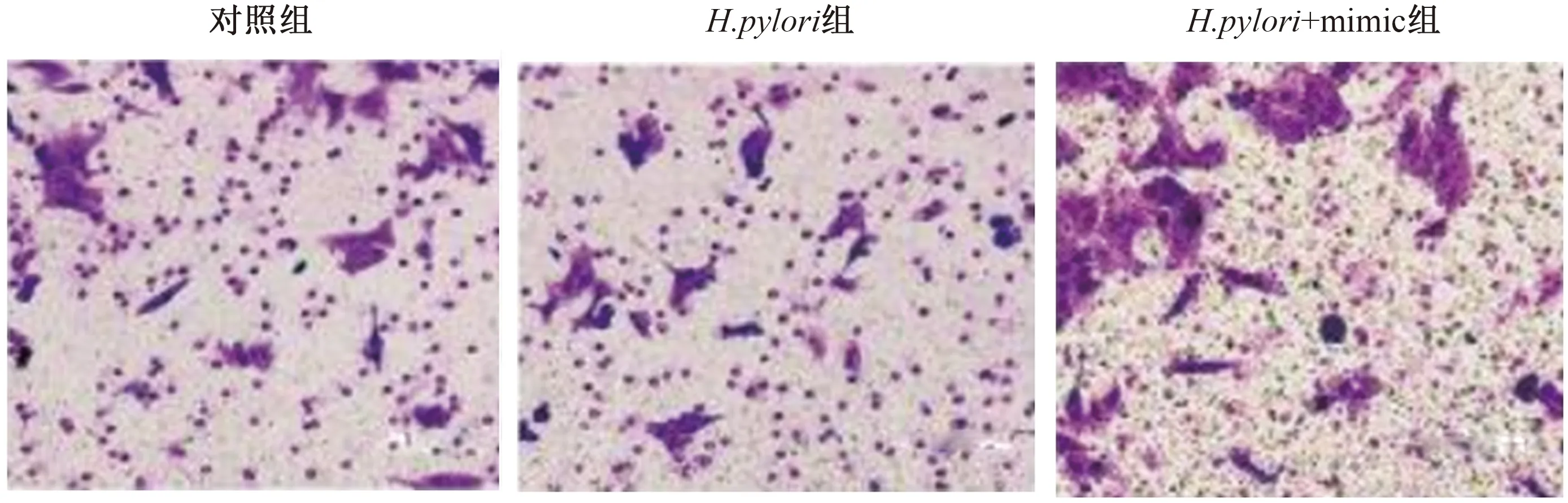
图3 Transwell检测H.pylori和miR-204 mimic对GES1细胞侵袭能力的影响(200×)
2.4 各组EMT相关蛋白表达水平比较H.pylori组的E-cadherin蛋白显著高于对照组而N-cadherin蛋白和Vimentin 蛋白显著低于对照组(P<0.05)。H.pylori+mimic组的E-cadherin蛋白显著低于H.pylori组而N-cadherin蛋白和Vimentin蛋白显著高于H.pylori组(P<0.05)(见表2、图4)。

表2 各组E-cadherin、N-cadherin和Vimentin蛋白表达水平比较

图4 Western blotting检测各组EMT相关蛋白表达
3 讨论
H.pylori在胃中很常见,由于其无法被宿主机体清除,一旦感染且未通过抗生素根除,则会在整个生命周期中持续存在。其中,有10%~15%的感染个体会发展为严重的胃病,这主要取决于细菌表达的致病性、毒力因子、环境因素和个体遗传易感性。在健康个体中,胃上皮是抵抗病原体有效的第一道屏障,机体可通过调节胃上皮细胞的形状、极性、细胞与细胞以及细胞与基质的黏附力,保持胃屏障的完整性,并起到隔绝病原体的作用[6]。H.pylori伴随着胃黏液定植,会影响胃上皮屏障功能,并诱导炎症反应和肿瘤样改变。
H.pylori会影响胃上皮细胞和胃癌细胞的生物学行为,包括增殖、凋亡、迁移、侵袭等,H.pylori介导的胃上皮细胞的迁移和侵袭是一个极其复杂的协调过程,其可通过多个途径使细胞边缘的层状脂膜扩展,改变细胞外基质,并使细胞粘连减少,引起细胞的迁移和侵袭。且H.pylori也可能通过促进血管生成引起胃癌细胞的转移[7]。研究发现,H.pylori的细胞毒素相关基因E可能通过TGF-β1促进人胃癌细胞AGS和MKN45的迁移和侵袭,并促进EMT[8]。miR在H.pylori调控的胃上皮细胞生物学行为中发挥重要作用,如miR-30可能通过抑制自噬途径的多种核心蛋白促进H.pylori在胃上皮细胞中的活性[9]。Zhou等[10]的研究显示,H.pylori感染后会通过调控长链非编码RNA AF147447调节miR-34c的表达,从而参与胃癌细胞的增殖和侵袭。本次研究中首次发现将GES1细胞与H.pylori共培养后miR-204的水平显著降低。miR-204与胃癌的发生和发展有关,在胃癌细胞中,H.pylori感染会使细胞中miR-204的水平降低从而促进迁移和侵袭[11]。Shi等[12]的研究也发现,miR-204的降低会促进H.pylori引起的胃癌进展。而本次研究在胃上皮细胞中也发现了H.pylori会抑制miR-204的表达。
miR-204是一种具有抑癌作用的miRNA,如在肝细胞癌、宫颈癌和前列腺癌中,miR-204均发挥着抑制肿瘤细胞迁移和侵袭的作用[13-15]。本次研究进一步发现,将GES1细胞与H.pylori共培养会促进细胞的迁移和侵袭,且过表达miR-204会逆转H.pylori对迁移和侵袭的促进作用。此外,本次研究还发现H.pylori组的E-cadherin蛋白显著高于对照组,而N-cadherin和Vimentin蛋白显著低于对照组,H.pylori+mimic组的E-cadherin显著低于H.pylori组而N-cadherin和Vimentin显著高于H.pylori组。E-cadherin维持细胞之间的紧密连接,是上皮表型的标志蛋白之一,N-cadherin和Vimentin是细胞上皮特征丧失及其转变为间质特征的标志。此外,研究发现,miR-204会抑制食管癌细胞的EMT过程。在肺腺癌、乳腺癌中miR-204也具有这种作用[17-18]。本次研究提示在胃上皮细胞中,miR-204也具有抑制由H.pylori引起的EMT。
综上所述,将胃上皮细胞与H.pylori共培养会使细胞中miR-204的水平降低,且过表达miR-204会通过调节EMT抑制由H.pylori引起的胃上皮细胞迁移和侵袭。但关于miR-204在H.pylori引起的胃上皮细胞迁移和侵袭中的作用还需要进一步的动物实验验证,其作用机制也值得进一步探讨。
