2型糖尿病患者血清25-羟胆骨化醇表达与糖尿病视网膜病变发生的相关性
2021-01-15杨欣荣陈东霞施燕红
杨欣荣, 陈东霞, 施燕红
(上海市青浦区中医医院 内科, 上海, 201700)
糖尿病视网膜病变(DR)是2型糖尿病(T2DM)患者的严重并发症,是造成患者低视力、致盲的主要原因之一[1]。维生素D可能参与T2DM的发生、发展,糖尿病患者维生素D水平明显低于正常人群[2]。血清25-羟胆骨化醇[25-(OH)VD]作为维生素D3的重要活性代谢物质,其水平能够反映维生素D的营养状态[3]。本研究探讨T2DM患者25-(OH)VD表达与DR的相关性,现报告如下。
1 资料与方法
1.1 一般资料
回顾性分析2018年6月—2019年12月本院收治的188例T2DM患者临床资料,所有患者均接受眼底及眼底荧光血管造影检查,根据检查结果将132例单纯T2DM无DR患者纳入无DR组,将56例T2DM发生DR患者纳入DR组。无DR组男56例,女76例; 年龄35~75岁,平均(58.62±7.81)岁; 体质量指数(BMI)为23~30 kg/m2, 平均(25.43±2.58) kg/m2; T2DM病程2~14年,平均(8.76±2.62)年。DR组男21例,女35例; 年龄35~76岁,平均(57.32±8.41)岁; BMI为23~30 kg/m2, 平均(26.42±2.57) kg/m2; T2DM病程1~13年,平均(8.31±2.45)年。2组一般资料比较,差异无统计学意义(P>0.05), 具有可比性。
纳入标准: ① T2DM符合《中国2型糖尿病防治指南(2017年版)》[4]中相关诊断标准, DR诊断符合《糖尿病视网膜病变防治专家共识》中相关标准者[5]。② 近期内未服用过维生素类药物; ③ 病历资料的抽取及阅读获得患者知情同意。排除标准: ① 合并急性感染者; ② 合并恶性肿瘤者; ③ 严重肝肾功能障碍者。
1.2 方法
所有患者均在入院后禁食8~10 h, 次日清晨抽取空腹静脉血5 mL, 以1500 转/min离心10 min后置于-20 ℃冰箱中保存待检。采用上海科华ST-360酶标仪(上海市聚慕医疗器械有限公司,国械注进2015632123)检测血清25-(OH)VD水平。
1.3 统计学方法
2 结 果
2.1 2组25-(OH)VD、HbA1c及FBG水平比较
无DR组患者25-(OH)VD水平为(52.43±11.26) nmol/L, HbA1c水平为(7.53±1.42)%, FBG为(8.13±0.62) mmol/L; DR组患者的25-(OH)VD水平为(31.87±8.85) nmol/L, HbA1c水平为(10.35±3.42)%, FBG为(10.24±0.47) mmol/L。无DR组25-(OH)VD水平高于DR组, HbA1c、FBG水平低于DR组,差异有统计学意义(P<0.05)。
2.2 25-(OH)VD、HbA1c及FBG水平与DR发生的相关性分析
双变量Kendall′s tau-b直线相关检验结果显示, 25-(OH)VD与DR的发生呈负相关(r=-0.684,P<0.001), HbA1c、FBG水平与DR的发生呈正相关(r=0.583、0.621,P<0.001)。
2.3 T2DM患者25-(OH)VD表达与DR发生的Logistic回归分析
将血清25-(OH)VD作为协变量, DR发生作为因变量(0=未发生DR, 1=发生DR), 经Logistic回归分析结果显示,血清25-(OH)VD低表达可能是诱发DR的影响因素(OR=1.836,P<0.05)。见表1。

表1 T2DM患者25-(OH)VD表达与DR发生的相关性分析
2.4 血清25-(OH)VD表达预测DR发生的价值分析
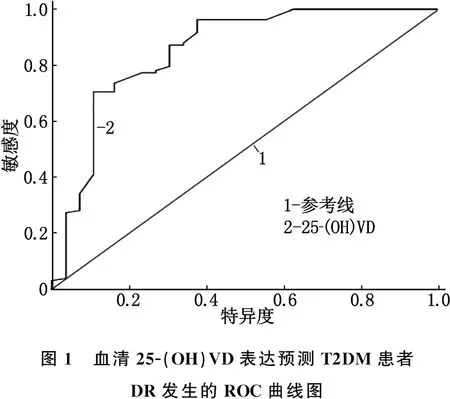
将血清25-(OH)VD作为检验变量,将DR发生作为状态变量(0=未发生DR, 1=发生DR), 绘制ROC曲线,结果显示,血清25-(OH)VD水平预测DR发生的AUC>0.8, 具有一定预测价值。见表2、图1。

表2 血清25-(OH)VD表达预测DR发生的价值分析
3 讨 论
DR发病机制复杂,与不良生活习惯、维生素D基因、蛋白尿等密切相关。DR可导致患者出现视力下降,且随病情加重会出现视野模糊,甚至失明,严重影响患者生活质量。维生素D作为类固醇激素,在糖脂代谢、免疫及炎症反应的调节中发挥重要作用[6]。研究[7]表明,适量补充维生素D能够有效降低T2DM患者炎症因子、纤维化水平,改善肾素-血管紧张素系统活性。
DR发生、发展除了与高血糖水平密切相关,还可能受到机体对血糖高水平的胰岛素抵抗、血脂水平紊乱、高血压及高凝状态等因素的影响[8]。上述因素可导致血管细胞外基质增多,基底膜增厚,炎症因子细胞长期干扰、浸润可导致内皮细胞及系膜细胞等增生,在内皮细胞功能受损情况下导致血液不断渗出,造成毛细血管闭塞,视网膜组织缺血、缺氧后则会发生水肿,随着时间的推移则会出现血管增生而引发DR[9]。维生素D高表达能够有效抑制内皮细胞增生,这与骨化醇及骨化三醇降低炎症因子水平有关[10]。此外, 25-(OH)VD能够通过延缓血管硬化、抗凝血及对微血管的形成起到抑制作用而发挥视网膜保护作用,且25-(OH)VD还可增加胰岛素分泌量,有效控制T2DM患者病情进展,对T2DM患者DR发生起到间接抑制及控制作用[11-12]。
本研究结果显示,无DR组25-(OH)VD水平高于DR组,提示25-(OH)VD在DR患者中呈低表达。进一步分析25-(OH)VD水平与DR发生的关系,结果发现,血清25-(OH)VD低表达可能是诱发DR的影响因素,提示25-(OH)VD可能参与DR的发生、发展。经双变量Kendall′s tau-b直线相关检验结果显示, 25-(OH)VD与DR的发生呈负相关(r=-0.684,P<0.001), HbA1c、FBG水平与DR的发生呈正相关(r=0.583、0.621,P<0.001), 提示血清25-(OH)VD呈下降而HbA1c及FBG水平呈上升趋势可能会引起DR的发生。进一步经ROC曲线检验结果显示,血清25-(OH)VD对DR具有一定的预测价值。因此,临床可给予T2DM患者适量的维生素D补充并配合其他有效的治疗方案,降低DR发生率或延缓病情发展。
综上所述, T2DM患者血清25-(OH)VD的表达与DR发生密切相关,可能参与DR发生、发展,临床或可通过检测25-(OH)VD水平评估DR发生,为早期防治提供参考。
