PDGF-CC及CD147在三阴性乳腺癌中的表达及其对预后的影响
2021-01-15胡光富余燕民陆永伟叶曼娜李双双郭绍文
胡光富, 叶 辉, 汪 成, 单 鸣, 余燕民,陆永伟, 叶曼娜, 李双双, 郭绍文
(上海交通大学医学院附属第九人民医院黄浦分院, 1. 乳腺外科, 2. 病理科, 上海, 200011)
三阴性乳腺癌(TNBC)是指免疫组织化学指标中雌激素受体(ER)、孕激素受体(PR)、人类表皮生长因子受体2(HER-2)均为阴性的一类具有高度异质性的乳腺癌分子亚型[1]。TNBC的国际6分型[2]和复旦肿瘤4分型[3]均尝试TNBC亚型的再分类,以实现对不同TNBC亚型的预后评估和精准化治疗。然而,目前TNBC 缺乏内分泌治疗和抗HER-2靶向治疗,仍以细胞毒性化疗为主要治疗手段,总体治疗效果不佳,易发生耐药,患者预后较差[4]。探索针对TNBC的有效分子靶标和研发新型靶向药物是临床治疗TNBC的重要方向[5]。
本课题组前期研究[6]发现, CD147在TNBC组织中高表达,且其高表达率与临床病理特征、预后存在密切关系, CD147有望成为治疗TNBC的新靶点。血小板源性生长因子CC(PDGF-CC)是PDGF-C的同源二聚体, PDGF-C通过活化为PDGF-CC而发挥作用[7]。研究[8]发现, PDGF-CC在多种恶性肿瘤中高表达,其与恶性肿瘤的生长、发展密切相关。ROSWALL P等[9]报道PDGF-CC可能成为治疗TNBC的新靶点。JASSON S等[10]发现,高表达PDGF-CC患者的TNBC的5年远处转移复发风险增高。本课题组在前期研究的基础上,应用免疫组织化学方法检测TNBC肿瘤细胞中PDGF-CC的表达,分析PDGF-CC与临床病理特征、CD147表达的关系以及PDGF-CC、CD147对预后的影响,现报告如下。
1 资料与方法
1.1 一般资料
分析2009年6月—2010年6月在上海交通大学医学院附属第九人民医院黄浦分院乳腺外科(原上海市黄浦区中心医院乳腺外科)手术并经病理检查证实为TNBC的110例患者的资料,既往石蜡标本制作为组织芯片,并采用免疫组织化学法检测了CD147表达水平[6]。所有患者术前均未行新辅助治疗,病理类型均为非特殊类型浸润癌,排除大汗腺癌、腺样囊性癌、化生癌等其他类型TNBC。所有患者免疫组织化学法检测ER、PR、HER-2均为阴性; 对于免疫组织化学法检测HER-2为(+)或()的病例,FISH检测结果需为阴性。收集患者的患病年龄、肿瘤T分期、淋巴结N分期、病理组织学分级、免疫组织化学指标(Ki67、CD147)等资料。
免疫组织化学检测ER(克隆号: EP1)、PR(克隆号: PgR636)、HER-2(克隆号: 485)、Ki67(克隆号: MIB-1)的一抗均购自DAKO公司,均为单克隆即用型抗体。免疫组织化学检测CD147的一抗购自江苏太平洋美诺克生物药业有限公司,为HAb18G/CD147单抗。免疫组织化学检测PDGF-CC的一抗购自LSBIo公司(货号LS-B11979), 为兔来源的多克隆抗小鼠PDGF-CC。生存期的定义: 从手术时间至随访截止时间(末次随访时间为2020年6月29日),或者因乳腺癌复发、转移而导致死亡的日期也视为截止日期。
1.2 方法
选用既往免疫组织化学法检测过CD147表达水平的石蜡病理组织芯片。所有标本均经10%中性甲醛溶液固定,常规脱水、石蜡包埋, 4 μm厚连续切片,常规苏木精-伊红(H-E)染色。光学显微镜下观察组织病理学特点。免疫组织化学染色采用Envision法, DAB显色。免疫组织化学检测PDGF-CC时,采用0.01 mol/L PBS代替一抗作阴性对照,用已知阳性表达的乳腺癌组织作阳性对照。
1.3 免疫组织化学结果判定
由2位病理诊断医生采用双盲法分别观察并交换判断结果。光学显微镜下, PDGF-CC抗原阳性反应位于细胞浆中,表现为棕黄色均匀颗粒。PDGF-CC阳性及阴性信号判断标准: 棕褐色染色细胞数≥50%判定为强阳性(), 25%~<50%判定为中等阳性(), <25%判定为弱阳性(+), ≤5%判定为阴性(-)。强阳性和中等阳性定义为高表达,弱阳性和阴性定义为低表达。以上标准均随机选5个高倍视野(放大倍数400倍)进行计数。CD147阳性信号判断标准中的高表达和低表达定义与PDGF-CC相同[6]。Ki67阳性表达信号位于细胞核,棕褐色染色细胞数≥20%判定为高表达。病理组织学分级采用Scarff-Bloom-Richardson分级法,分为Ⅰ、Ⅱ、Ⅲ级。
1.4 统计学方法
采用SPSS 19.0软件进行统计学分析。PDGF-CC的表达与年龄、临床病理特征以及CD147表达水平的关系分析采用Mann-WhitneyU秩和检验。单因素生存分析采用Kaplan-Meier法,差异显著性检验采用时序检验(Log-rank), 生存多因素分析采用Cox比例风险模型。P<0.05为差异有统计学意义。
2 结 果
2.1 免疫组织化学染色结果
110例TNBC组织中, PDGF-CC阳性表达为103例(93.64%), 其中19例(17.27%)为强阳性,细胞浆中出现弥漫且非常强的染色; 57例(51.82%)为中等阳性; 27例(24.54%)为弱阳性,细胞浆中有较弱的表达; 7例(6.36%)为阴性,表达非常微弱或不表达。见图1。据此统计, PDGF-CC高表达为76例(69.09%), 低表达为34例(30.91%)。课题组前期研究[7]结果显示, 110例TNBC组织中CD147的强阳性、中等阳性、弱阳性和阴性表达分别为56例(50.91%)、22例(20.00%)、12例(10.91%)和20例(18.18%), CD147高表达为78例(70.91%), 低表达为32例(29.09%)。
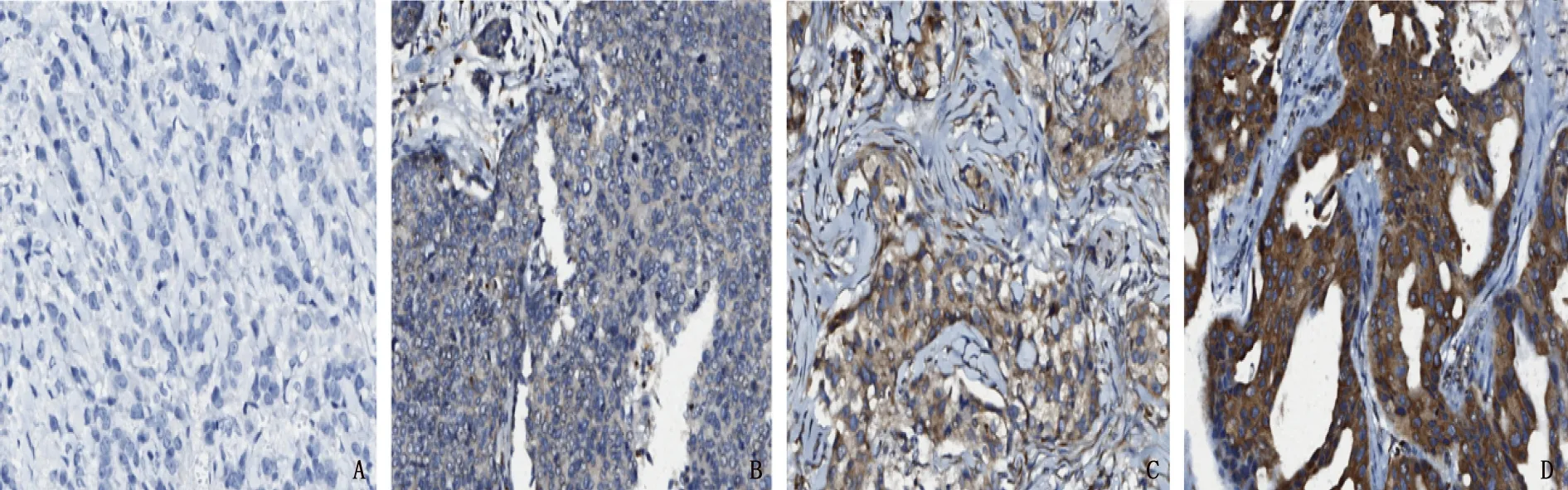
A: 强阳性; B: 中等阳性; C: 弱阳性; D: 阴性。
2.2 TNBC中PDGF-CC的表达与年龄、临床病理特征以及CD147表达水平的关系
PDGF-CC在TNBC组织中的表达水平与患者年龄(P=0.186)、肿瘤T分期(P=0.737)、淋巴结N分期(P=0.458)、病理组织学分级(P=0.994)和Ki67表达水平(P=0.352)均无相关性,但PDGF-CC表达水平与CD147表达水平呈显著正相关(P=0.001)。见表1。
2.3 PDGF-CC、CD147在TNBC组织中表达水平与生存率的关系
Kaplan-Meier生存分析结果显示, PDGF-CC、CD147在TNBC组织中的不同表达水平与无病生存率(DFS)和总生存率(OS)有关。与PDGF-CC低表达组相比, PDGF-CC高表达组患者DFS和OS更低,但差异无统计学意义(P=0.477、0.318); PDGF-CC和CD147均为低表达的患者DFS和OS最优,而PDGF-CC和CD147均为高表达的患者DFS和OS最差,但差异无统计学意义(P=0.883、0.768)。见图2。
2.4 Cox比例风险模型分析
将110例TNBC患者年龄、肿瘤T分期、淋巴结N分期、病理组织学分级、Ki67表达、CD147表达和PDGF-CC表达进行Cox模型多因素分析,结果显示, PDGF-CC表达与CD147表达不是影响TNBC患者OS的独立预后因素,而患者年龄和淋巴结N分期是影响TNBC患者OS的独立预后因素。见表2。
3 讨 论
TNBC是一种具有侵袭性及异质性的乳腺癌亚型。目前, TNBC的主要治疗方法仍是细胞毒性化疗。聚ADP核糖聚合酶(PARP)抑制剂奥拉帕利(olaparib)和他拉唑帕利(talazoparib)分别于2017年和2018年由美国食品药品监督管理局(FDA)批准用于治疗包括晚期TNBC在内的胚系BRCA1/2基因突变的转移性乳腺癌[11]。程序性死亡配体-1(PD-L1)抑制剂阿替利珠单抗(atezolizumab)于2019年由FDA批准用于治疗PD-L1阳性不可切除的局部晚期或转移性TNBC[12]。下一代测序(NGS)技术正在识别潜在的多个肿瘤分子靶点[13]。将TNBC的可靶向干预的基因突变及位点包括Akt、ERBB2、NTRK、免疫检查点等应用于临床,为TNBC患者带来新的转机[14]。
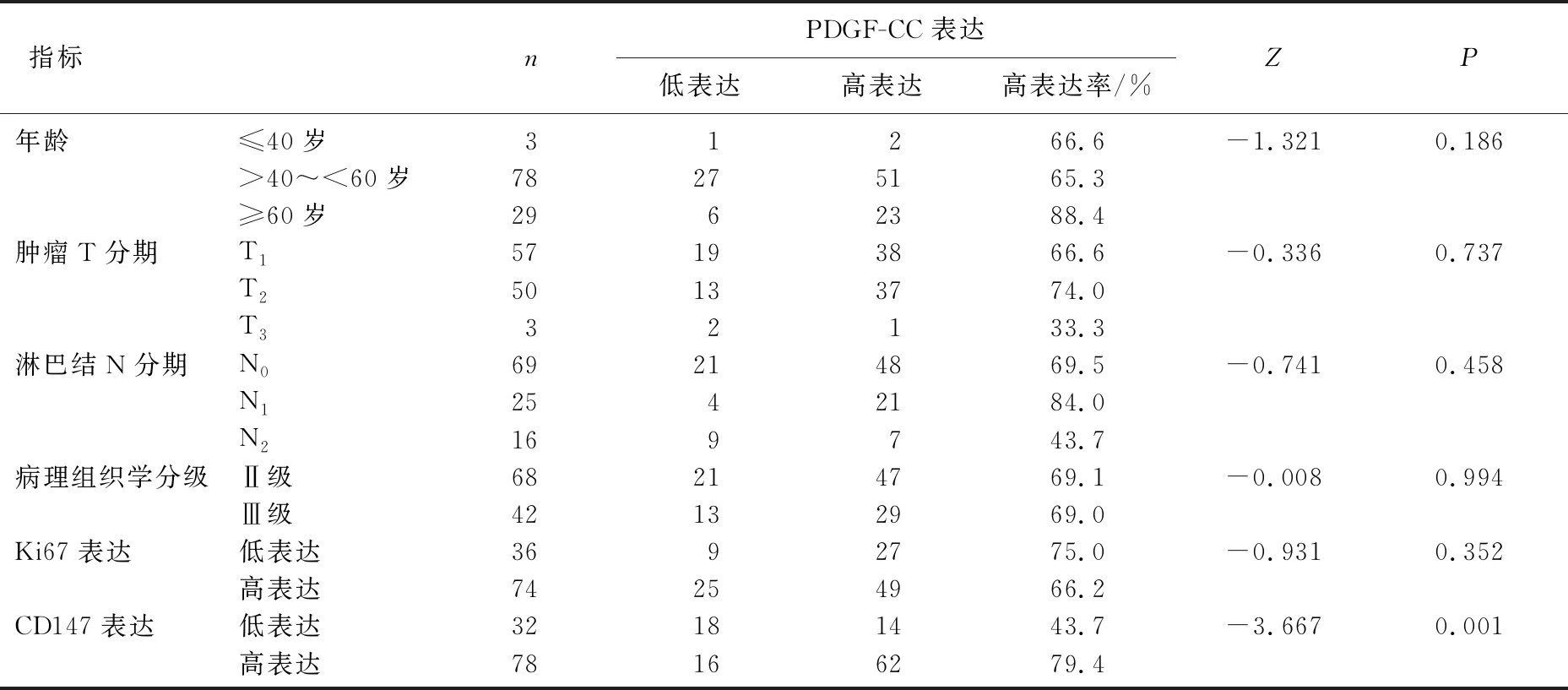
表1 TNBC组织中PDGF-CC的表达与病理特征、CD147的关系
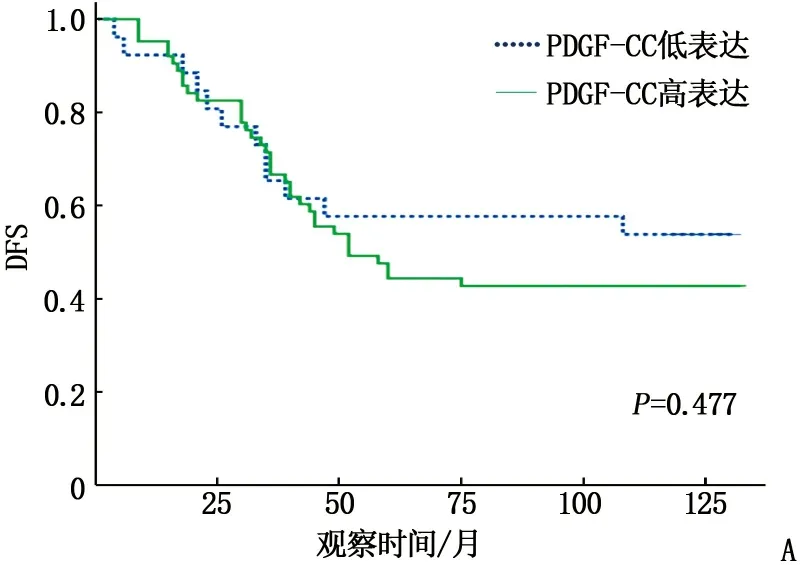
A: PDGF-CC低表达与高表达的DFS比较; B: PDGF-CC低表达与高表达的OS比较;C: PDGF-CC与CD147不同表达组合的DFS比较; D: PDGF-CC与CD147不同表达组合的OS比较。
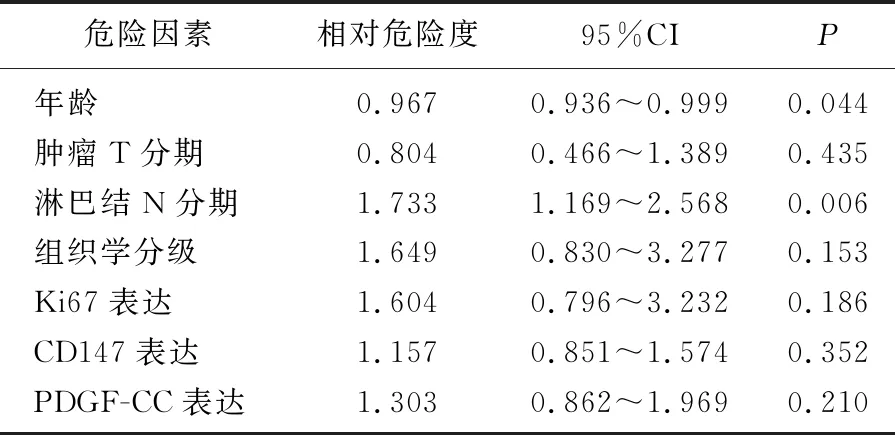
表2 110例TNBC患者预后因素的Cox模型多因素分析
PDGF家族成员包括PDGF-AA、PDGF-BB、PDGF-AB、PDGF-CC、PDGF-DD, 主要分布在细胞浆中,通过激活相应的血小板源性生长因子受体蛋白(PDGFR), 从而激活下游的酪氨酸激酶,在促进肿瘤血管的生成、促使肿瘤相关成纤维细胞(CAFs)相关基因发挥作用、诱导肿瘤发生转移等过程中发挥重要作用[15]。研究[16]表明, PDGF-CC在乳腺癌组织中的表达水平较非癌组织中的表达水平显著升高,其在乳腺癌的生物学行为中起着非常重要的作用。研究[9]报道, PDGF-CC在TNBC细胞与CAFs间充当“信使”角色。TNBC细胞旁分泌PDGF-CC作用于CAFs, CAFs再旁分泌多种因子反作用于TNBC细胞,使TNBC细胞衍生出不表达ER的肿瘤细胞。抗体靶向PDGF-CC阻断这一旁分泌机制,可使TNBC细胞衍生出高表达ER的肿瘤细胞,从而转变为对内分泌治疗敏感的Luminal型乳腺癌。
自2014年起,本课题组就开始研究CD147在TNBC中的表达及临床意义[17]。CD147也称细胞外基质金属蛋白酶诱导因子(EMMPRIN), 主要定位在细胞膜上。CD147是一种高度糖基化的跨膜糖蛋白,可诱导CAFs合成基质金属蛋白酶(MMPs), 降解基质和基底膜而促进肿瘤细胞的浸润和转移。本课题组前期研究[6]发现, TNBC标本中CD147表达率高达85.70%, 且其表达水平可以作为独立的预后判断因子。
既往研究[18]发现, PDGF-CC和CD147均可在TNBC中高表达,且两者分别主要定位在细胞浆和细胞膜上。因此,从细胞空间分布上而言,同时靶向PDGF-CC和CD147可能起到协调抑制TNBC细胞生长的作用,从而起到“双靶联合”效应。基于以上假设,本研究的创新点是首次探索PDGF-CC表达与CD147表达的关系及其对预后的影响。本研究结果显示, PDGF-CC表达与CD147表达呈正相关, PDGF-CC表达和CD147表达均与患者DFS和OS有关,即两者表达越高,患者生存率越差。本研究尚存不足,因本研究样本量相对较小、部分患者失访等原因,导致PDGF-CC表达和CD147表达对生存率的影响存在偏差,多元回归分析也并未显示PDGF-CC表达和CD147表达是独立的预判断因子。因此,未来应该进一步扩大样本量及完善随访数据,同时开展体外细胞功能实验,探索同时阻断TNBC细胞的PDGF-CC和CD147靶点的可行性和有效性。
