燕麦蛋白-结冷胶冷诱导凝胶微观结构与控释特性的关联性研究
2021-01-13杨晨袁哲闫可心胡海玥汪建明
杨晨,袁哲,闫可心,胡海玥,汪建明*
(1.天津科技大学食品科学与工程学院,天津 300457;2.优滋福(天津)食品科技有限公司,天津 300457)
燕麦中除了含有大量的β-葡聚糖,还含有丰富的蛋白质(12% ~24%)[1-2],其中球蛋白占总蛋白质含量的70% ~80%,主要由12S、7S和3S蛋白组成[3-4]。前期研究发现,燕麦蛋白(oat protein isolate,OPI)具有良好的凝胶特性[5]。加热变性后的燕麦蛋白六聚体解聚成活跃的单体,并且二级结构打开,提供了大量的交联点,在静电斥力逐渐降低的情况下可促使蛋白质单体有序排列,从而形成类似聚合物凝胶的网络结构[5-6]。燕麦蛋白这一凝胶结构和加热变性后的特性使其具有较好的凝胶硬度以及包埋、保护和控释营养素的能力[6-9]。但是燕麦蛋白凝胶在中性和弱酸性条件下的硬度较弱,在含有胰蛋白酶的模拟胃液中超过1 h,部分燕麦蛋白凝胶会降解,从而影响其在模拟消化液中的控释能力[7]。在蛋白质中添加多糖可制备不同微结构的凝胶,可有效增强蛋白凝胶的硬度,也可增强其作为载体保护功能性物质活性的能力。
Nieto等研究了在酸性和中性条件下菊粉、卡拉胶和糊精对热致燕麦蛋白凝胶结构和硬度的影响,发现在加热凝胶过程中,两种物质产生了相分离从而使多糖分散在燕麦蛋白凝胶的网络结构中,同时增加了凝胶内部蛋白质部分的浓度,从而增强了燕麦蛋白-多糖热致凝胶的硬度[10-11]。然而,加热条件会破坏热敏性生物活性物质,热凝胶作为营养物质递送体系有一定的局限性,冷诱导燕麦蛋白-多糖混合凝胶的特性还有待研究。
结冷胶(gellan gum,GG)因其凝胶性、透明性高,耐高温,在较宽的pH值条件下稳定性好,因此广泛应用于食品体系中以增强食品的质构和稳定性[12-14]。结冷胶与大豆蛋白和蛋清蛋白混合可改善蛋白质凝胶性和结构[15-16]。本研究的预试验中发现,热变性后的燕麦蛋白与结冷胶混合形成的凝胶具有较强的凝胶硬度和较好的性质,有望作为营养物质递送体系。本文通过葡糖酸-δ-内酯(glucono-delta-lactone,GDL)诱导凝胶(冷诱导)的方法,制备热变性后的燕麦蛋白-结冷胶共混凝胶,通过质构分析、扫描电镜、激光共聚焦显微镜、傅里叶红外光谱等方法,探究不同pH值对共混凝胶的结构、性质以及控释行为的影响,为燕麦蛋白-结冷胶共混凝胶体系应用在食品工业中提供理论支持。
1 材料与方法
1.1 材料与试剂
裸燕麦:加拿大曼尼托巴省;燕麦蛋白(OPI):加拿大阿尔伯塔大学农业、食品、营养系实验室提取[10],蛋白质含量为(90.4±0.6)%;结冷胶(纯度为99%,分子量500 kDa):河南华森食品添加剂有限公司;葡糖酸-δ-内酯(GDL):上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
傅里叶红外光谱仪(NICOLET IS50):德国Thermo Scientific公司;SU1510扫描电子显微镜(scanning electron microscopy,SEM):日本 Hitachi公司;激光扫描共焦显微镜(confocal):日本尼康公司;真空冷冻干燥(FD-1-50):北京博医康实验仪器有限公司;紫外可见分光光度计(Evolution300):Thermo Fisher Scientific公司;恒温磁力搅拌器(H05-1):天津东南仪诚科技有限公司;智能数显磁力加热控温搅拌器(TP-350S):杭州米欧仪器有限公司。
1.3 方法
1.3.1 燕麦蛋白-结冷胶(OPI-GG)冷诱导凝胶制备
OPI溶于水中并在室温25℃下搅拌过夜,用1 mol/L NaOH将溶液调节至pH 8。将OPI溶液密封在玻璃瓶中并在115℃(高于变性温度)油浴中加热15 min。随后冷却至室温25℃,加入不同浓度的GG(0%、0.05%、0.1%、0.15%、0.2%,基于蛋白质干重的质量分数),使得OPI的浓度为7 g/100 mL且保持每个样品有相同的总体积,并将不同量的GDL(20%,9%,4%,1.5%,基于蛋白质干重的质量分数)加入到溶液中,将溶液储存在4℃下24 h,形成不同pH值(4、5、6、7)的OPI-GG凝胶。
1.3.2 OPI-GG凝胶质构分析
OPI-GG凝胶制成相同的高度(18 mm)和直径(22 mm),确保表面和底面的平整,采用P/36R探头分析凝胶的硬度,测定参数为:测定前速度5 mm/s,测定速度2 mm/s,测后速度5 mm/s,应变位移60%,引发力5 g,引发类型为自动。
1.3.3 复合凝胶微观结构的观察
OPI-GG凝胶经液氮速冻后冻干,取自然冻干截面,经表面喷洒镀金后置于SEM下,观察不同条件处理后的凝胶微观形貌[7]。
用激光共聚焦观察OPI-GG凝胶内燕麦蛋白和结冷胶的分布。将0.54 g的GG和60 mL水混合,然后向混合物中加入10 mg异硫氰酸荧光素(fluorescein isothiocyanate,FITC),避光搅拌过夜后透析 12 h,冷冻干燥。罗丹明B用于OPI的非共价标记,首先制备蛋白质悬浮液30 mL,然后加入2 mg罗丹明B,混合物在室温25℃下避光搅拌过夜后透析12 h,冷冻干燥。将标记过的OPI与GG混合,制备凝胶,方法同1.3.1。将制备好的凝胶样品置于显微镜载玻片上,盖上薄片,并在488 nm和543 nm波长同时获得荧光图像[9]。
1.3.4 OPI-GG凝胶分子结构的测定
准确称量1 mg OPI-GG凝胶的冻干样品,加入150 mg充分干燥的KBr(其中溴化钾放在烘箱中105℃烘干超过8h),用研钵将其充分研磨至细末贴壁。使用压片机(108Pa)将混合粉末压制1 min成透明薄片,用红外光谱仪做全波段扫描(4 000 cm-1~400cm-1),分辨率为4 cm-1,扫描次数为16次,以空气为采集背景,样品红外光谱图经过傅立叶变换后利用OMNIC 8.2软件进行分析处理。
1.3.5 包埋核黄素的OPI-GG凝胶的控释行为的测定
OPI(7 g/100 mL)在115℃油浴中加热变性,冷却至室温25℃后加入核黄素(1%,基于蛋白质干重的质量分数)和不同浓度的GG,避光搅拌,制备凝胶(方法同1.3.1)。核黄素的包埋率通过紫外分光光度计测定,先将包埋核黄素的凝胶冻干,粉末溶于蒸馏水,搅拌过夜,6 000 g离心20 min,取上清液,稀释后,用紫外可见分光光度计445 nm波长下测定吸光度值,根据核黄素的标准曲线计算核黄素包埋量。核黄素包埋率通过以下公式计算:

式中:C0为包埋在凝胶中核黄素含量,mg,C1为核黄素总含量,mg。
将包埋核黄素的OPI-GG凝胶置于pH1.2磷酸缓冲溶液(phosphate buffer saline,PBS)(37℃)中 2 h后,再将凝胶转入中性PBS(pH7.4,37℃)8 h进行释放试验。每隔特定的时间取样,采样之后,补充等体积PBS,以保持恒定的体积。取出的液体离心(6 000 g,10 min)后用紫外可见分光光度计在445 nm波长下测量核黄素吸光值,通过标准曲线,计算其释放量(R1),在模拟肠液中释放8 h后,将剩余凝胶破碎,使核黄素充分溶出,离心取上清液稀释后用紫外分光光度计在445 nm处测量核黄素的吸光值,根据核黄素的标准曲线计算核黄素的量(R2),该值加上核黄素在模拟胃液2 h后释放的量(R0),即为核黄素的总量(Rt),核黄素的释放率/%=R1/Rt× 100。
2 结果与分析
2.1 pH值和GG浓度对OPI-GG凝胶硬度的影响
本研究通过质构分析,探究了不同GG浓度和pH值对OPI-GG凝胶硬度的影响,其结果如图1所示。
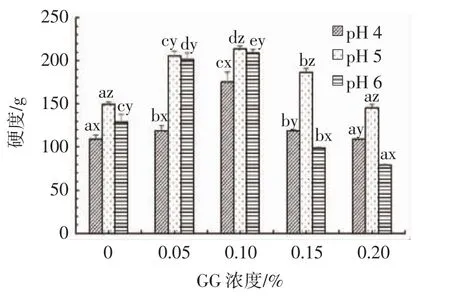
图1 pH值和GG浓度对OPI-GG凝胶硬度的影响Fig.1 Effect of pH and GG concentration on OPI-GG gel hardness
试验中发现,pH值为7时,OPI-GG凝胶透明且富有弹性,但由于凝胶硬度低于仪器检测下限,无法被检测。如图1所示,不同的pH值对OPI-GG凝胶硬度有显著影响(P<0.05),凝胶硬度呈现先上升后下降的趋势。在pH值为6时,OPI与GG的静电斥力降低,分子间的氢键和疏水基相互作用增强,凝胶硬度也随之增加[8]。当pH值等于OPI等电点(pH值为5)时,OPI与GG因为静电吸引力形成凝聚体,从而使OPI-GG凝胶硬度增强,此时凝胶硬度最大。当pH值为4时,凝胶硬度降低,由于pH值低于OPI等电点,OPI分子间带正电荷而产生静电斥力从而使网络结构溶胀。在GG浓度为0% ~0.10%时,不同的GG浓度对凝胶硬度也有显著影响(P<0.05),凝胶硬度随着GG浓度增加而增加,在GG浓度为0.1%时凝胶硬度达到最大值,随着GG添加量的继续增加,凝胶的硬度逐渐降低,其原因可能是过多的GG与OPI分子相互作用,阻碍了OPI分子间和分子内的相互作用从而不能形成坚固的凝胶三维网络结构[8,17],最终导致凝胶硬度减弱。凝胶硬度分析结果表明,GG添加量为0.1%、pH值为5时凝胶硬度最大,0.1%GG浓度被选为最优制备OPI-GG凝胶条件。
2.2 不同pH值对OPI-GG凝胶网络微结构的影响
扫描电子显微镜可直观地观察不同pH值条件下形成的OPI-GG凝胶的内部结构,如图2所示。

图2 不同pH值条件下OPI-GG凝胶扫描电子显微镜图Fig.2 SEM images of OPI-GG gel formed at different pH
从图2中可以看出,不同pH值条件下形成的OPIGG凝胶均具有类似聚合物的三维网络结构。OPI-GG在pH 5时的凝胶孔径最小,形成致密的三维网络结构。在此条件下,OPI与GG带相反电荷,分子间具有静电吸引力,同时OPI分子在预加热的条件下解聚和伸展,使功能基团暴露出来,有利于蛋白质和多糖之间的相互作用,GG与OPI通过相互作用形成均一稳定的蛋白质-多糖体系,因此,在pH值为5时,OPIGG凝胶具有最强的硬度。在pH值为6时,凝胶网络结构的孔径变大,此时OPI所带负电荷较少[8],与GG之间虽然存在静电斥力,但是由于OPI在预加热变性后功能基团暴露,其与GG之间可能仍因疏水基和氢键作用而相互结合,从而形成稳定的结构和较强的凝胶硬度。在pH值为4时,由于pH值远离OPI等电点,OPI-GG形成凝胶后,其网络结构随着pH值降低而吸水溶胀,内部孔径变大,因此凝胶硬度减弱[8]。同理,随着pH增加至7,远离OPI等电点,凝胶结构的孔径变大,凝胶孔壁变薄,OPI-GG凝胶的硬度变弱。有趣的是,在pH 6和pH 7的条件下,凝胶孔径虽然变大,但是内部均出现细丝连接的现象。在OPI等电点以上时,OPI-GG存在静电斥力可能产生相分离,在蛋白质分子和多糖分子凝聚的过程中,OPI和GG可能各自形成网络,从而形成双网络结构,导致凝胶孔内出现细丝网络结构。
OPI-GG凝胶中蛋白质的多糖在不同pH值条件下的分布情况可通过激光共聚焦显微镜进行观察,结果如图3所示。

图3 不同pH值条件下OPI-GG凝胶中的激光共聚焦显微镜图Fig.3 Effect of different pH on laser confocal microscopy of OPI-GG gel
由图3可知,在pH4条件下,加入GDL后,OPI-GG共混物在pH值快速降低的情况下迅速形成凝胶,OPI和GG在凝胶中的分布较均匀。pH 5接近OPI的等电点,OPI带有少量的正电荷,与GG相互作用力较弱,在pH值快速降低的情况下,OPI-GG形成蛋白质和多糖均匀分布的凝胶,其验证了SEM的观察结果,即在pH 4和5条件下,OPI-GG形成了致密的均匀的三维网络结构。在pH值为6或7时,随着凝胶网络的形成,交联的GG(白色虚线圈内)与OPI分开,嵌入在OPI连续的网络中,这是由于这个OPI与GG均带有负电荷,在缓慢凝胶过程中由于静电斥力而各自形成网络结构,从而形成相分离状态的凝胶双网络结构。从图3(pH 7,24 h)中可以看出,GG分布在OPI凝胶的连续网络结构内,证实了图2(pH 7)凝胶孔内的细丝是结冷胶在OPI连续的网络结构中形成的双网络结构。
2.3 OPI-GG凝胶分子构象变化
傅里叶红外光谱(Fourier transform infrared spectroscopy,FTIR)是常用的表征分子中化学键或官能团的信息的方法之一[18]。图4是OPI-GG凝胶在不同pH值下FTIR的吸收光谱图。
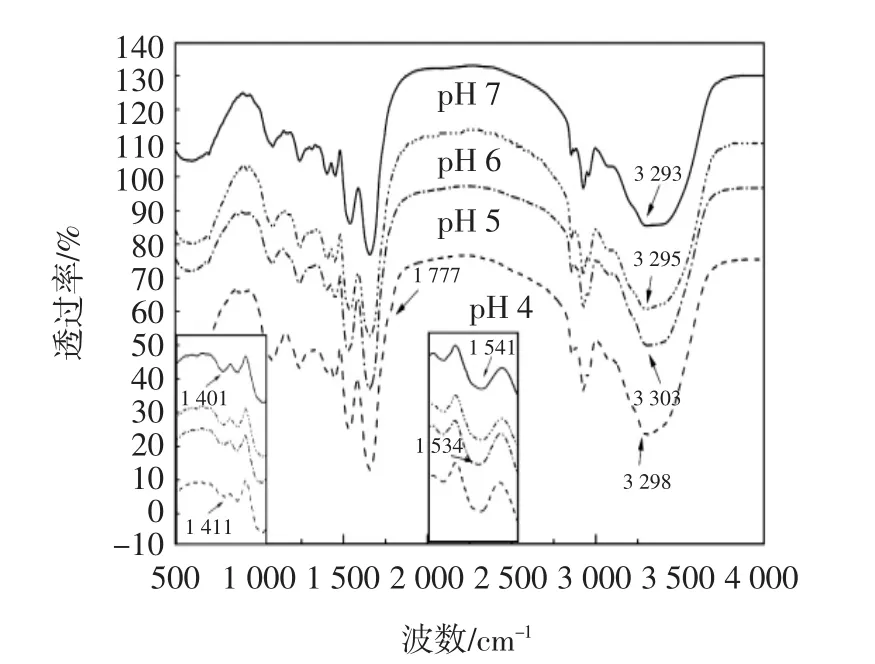
图4 不同pH值条件下OPI-GG凝胶FTIR图谱的变化Fig.4 FTIR image of OPI-GG gel formed at different pH value
如图4所示,随着pH值降低,在1 640 cm-1处的特征峰吸收硬度增强,OPI与GG之间的作用力逐渐增强。pH 4时,在1 777 cm-1处出现新的峰,代表羧基中C=O伸缩振动,另外,与pH 7条件下形成的凝胶相比,pH 4时形成的凝胶在3 298 cm-1处的特征峰比较尖锐,发生蓝移,-OH强吸收[19],证明分子间氢键作用增强,GG上乙酰基与OPI发生乙酰化反应,从而使微结构发生改变。pH 5时,-OH拉伸振动峰在3 303 cm-1变化明显,这是由于OPI与GG因静电吸引力而相互作用,OPI中的羟基/氨基与GG的羟基之间形成了较强的氢键[20],证实了在pH 5条件下形成的凝胶因较强的蛋白质与多糖相互作用力而具有较强的凝胶硬度。在pH7时,1411cm-1处-OH的特征峰红移到1401cm-1,吸收峰也增强,说明OPI-GG凝胶在pH 7时有氢键生成。然而,预试验中发现,在pH 7时,由于OPI和GG均带有负电荷,它们之间的相互作用力以疏水作用力为主(数据没有体现)。结合激光共聚焦和扫描电镜得到的pH 7下OPI-GG形成的双网络结构,其氢键的形成可能是由于GG自身交联而成。
2.4 pH值对负载核黄素的OPI-GG凝胶的包埋率和控释性能的影响
不同pH值的OPI-GG凝胶包埋核黄素的包埋率测试结果如图5所示。
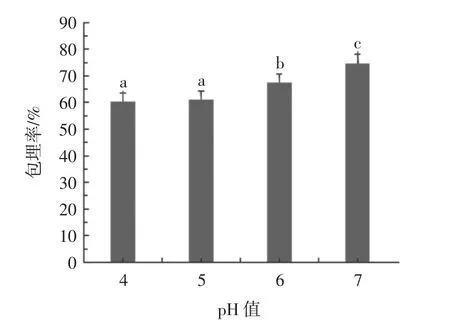
图5 不同pH值对OPI-GG凝胶包埋率的影响Fig.5 Effect of different pH on the encapsulation efficiency of OPI-GG gel
由图5可知,在pH 4和pH 5时,OPI-GG凝胶的包埋率略低,约61%,随着pH值升高至6和7,包埋率分别增加至67%和75%。在pH 6和pH 7条件下,OPI-GG凝胶由于静电斥力产生相分离,形成双网络结构,因此可有效阻止核黄素的溶出,提高凝胶的包埋率。
包埋核黄素的OPI-GG凝胶在PBS中的释放试验如图6所示。
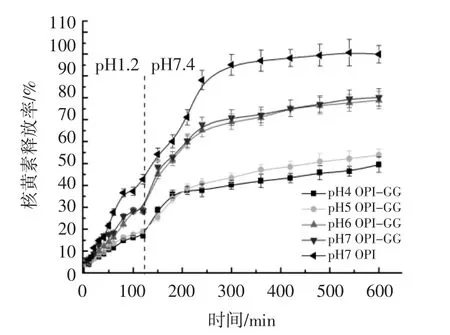
图6 包埋核黄素的OPI-GG凝胶在PBS(pH 1.2,pH 7.4)中的释放曲线图Fig.6 Release rate of riboflavin encapsulated in OPI-GG gels in PBS(pH 1.2,pH 7.4)
由图6可知,pH 7条件下不添加GG制备的OPI凝胶,在pH 1.2的酸性PBS中2 h时,核黄素的释放率为42%,加入0.1%的GG以后,在pH 1.2的PBS环境下2 h时释放率为33%,随着凝胶制备的pH值降低至5和4时,2 h的核黄素释放率降低至18%和16%。在pH 7.4的PBS中,不加GG的OPI凝胶3 h以后几乎释放全部核黄素。加入0.1%的GG后,在pH 7和pH 6条件下制备的凝胶核黄素的释放率明显,低于不加GG的凝胶。当凝胶pH值为4和5时,在pH7.4 PBS中浸泡8 h后,核黄素的释放率降低至49%和53%。
OPI-GG凝胶释放核黄素的机制与其结构和相互作用力有很大关系。在pH 4和pH 5时,SEM和FTIR的结果显示,相对于pH 6和pH 7形成的双网络结构凝胶,其凝胶壁的孔径较小,网络比较致密,而且凝胶的形成速度较快,OPI和GG形成更强的相互作用力,所以在pH 4和pH 5条件下形成的OPI-GG凝胶在pH 1.2的条件下受酸性环境的影响较小,可以控制核黄素的释放率在17%左右,在pH 7.4的条件下通过扩散缓慢释放核黄素。试验结果证明,具有双网络结构的OPI-GG凝胶具有较好的包埋能力,具有均匀致密的单网络结构的OPI-GG凝胶具有较好的控释能力,因此,OPI-GG凝胶具有作为营养素包埋和递送体系应用在食品工业中的潜力。
3 结论
本文通过GDL冷诱导制备OPI-GG凝胶,利用质构分析、扫描电镜、激光共聚焦、FTIR等方法研究不同制备条件下混合凝胶的硬度,以及不同pH值条件下凝胶微结构与控释特性之间的关联性。结果表明在GG添加量为0.1%pH 5条件下制备的凝胶硬度最大。凝胶硬度与凝胶结构和分子构象的变化有关,pH 4和pH 5时,由于静电引力的相互作用,OPI与GG之间相互作用力增强,OPI-GG凝胶形成致密的均匀的单网络结构。在pH 6和pH 7时,OPI与GG由于静电斥力的作用产生相分离,从而形成双网络结构。具有不同微结构的OPI-GG凝胶可作为基质包埋核黄素,研究结果表明,OPI-GG双网络结构凝胶的包埋率为75%,其在pH 1.2 PBS中2 h时释放核黄素33%;OPI-GG致密单网络结构凝胶的包埋率为61%,在pH 1.2 PBS中2 h时释放核黄素18%。本研究结果证明,在pH 6和pH 7条件下制备的OPI-GG双网络结构冷凝胶具有较好的核黄素包埋能力,在pH 4和pH 5条件下制备的具有均一致密结构的OPI-GG单网络冷凝胶具有较好的控释能力,具有不同微结构的OPI-GG冷凝胶可作为营养素包埋和递送体系,为其应用在食品中作为营养素载体提供理论基础。
