糖源蜜、花源蜜和市售蜂蜜品质的比较研究
2021-01-13董莹莹迟增钊迟玉森
董莹莹,迟增钊,迟玉森
(青岛农业大学食品科学与工程学院,山东 青岛 266109)
蜂蜜是由蜜蜂在离巢2.5 km以内有效范围的植物活体或植物活体分泌物中吸收含水量约为75%的花蜜或分泌物,存入到第二个胃中并与自身分泌物结合后存放在巢脾中,经过充分转化将花蜜中的多糖转变成人体可直接吸收的葡萄糖、果糖,同时将各种维生素、矿物质和氨基酸丰富到一定的数值,并脱水至水分含量少于23%时用蜂蜡密封,形成的一种天然的饱和糖溶液[1-2]。每年秋冬时节缺乏蜜源,或者有蜜源但天气不好(梅雨季节)的情况下,巢脾中的蜂蜜已经被蜜蜂吃完,大部分蜂农选择饲喂白糖而非蜂蜜,这是目前比较经济的越冬方式。越冬后蜂群很弱,饲喂白糖刺激蜂王产卵促使大的蜜源来临之前蜜蜂群体增强,此时产的蜜可被称为糖源蜜。
目前我国对糖源蜜和花源蜜的比较研究甚少。本文测定了糖源蜜和花源蜜的基本理化成分和活性成分,并与市售4类蜂蜜进行比较,研究蜜蜂通过采取不同的蜜源产出的糖源蜜和花源蜜的品质,为蜂业发展提供理论参考依据。
1 材料与方法
1.1 材料与试剂
样品来自青岛王氏蜜蜂园的蜂农自养蜜蜂在蜜源期产出的花源蜜和在秋冬无蜜源期喂糖水摇出的糖源蜜,以及选用青岛某超市销售的单价差距比较大的4类蜂蜜[黑蜂雪蜜(产地:吉林)、洋槐蜂蜜(产地:上海)、天然蜂蜜(产地:上海)、紫云英蜂蜜(产地:江西)(价格:黑蜂雪蜜>洋槐蜂蜜>天然蜂蜜>紫云英蜂蜜)]样品作为研究对象,蜂蜜的样品信息表见表1。

表1 蜂蜜样品信息表Table 1 Honey sample information table
所用主要试剂见表2。

表2 试验所用主要试剂Table 2 Main reagents used in the experiment
1.2 仪器与设备
试验所用仪器见表3。

表3 试验所用主要仪器Table 3 Main instruments used in the experiment
1.3 方法
1.3.1 蜂蜜样品的理化成分含量测定
1.3.1.1 蜂蜜样品水分含量测定
根据SN/T 0852—2012《进出口蜂蜜检验规程》提供的方法测定蜂蜜中的水分含量。
1.3.1.2 蜂蜜样品电导率的测定
准确称取蜂蜜样品10 g,用煮沸冷却后的蒸馏水,溶解在小烧杯中,定容至50 mL后,将小烧杯置于水浴锅中,25℃恒温水浴30 min,用电导率仪测定其电导率。每个样品按照相同方法测定3次,结果取平均值[3]。
1.3.1.3 蜂蜜样品色泽的测定
称取20 g蜂蜜样品于25 mL透明称量瓶,置于同一阴暗环境中,将便携式色差仪透光孔对准样品中心处,按下测量键读取所示参数,平行测量10次并记录所测的L值、a值和b值[4]。
1.3.1.4 蜂蜜样品中葡萄糖、果糖、麦芽糖和蔗糖含量的测定
根据GB 5009.8—2016《食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定》略加改进,使用色谱柱型号TSK G2500,进样量10 μL,流动相为2%氯化钠溶液,流速0.6 mL/min,柱温30℃,对蜂蜜样品进行含量测定。
1.3.1.5 蜂蜜样品pH值的测定
准确称取蜂蜜样品10 g,溶解在75 mL的蒸馏水中,通过磁力搅拌器充分搅拌,使样品溶液完全均匀后,用pH计测定。每个样品按照相同方法测定3次,结果取平均值[5]。
1.3.1.6 蜂蜜样品中游离酸和总酸度的测定
取10 g蜂蜜样品溶解在75 mL的蒸馏水中,搅拌均匀后用pH计测出蜂蜜溶液的pH值,用已标定的0.1 mol/L的氢氧化钠标准溶液匀速滴定。在pH 8.50时停止滴定,并快速加入10 mL氢氧化钠标准溶液,再用0.100 mol/L HCl返滴定到pH 8.30[6-7]。按下列算式计算。

式中:V1为滴定时NaOH标准溶液消耗的体积,mL;V2为空白试验中NaOH标准溶液消耗的体积,mL;V3为滴定时0.1 mol/L HCl溶液消耗的体积,mL;Xc为NaOH标准溶液的摩尔浓度,mol/L;m为样品的质量,g。
1.3.1.7 蜂蜜样品中蛋白质含量的测定
采用考马斯亮蓝法(牛血清蛋白作为对照)检测蜂蜜中蛋白质的含量[8]。准确称取100 mg考马斯亮蓝G-250,溶解于50 mL的95%乙醇中,加入100 mL浓度85%的磷酸,用蒸馏水定容至1 000 mL,过滤后置于棕色瓶中常温保存。以牛血清蛋白为标准品,配制100 μg/mL蛋白质标准液。分别精密吸取蛋白质标准溶液 0、0.1、0.2、0.4、0.6、0.8、1.0 mL 置于 7 支 10 mL 具塞试管中,加水补足至1 mL,加入5 mL考马斯亮蓝G-250溶液混匀,静置反应5 min后于595 nm处迅速测定其吸光度,绘制标准曲线。称取2 g(0.01 g)蜂蜜样品,用蒸馏水定容至10 mL,制成待测样品溶液。吸取蜂蜜溶液1 mL于试管中,重复上述操作,测出样品的吸光度。将所测样品吸光值代入标准曲线,计算其蛋白质含量,以mg/100 g表示。
1.3.2 蜂蜜样品的活性成分含量测定
1.3.2.1 蜂蜜样品中矿物质成分的测定
利用火焰原子吸收法测定蜂蜜样品中Ca、Mg、Zn、Fe元素含量[9]。分别称取蜂蜜样品,洋槐蜂蜜3.163 3 g、天然蜂蜜3.083 9 g、黑蜂雪蜜3.330 0 g、紫云英蜂蜜2.992 8 g、花源蜜3.162 5 g、糖源蜜3.263 7 g于消化管中,于各样品中加入15 mL浓硝酸浸泡15 h。浸泡之后再于消化管中加入4 mL的高氯酸,安装好消化装置后,将消化管置于消化炉中进行消解,液体呈蓝绿色或无色透明后停止加热。待消化液冷却以后,将其全部分别转移至50 mL容量瓶中,加双蒸水定容摇匀后,于0.22 μm水相膜过滤备用。同时制备两份平行的空白对照溶液,消解待测。
打开原子吸收分光光度计仪器后,调节和预热30 min,分别在测定每个元素时,安装好空心阴极灯,准确测定标准系列溶液中的Ca、Mg、Zn、Fe元素的含量。选择最佳工作条件,准确测定蜂蜜样品中元素的含量。试验获得线性回归方程及相关系数和工作曲线图。
1.3.2.2 蜂蜜样品淀粉酶活性的测定
依据GB/T 18932.16—2003《蜂蜜中淀粉酶值的测定方法》的测定方法,对6种样品进行淀粉酶的测定。
1.3.2.3 蜂蜜样品中总酚酸含量的测定
采用曹炜等的Folin-Ciocalteu比色法[10]。准确吸取没食子酸标准贮备液(2.0 mg/mL)配制成0、0.04、0.08、0.12、0.16、0.2、0.24、0.28 mg/mL 的溶液后待测。称取2 g(0.01 g)蜂蜜样品,用蒸馏水定容至10 mL,制成待测样品溶液。分别取各浓度没食子酸上清液0.5 mL和蜂蜜样品1 mL与2.5 mL 0.2 mol/L福林酚溶液混匀后静置5 min,加入100 g/L的碳酸钠溶液2 mL,定容至10 mL,在避光条件25℃水浴反应1.5 h后,以空白试剂为空白对照,在765 nm下测定吸光度值。以没食子酸含量(mg/mL)为横坐标,OD值为纵坐标绘制标准曲线,结果测量3次。
1.3.2.4 蜂蜜样品中总黄酮含量的测定
参考鞠爱华等测量黄酮含量的方法,进行改动[11]。将120℃干燥恒重的芦丁标准品制成0.2 mg/mL的芦丁标准溶液,稀释成 0、40、80、120、160、200 μg/mL 的溶液,各取l mL于试管中,各加l mL 70%的乙醇溶液,再精确加入5%的NaNO2溶液0.5 mL,摇匀,放置6 min后,加入10%的Al(NO3)3溶液0.5 mL,摇匀,放置6 min后,加入1 mol/L的NaOH溶液2 mL,摇匀,放置15 min。以零管为空白,在410 nm处测定吸光度。以芦丁含量(mg/mL)为横坐标,OD值为纵坐标绘制标mL,制成待测样品溶液。取1 mL稀释后的蜂蜜溶液,以试剂空白溶液(70%乙醇溶液取代蜂蜜溶液)调整零点,在波长410 nm处测样品的吸光度。从标准曲线上查出或用回归方程计算出样品溶液中总黄酮的含量。
1.4 数据处理
所有试验(除色泽测定进行10次外)均进行3个重复,使用Microsoft office 2010和SPSS软件进行数据统计分析,Origin 9.0软件作图。
2 结果与分析
2.1 蜂蜜样品水分含量的测定结果
蜂蜜样品水分含量的测定结果见表4。
水分含量常常作为蜂蜜成熟度的重要指标,蜂蜜的水分含量主要和蜂蜜种类、产地情况、储存条件等因素有关。成熟蜂蜜的水分一般低于20%[12]。因此,GH/T 18796—2012《蜂蜜》中强制性理化要求其他类(除荔枝蜂蜜、龙眼蜂蜜、柑橘蜂蜜、鹅掌柴蜂蜜、乌桕蜂蜜)二级蜂蜜的水分含量不高于24%[5]。所测的蜂蜜样品的水分含量范围是15.25% ~17.66%,符合标准。

表4 6种蜂蜜样品的水分含量Table 4 Moisture content of six honey samples
2.2 蜂蜜样品电导率的测定结果
蜂蜜样品电导率的测定结果见表5。
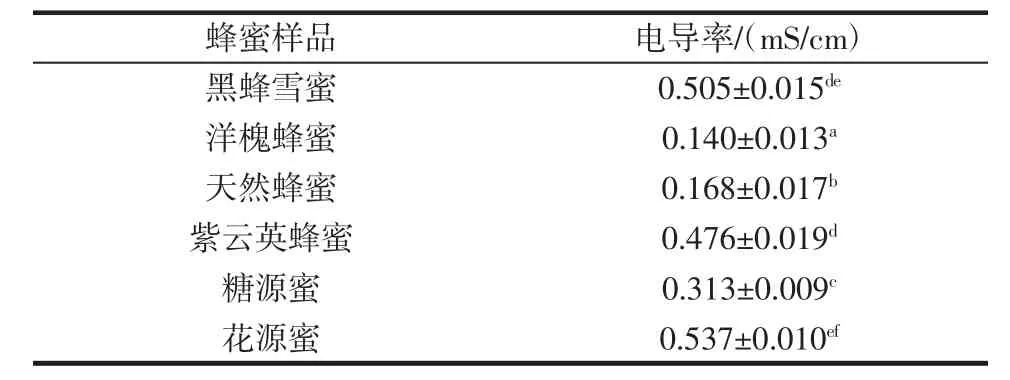
表5 6种蜂蜜样品的电导率Table 5 Conductivity of six honey samples
蜂蜜的电导率不同主要是由于植物蜜源不同引起的,与蜂蜜中的蛋白质、有机酸和矿物元素含量相关,食品法典委员会(Codex Alimentarius Commission,CAC)和欧盟(European Union,EU)规定蜂蜜的电导率值小于0.8 mS/cm。本试验中所测蜂蜜样品的电导率值在0.140 mS/cm ~0.537 mS/cm之间,符合CAC和EU的标准。
2.3 蜂蜜样品pH值的测定结果
蜂蜜样品pH值的测定结果见表6。

表6 6种蜂蜜样品的pH值Table 6 pH values of six honey samples
由于蜂蜜中含有游离酸和内酯酸等多种酸类物质,蜂蜜的pH值呈酸性,且其含量越高,蜂蜜的pH值越低。此外,蜂蜜的pH值也会受矿物元素含量、蜂蜜的采集和贮存过程影响。蜂蜜的pH值又影响着蜂蜜的货架期。本试验测得蜂蜜的pH值为3.73 ~4.54,表明不同种类的蜂蜜pH值有所不同。
2.4 蜂蜜样品中游离酸及总酸度的测定结果
蜂蜜样品中游离酸及总酸度的测定结果见表7。
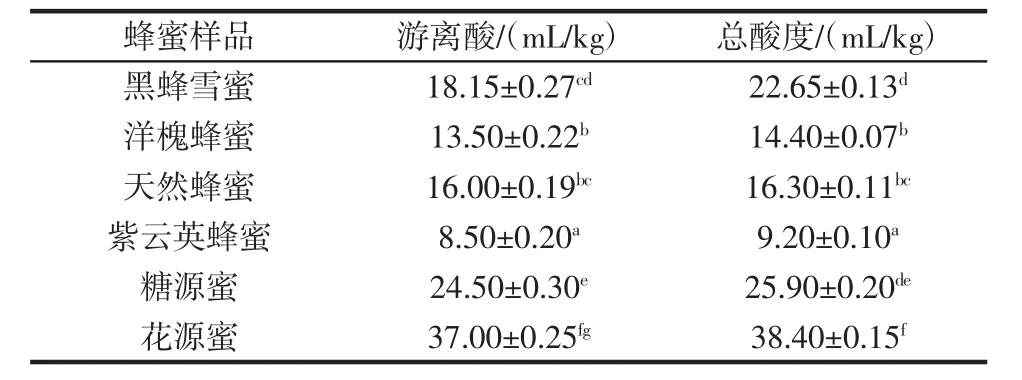
表7 6种蜂蜜样品的游离酸及总酸度Table 7 Free acid and total acidity of six honey samples
蜂蜜中葡萄糖在蜂蜜发酵过程中的氧化产物是蜂蜜中酸类物质的主要来源,可指示蜂蜜有无发酵现象,故蜂蜜的酸度可以用来衡量蜂蜜成熟程度和新鲜程度[13-14],游离酸含量也用来评价蜂蜜样品有无过度发酵。本试验所测蜂蜜的游离酸含量为8.50 mL/kg ~37.00 mL/kg。符合食品法典委员会(CAC)和欧盟(EU)规定的游离酸(1 mol/L氢氧化钠)含量≤50 mL/kg。这表明蜂蜜样品均没有出现过度发酵。
2.5 蜂蜜样品中蛋白质含量的测定结果
蜂蜜样品中蛋白质含量的测定结果见表8。

表8 6种蜂蜜样品的蛋白质含量Table 8 Protein content of six honey samples
蜂蜜中蛋白质含量通常不高于5 g/kg,约占蜂蜜总质量的0.1% ~0.5%。不同种类的蜂蜜蛋白质含量受蜜源植物的影响差异明显,因此可作为蜂蜜掺假鉴定和追溯源头的依据[15-16]。蜂蜜样品中蛋白质含量6.90 mg/100 g ~41.71 mg/100 g。说明不同种类的蜂蜜因蜜源植物的不同会影响到蜂蜜的蛋白质含量。
2.6 蜂蜜样品中色泽的测定结果
蜂蜜的颜色一般取决于蜜源植物的种类,后续的加工过程和储存条件也会对其有一定的影响[17-18],蜂蜜的颜色一般是从水白色到深琥珀色不同,用色差仪进行测定。L、a、b是代表物体颜色的色度值,其中L代表明暗度(黑白),a代表红绿色,b代表黄蓝色。L+表示偏亮,L-表示偏暗,a+表示偏红,a-表示偏绿,b+表示偏黄,b-表示偏蓝。有研究以L值50为界限,低于50则认为蜂蜜为浅色蜜[19]。结果如图1。6种蜂蜜都属于浅色蜜,除花源蜜和紫云英蜂蜜偏红外,其他蜂蜜偏绿色。
2.7 蜂蜜样品中果糖、葡萄糖及蔗糖含量的测定结果
6种蜂蜜样品的4种糖含量结果见表9。
碳水化合物是蜂蜜中含量最多的物质,包括单糖、双糖和低聚糖等。其中果糖和葡萄糖占总糖的85% ~95%。果糖和葡萄糖含量常被用来评价蜂蜜质量的基础指标。因此,GB 14963—2011《食品安全国家标准蜂蜜》要求规定中蜂蜜的果糖和葡萄糖含量不低于60%。本试验测得蜂蜜样品的葡萄糖含量均高于60%,符合国家标准。在蜂蜜酿造过程中,可以被蔗糖转化酶转化为果糖和葡萄糖,因此蔗糖含量可以评价蜂蜜成熟程度和新鲜程度,蔗糖含量越高,表明成熟度越低。GB 14963—2011《食品安全国家标准蜂蜜》中规定蜂蜜的蔗糖含量不高于5%。本试验测定的蜂蜜样品的蔗糖含量均低于5%,符合国家标准。

图1 蜂蜜样品的色泽Fig.1 The color of the honey sample
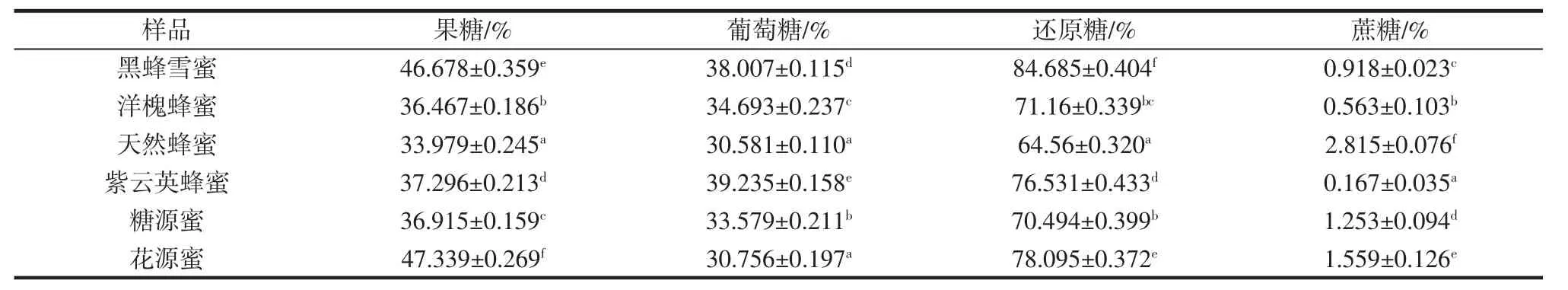
表9 6种蜂蜜样品的4种糖含量Table 9 Four sugar contents of six honey samples
2.8 蜂蜜样品的矿物质含量
Ca、Mg、Fe、Zn 的标准曲线见图 2。

图2 Ca(a)、Mg(b)、Fe(c)、Zn(d)的标准曲线Fig.2 Standard curve of Ca(a),Mg(b),Fe(c),Zn(d)
蜂蜜中的矿物质含量占蜂蜜的0.03% ~0.09%,包括 Na、K、Ca、Mg、P、S、Cl、Al、Cu、Zn、Mn、Fe 等 54 种元素,种类和含量取决于花蜜的植物和地理来源[20 ~22]。蜂蜜样品的6种蜂蜜样品的矿物质元素含量的测定结果见表10。
如表 10 所示,Ca的含量较高,Mg、Zn、Fe的含量较少,且不同的蜂蜜种类所表现的矿物质元素含量有较大的区别。

表10 6种蜂蜜样品的矿物质含量Table 10 Mineral content of six honey samples
2.9 蜂蜜样品的淀粉酶活性
蜂蜜中包含多种酶类成分,其中蜂蜜中的淀粉酶是蜜蜂在酿造蜂蜜过程中掺入的唾液中所含有的生物酶,能够转化蜂蜜中含有的淀粉,其稳定性较差。因此蜂蜜中淀粉酶活性是评价蜂蜜新鲜度的重要指标。GH/T 18796—2012《蜂蜜》中规定其他类(除荔枝蜂蜜、龙眼蜂蜜、柑橘蜂蜜、鹅掌柴蜂蜜、乌桕蜂蜜)二级蜂蜜的淀粉酶值不低于8 mL/(g·h)。6种蜂密样品的淀粉酶活性见表11。

表11 6种蜂蜜样品的淀粉酶活性Table 11 Amylase activity of six honey samples
本试验测定蜂蜜样品的淀粉酶值为3.96mL/(g·h) ~26.20 mL/(g·h),紫云英蜂蜜未符合我国供销合作总社的行业推荐标准。
2.10 蜂蜜样品的总酚酸和总黄酮的含量
蜂蜜中的多酚类物质主要来源于植物的花粉,包括类黄酮和酚酸类物质,可作为蜂蜜的溯源依据。如Bertoncelj等比较并测定了合欢蜜、冷杉蜜等的总酚含量,差异大可能与蜜源有关[23];Lachman和Ferreres等研究了石楠蜜中的黄酮类物质,可以用来判断它的植物来源[24-25]。6种蜂蜜样品的多酚含量见表12。

表12 6种蜂蜜样品的多酚含量Table 12 Polyphenol content of six honey samples
由表12可知,糖源蜜的酚酸类物质要高于天然蜂蜜、洋槐蜂蜜,接近于黑蜂雪蜜的含量,这可能与蜂蜜的产地等多种因素有关系。
3 结论
本研究主要测定了6种蜂蜜样品的理化成分和活性成分的含量,包括水分含量、电导率值、色度、果糖、葡萄糖、蔗糖、蛋白质含量、pH值、游离酸和总酸含量以及淀粉酶活性、矿物质含量、总酚酸含量、总黄酮含量。由表4 ~表6的结果可知,糖源蜜、花源蜜以及市售4类蜂蜜的基本理化成分含量均符合我国国家标准,表明这6种蜂蜜均为新鲜蜂蜜以及来自不同的蜜源;活性成分含量测定时,除紫云英蜂蜜的淀粉酶活性没有达到8 mL/(g·h),不符合标准外,其他蜂蜜均符合,价格最低的紫云英蜂蜜活性未达到要求,可能是因为加工过程不规范使酶失活或是掺入了其他物质。糖源蜜的酶活性介于洋槐蜂蜜和天然蜂蜜之间,且更接近于天然蜂蜜;花源蜜的酶活性远远高于黑蜂雪蜜,这说明饲喂糖水的蜂蜜,经发酵后,虽然活性达不到花源蜜的活性,但比市面上一般的蜂蜜质量好得多。此外,蜂蜜矿物质、总酚酸、总黄酮的含量因蜜源不同存在很大的差异。由结果可知,初步探究糖源蜜的质量良好,为我国糖源蜜品质测定提供理论依据。
