河源市新生儿α-珠蛋白生成障碍性贫血筛查及基因型分析*
2021-01-13刘运华刘晓燕李登峰曾庆林
刘运华,刘晓燕,张 旻,李登峰,曾庆林
广东省河源市妇幼保健院医学遗传实验室,广东河源 517000
珠蛋白生成障碍性贫血是由一种或多种珠蛋白肽链合成受阻或抑制,导致血红蛋白(Hb)组分异常,从而引起的溶血性贫血,是一种遗传性溶血性疾病[1]。依肽链合成缺陷的差异,把珠蛋白生成障碍性贫血分为α、β、γ及δ 4种类型,α与β是主要的2种类型。不同国家发病率大约在1%~10%,在地中海地区的某些国家发病率高达10%[2]。我国长江以南大部分地区,尤其是广东、广西及海南地区是α-珠蛋白生成障碍性贫血的高发区[3]。依临床症状的差异将α-珠蛋白生成障碍性贫血划分为重、中、轻及静止4种类型。中重度α-珠蛋白生成障碍性贫血婴儿的出生给家庭和社会带来了沉重的负担。由于此类疾病无有效的治疗方法,产前筛查与诊断是有效阻止此类重型疾病胎儿出生的有效手段[4],故开展α-珠蛋白生成障碍性贫血普遍筛查对预防出生缺陷有较好的临床价值。检测新生儿期Hb Bart′s水平可作为α-珠蛋白生成障碍性贫血筛查和临床早期诊断的敏感指标[5-6]。2015年3月起,河源市新生儿疾病筛查中心开始筛查新生儿珠蛋白生成障碍性贫血。为分析河源市新生儿α-珠蛋白生成障碍性贫血筛查结果与Hb Bart′s筛查α-珠蛋白生成障碍性贫血的临床价值,探索本地区新生儿α-珠蛋白生成障碍性贫血基因型分布特征,本研究对2015年3月至2019年10月的新生儿α-珠蛋白生成障碍性贫血的筛查结果与基因型分布特征进行分析,现报道如下。
1 资料与方法
1.1一般资料 筛查标本为2015年3月至2019年10月来自河源市五县二区的新生儿足跟血干血斑,共160 370例,其中男84 983例,女74 293例,性别未知1 094例。202例随机对照标本为来自全市五县二区的新生儿足跟血干血斑,新生儿中男119例,女83例;筛查与基因诊断均分两批次与常规标本一起进行试验。在知情同意条件下,严格遵循采血流程,于分娩后72~168 h采集新生儿足跟血3~4滴,将黄豆般大小的血滴在不接触皮肤情况下慢慢渗过滤纸片;标本要求直径≥8 mm,避免在紫外线或太阳照射的条件下晾干3~4 h后,密封保存于4 ℃冰箱。标本用快递寄送至本中心,收到标本后5个工作日内采用全自动毛细管电泳仪进行筛查,及时召回初筛阳性个体检测珠蛋白生成障碍性贫血基因。
1.2仪器与试剂 全自动毛细管电泳仪Capillarys2与进口配套Hb电泳试剂盒(含溶血素、冲洗液、缓冲液等)均购自法国Sebia公司;DNA自动提取仪Lab-Aid 824及配套试剂盒购自厦门致善公司;PCR扩增仪与电泳仪购自美国Bio-Rad公司;分子杂交仪ZWY-200D购自上海智城公司;珠蛋白生成障碍性贫血基因诊断试剂盒与耗材购自深圳亚能公司。
1.3方法
1.3.1Hb电泳 每例标本打下1个直径为3.5 mm干血斑放入样品杯,用移液器加纯净水50 μL每杯,封好样品杯并移进湿盒,于4 ℃冰箱浸泡2 h以上或过夜,充分洗脱干血斑中红细胞,以待上机电泳。运用全自动毛细管电泳仪进行检测,操作步骤如下:读取样品架条形码、溶血素稀释标本、清洗样品针、清洗毛细管、标本注入毛细管、电泳、分析各Hb成分的浓度,含正常HbF、HbA和Hb变异体(S、C、E、D与Hb Bart′s),HbA2带和部分Hb Bart′s带由人工判读。
1.3.2基因检测 及时召回筛查阳性新生儿(检出Hb Bart′s带)重新采血,检测珠蛋白生成障碍性贫血基因;(--SEA、-α4.2、-α3.7)等缺失突变与αT(CS、QS、WS)3种点突变及17种β-珠蛋白生成障碍性贫血基因[CD41-42(-TTCT)、CD43(G>T)、IVS-Ⅱ-654(C>T)、-29(A>G)、-28(A>G)、CD 71-72(+A)、CD17(A>T)、CD26(G>A)、-30(T>C)、-32(C>A)、CAP(-AAAC)、Int(T>G)、CD14-15(+G)、CD27/28(+C)、CD31(-C)、IVS-Ⅰ-1(G>T)、IVS-Ⅰ-5(G>C)],分别运用跨越断裂点聚合酶链反应与反向斑点杂交法检测。
1.3.3质量控制 室内质量控制:(1)Hb电泳,每批次试验均有第三方质控物,与普通标本一样的操作流程。(2)基因检测,每批次试验均进行空白对照、阴性对照、阳性对照(包括主要的缺失或突变类型);Hb电泳与基因检测的分析前、中、后均严格按照标准操作流程进行。室间质评:珠蛋白生成障碍性贫血基因检测参加广东省临床检验中心与国家临床检验中心的室间质评,均满分通过。
1.3.4结果判读标准 α-珠蛋白生成障碍性贫血初筛阳性判读标准:如果电泳结果读到Hb Bart′s带,就可判读为α-珠蛋白生成障碍性贫血初筛阳性。基因诊断判读标准:根据试剂厂家提供的判读标准。

2 结 果
2.1筛查与基因检测结果 筛查160 370例标本,检出Hb Bart′s带标本16 804例,筛查阳性率为10.48%。召回本院分娩的1 348例α-珠蛋白生成障碍性贫血初筛阳性新生儿,确诊α-珠蛋白生成障碍性贫血患儿1 271例,诊断符合率为94.29%。共检出基因型别27种,静止型5种,标准型5种,中间型5种,α合并β-珠蛋白生成障碍性贫血12种。1 271例α-珠蛋白生成障碍性贫血新生儿中,静止型占27.93%(355/1 271),基因型以-α3.7/αα与-α4.2/αα为主;标准型占67.82%(862/1 271),基因型以--SEA/αα为主;中间型占2.05%(26/1 271),基因型以--SEA/-α3.7为主;α合并β珠蛋白生成障碍性贫血占2.20%(28/1 271),基因型以(--SEA/αα)/(βCD41-42/βN)和(--SEA/αα)/(βIVS-Ⅱ-654/βN)为主。见表1。
2.2Hb Bart′s水平与临床表型的关系 α-珠蛋白生成障碍性贫血静止型355例,Hb Bart′s水平为0.34±0.11,标准型862例,Hb Bart′s水平为2.08±0.78,中间型26例,Hb Bart′s水平为10.60±3.37,Hb Bart′s水平随临床表型的加重而逐步增高,3种临床表型Hb Bart′s水平比较,差异有统计学意义(F=2 145,P<0.05)。
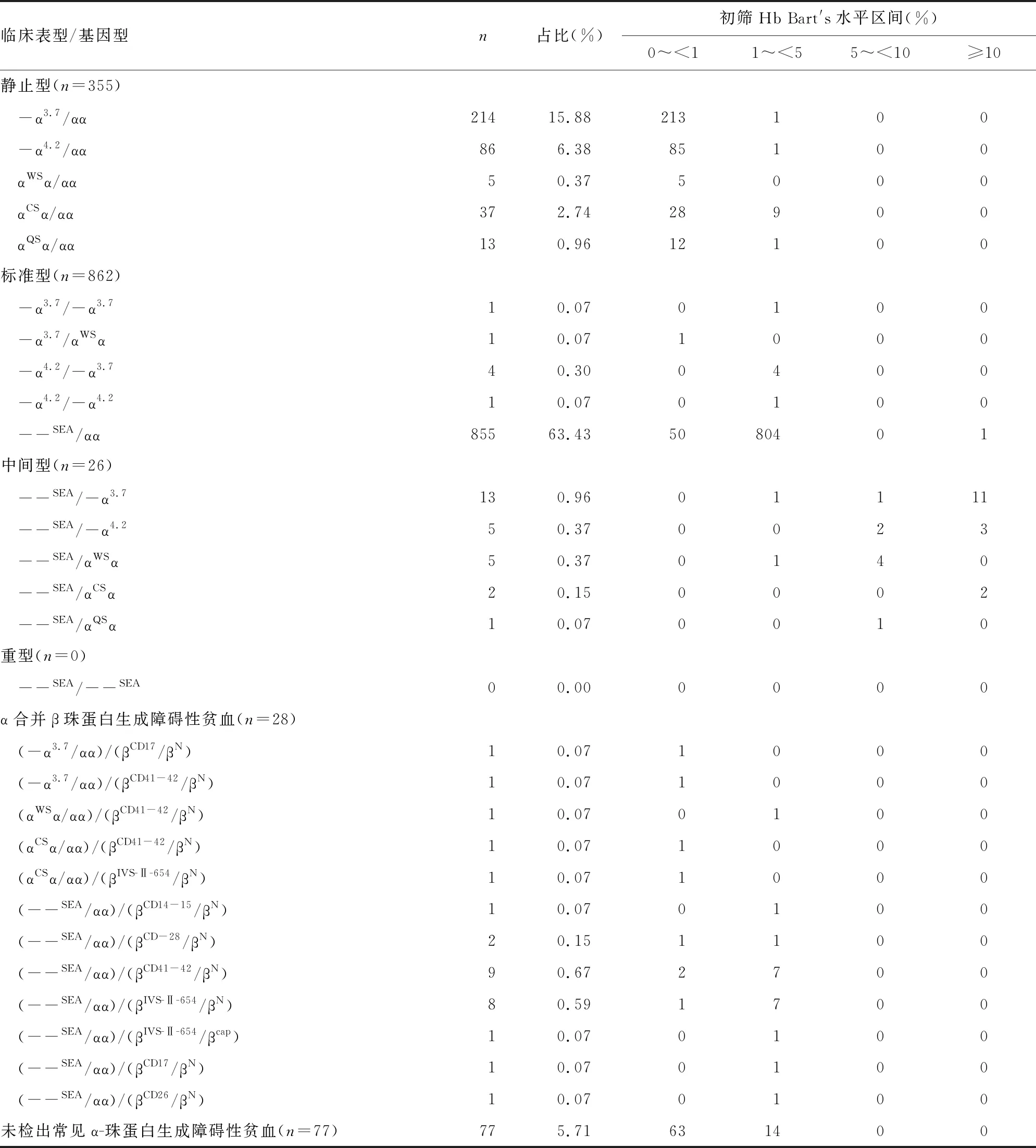
表1 筛查与基因检测结果
2.3202例新生儿足跟血四格表分析结果 随机同时检测202例标本的Hb Bart′s水平、3种缺失突变和3种非缺失突变的α-珠蛋白生成障碍性贫血基因。阳性符合率为91.89%,95%置信区间为78.70%~97.21%;阴性符合率为99.39%,95%置信区间为96.65%~99.89%;总符合率为98.02%,95%置信区间为95.02%~99.23%。另外,未检出Hb Bart′s带167例(确诊2例-α3.7/αα、1例αWSα/αα珠蛋白生成障碍性贫血)。见表2。

表2 202例新生儿足跟血四格表分析结果(n)
3 讨 论
缺失型α-珠蛋白生成障碍性贫血以--SEA/αα、-α4.2/αα和-α3.7/αα 3种基因型较为普遍。常见非缺失型突变α-珠蛋白生成障碍性贫血有HbCS、HbQS与HbWS,是发生在α2-珠蛋白基因或其调节序列上的点突变,影响mRNA的加工、翻译及翻译后肽链稳定性等过程[7-9]。珠蛋白生成障碍性贫血是目前世界上发病率最高的单基因遗传病,据世界卫生组织统计,全世界约有18亿人携带珠蛋白生成障碍性贫血基因,每年约有20万以上各类重症珠蛋白生成障碍性贫血新生儿出生[10]。
广东省的珠蛋白生成障碍性贫血携带率仅次于广西壮族自治区,主要类型是α-珠蛋白生成障碍性贫血、β-珠蛋白生成障碍性贫血[3]。因此,普遍开展人群α-珠蛋白生成障碍性贫血筛查对广东省出生缺陷防控项目有重大战略意义。目前,能最终诊断α-珠蛋白生成障碍性贫血的试验依据是分子水平的基因检测,但其成本及技术要求相对较高,致使其不能成为α-珠蛋白生成障碍性贫血普遍筛查的常规方法。临床上用于α-珠蛋白生成障碍性贫血筛查的常规技术有血常规检查联合红细胞脆性试验、Hb电泳法、高效液相色谱法。因血常规检查联合红细胞脆性试验筛查α-珠蛋白生成障碍性贫血有较高的漏检率,所以不可单独运用。同时,技术要求高、干扰因素较多及成本高的高效液相色谱法也不能开展普遍筛查。故当前国内运用于α-珠蛋白生成障碍性贫血筛查最常见的方法是Hb电泳。Hb电泳主要有琼脂糖Hb电泳和毛细管Hb电泳,因为毛细管Hb电泳方法更有优势[5],大部分新生儿筛查中心实验室采用毛细管电泳技术筛查α-珠蛋白生成障碍性贫血。
α-珠蛋白生成障碍性贫血的产生机制是α-珠蛋白基因缺失或点突变造成α-珠蛋白链合成减少,导致非α链相对过剩而形成四聚体;新生儿期γ链形成四聚体,Hb电泳结果即表现为Hb Bart′s带[11]。在新生儿期,利用脐血Hb电泳、Bart′s定量测定技术筛查α-珠蛋白生成障碍性贫血,其结果与基因检测结果诊断符合率为91.8%;儿童及成人期,利用静脉血Hb电泳、HbA2定量技术筛查α-珠蛋白生成障碍性贫血,诊断符合率为75.1%[5]。目前,运用毛细管Hb电泳技术筛查新生儿α-珠蛋白生成障碍性贫血的报道中,大部分是采集脐血作为标本进行电泳。与脐血比较,新生儿出生后3~7 d采集足根血干血斑筛查α-珠蛋白生成障碍性贫血更有优势,因为干血斑标本方便各合作单位的寄送,又可永久储存,更有利于该技术的管理与全面推广。
本研究中,筛查与基因诊断符合率为94.29%,稍高于叶立新等[5]、黄金芬等[10]、陈小兰等[12]报道的诊断符合率,表明运用全自动毛细管电泳技术筛查新生儿α-珠蛋白生成障碍性贫血可满足临床需求。随机同时检测Hb Bart′s水平与珠蛋白生成障碍性贫血基因的202例的对照标本中,筛查与珠蛋白生成障碍性贫血基因诊断符合率为91.89%,低于上述的94.29%,可能是随机对照标本部分筛查阳性新生儿属于稀有型珠蛋白生成障碍性贫血,不在所用试剂的检测范围内,也可能是Hb Bart′s水平与基因检测符合率有差异的原因;也不排除操作误差引起。未检出Hb Bart′s带的标本167例(确诊2例-α3.7/αα、1例αWSα/αα珠蛋白生成障碍性贫血),结果表明该技术无法检出少部分静止型α-珠蛋白生成障碍性贫血,与WU等[13]提出的Hb Bart′s带不能作为新生儿-α3.7/αα型珠蛋白生成障碍性贫血的筛选方法观点相符;但与ALAUDDIN等[14]报道的利用毛细管电泳系统分析Hb Bart′s方法可以筛选新生儿非缺失型α-珠蛋白生成障碍性贫血稍有差异。
本研究提示,依据Hb Bart′s水平可初步判断α-珠蛋白生成障碍性贫血分型,确诊1 271例α-珠蛋白生成障碍性贫血中,有402例Hb Bart′s水平在0%~<1%,静止型343例(85.32%);844例Hb Bart′s水平在1%~<5%,标准型810例(95.97%);25例Hb Bart′s水平>5%,中间型(HbH病)24例(96.00%)。因没有筛查出重型α-珠蛋白生成障碍性贫血个体,无法讨论重型α-珠蛋白生成障碍性贫血Hb Bart′s的水平。
本研究检出的基因型别27种,排在前3名基因型依次是--SEA/αα、-α3.7/αα与-α4.2/αα,此基因分布特点与相关研究的地区报道的α-珠蛋白生成障碍性贫血主要基因型别是一致的[15-18],与本地区作者胡莉莉等[19]、刘平等[20]报道的α-珠蛋白生成障碍性贫血主要基因型别相同。
综上所述,运用干血斑毛细管电泳技术筛查新生儿α-珠蛋白生成障碍性贫血有较高的诊断符合率,可在早期发现α-珠蛋白生成障碍性贫血。本研究阐明了河源地区α-珠蛋白生成障碍性贫血基因分布特征,以此制订珠蛋白生成障碍性贫血防控策略,做好相关遗传咨询与宣传工作,可指导广大适婚人群进行合理婚育,提高新生儿出生质量。
