盐胁迫对普陀樟和日本荚蒾生理及叶片解剖结构的影响
2021-01-13高玉德沈登锋王世伟章建红
高玉德 沈登锋 王世伟 章建红
摘 要:以2年生普陀樟(Cinnamomum japonicum var.chenii)和日本荚蒾(Viburnum japonicum)容器苗为研究材料,施以不同浓度(0、3‰、6‰、9‰)NaCl溶液,调查其生理生化指标和叶片解剖结构的变化,对耐盐能力进行评价。结果表明,随NaCl處理浓度的增加2种植物叶绿素质量浓度、净光合速率(Pn)显著下降;其中普陀樟和日本荚蒾光合速率下降的主要因素分别为非气孔限制和气孔限制;低浓度NaCl处理对两者生长有促进作用,表现为最大光化学效率(Fv/Fm)、潜在光化学效率(Fv/Fo)的上升,YⅡ、qP的下降;切片结果表明盐处理后叶片栅栏组织的厚度和组织细胞变小、细胞间隙变大,普陀樟变化程度显著小于日本荚蒾。综合各指标变化,低浓度盐环境促进普陀樟和日本荚蒾生长,而高浓度会产生抑制效应,两者中普陀樟对盐环境适应能力更强。
关键词:NaCl胁迫;光合参数;叶片解剖结构
中图分类号:S71 文献标识码:A
文章编号:1008-0457(2021)05-0028-06 国际DOI编码:10.15958/j.cnki.sdnyswxb.2021.05.005
Effects of Salt Stress on Physiology and Leaf Anatomical Structure of Cinnamomum Japonicum var.Chenii and Viburnum Japonicum
GAO Yude1,2,SHEN Dengfeng2,WANG Shiwei1*,ZHANG Jianhong2
(1.College of Forestry and Landscape Architecture,Xinjiang Agricultural University,Urumqi,Xingjiang 830052,China;2.Institute of Forestry,Ningbo Academy of Agricultural Sciences,Ningbo,Zhejiang 315040,China)
Abstract:To explore salt tolerance evaluation of Cinnamomum japonicum var.chenii and Viburnum japonicum,two-year-old container seedlings were watered by different concentrations of NaCl solution (0,3‰,6‰,9‰).Their physiological and biochemical index and leaf anatomical structure were investigated.The results showed that the chlorophyll mass concentration and net photosynthetic rate (Pn) of the two species decreased significantly with increase of NaCl concentration,The main factors of photosynthetic rate decrease in the twoplants were non-stomata restriction and stoma restriction,respectively.Low-concentration NaCl treatment could promote growth of both species,manifested by the increase of maximum photochemical efficiency (Fv/Fm),potential photochemical efficiency (Fv/Fo) and decreaseof YII and qP.The slice results indicated that thickness of the leaf fence tissue and the tissue cells became smaller and intercellular space became greater after salt treatment.The degree of change in Cinnamomum japonicum var.chenii was significantly less than that in Viburnum japonicum.Based on changes in various indicators,low-concentration salt environment promotes the growth of Cinnamomum japonicum var.chenii and Viburnum japonicum,while high concentration inhibits.Both them,Cinnamomum japonicum var.chenii has a stronger ability to adapt to salt environment.
Keywords:salt stress;photosynthetic parameters;anatomical structure of leaf
基金项目:宁波市科技局公益项目(2019C10085)
普陀樟(Cinnamomum japonicum var.chenii)和日本荚蒾(Viburnum japonicum)分布于浙江东部海岛,是具有抗风、抗海雾、耐干旱等优良性状的树种。普陀樟属常绿乔木,常作为沿海山地造林使用,野生资源趋于枯竭,被列为国家Ⅱ级重点保护植物[1]。日本荚蒾属常绿灌木,野生植株常生长于松林下、灌草丛中,为浙江省重点保护野生植物[2]。
海岛环境受盐雾、海水侵蚀等影响,土壤盐渍化严重影响原生植物的生长。在盐环境中,植物通常表现为生长速度慢、植株矮小、叶片发黄脱落等受胁迫和生长势增强、生物量增加等受促进两种情况[3]。研究者总结了一系列生理生化指标来反映盐处理下植株的适应情况,高浓度盐处理会导致植物叶片中叶绿素被降解,抑制叶绿素对光能的捕獲能力,从而影响植物正常生长[4]。净光合速率的变化与植物气孔导度、胞间CO2浓度、蒸腾速率等有着显著相关性,棉花中气孔导度和叶肉导度的下降在植物光合抑制方面起主要作用[5]。由于叶绿素荧光反映植物体内能量捕获与传递的特性,常常作为光合作用的探针被使用。根据已有报道盐处理下植物的最大光化学效率、潜在光化学效率、光化学猝灭系数等荧光参数均呈下降的趋势[6]。组织切片直接反映植物解剖结构在盐胁迫下的变化。为研究两个乡土树种对海岛盐生环境适应机制,开展了不同浓度盐处理下的生理活性、解剖结构的研究,总结指标变化规律,对两种植物的耐盐性开展评价,为乡土树种在海岛生态修复和近海防护林营造等提供科学依据。
1 材料与方法
1.1 试验材料
试验所需普陀樟和日本荚蒾两年生容器苗引种自舟山市林业科学研究院。
1.2 试验方法
1.2.1 试验设计
试验地点在宁波市高新农业技术实验园区(121°41′E,29°48′N)温室大棚开展,采用盆栽方式试验。根据杭州湾南岸防护林带土壤含盐量设置了4个处理,即清水对照(CK)、3‰、6‰、9‰浓度的NaCl溶液,每个处理15盆,3次重复,胁迫持续35 d。
1.2.2 指标测定方法
待胁迫结束后,选取成熟叶片,对植物叶片电导率进行测定[8];随机取3片成熟叶片进行台盼蓝(Trypan Blue)染色检测分析叶片凋亡区域变化[9];叶绿素含量测定参照分光光度法[10];选取植株上部生长旺盛的成熟叶片,使用Li-6400(LI-COR,美国),于早上9∶00-11∶00测定光合气体交换参数,包括叶片净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr);使用Mini-PAM2500便携式调置叶绿素荧光仪测定相关叶绿素荧光参数;叶片结构观察采用微波石蜡切片法[11]。
1.3 数据处理
使用Microsoft Excel 2016和SPSS 19.0对数据整理与统计,采用邓肯氏新复极差检验法对各生理指标进行显著性分析,使用GraphPad Prism 8绘制图表。
2 结果与分析
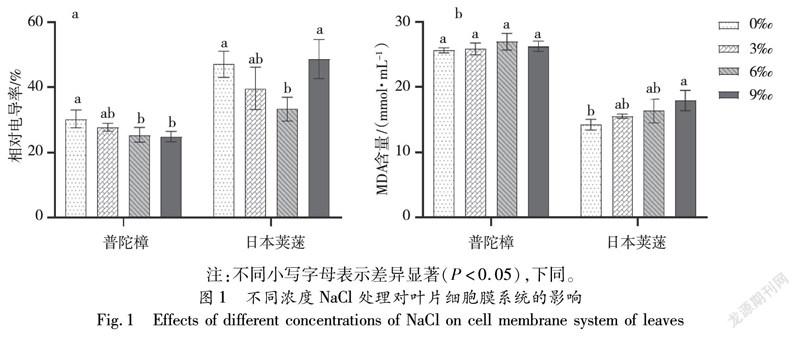
2.1 不同浓度NaCl处理对叶片细胞膜系统的影响 在NaCl处理后,2种植物相对电导率总体呈下降趋势,丙二醛含量(MDA)表现为上升变化,但普陀樟的相对电导率与MDA含量变化幅度均小于日本荚蒾。普陀樟随NaCl浓度的增加相对电导率
持续下降,3‰、6‰、9‰NaCl处理后较对照分别下降8.3%、15.9%、17.8%;MDA含量较对照无显著差异。日本荚蒾在NaCl浓度≤6‰处理下,相对电导率的变化与普陀樟相同持续下降,变化幅度更大,在6‰处理下较对照下降29.5%达到最低值,当NaCl浓度提高至9‰,相对电导率开始上升,但最终较对照无显著差异。与普陀樟的MDA含量的变化趋势不同,日本荚蒾MDA含量随NaCl浓度的提高持续的增加,在9‰处理下较对照上升26.0%(P<0.05)。
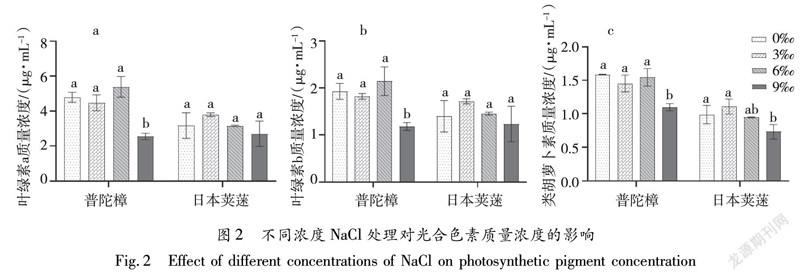
2.2 不同浓度NaCl处理对光合色素质量浓度的影响
随NaCl浓度的提高两种植物的叶绿素a、叶绿素b、类胡萝卜素的含量均先升后降;在NaCl浓度≤6‰处理下两者较对照变化均不显著。普陀樟的叶绿素a、叶绿素b的最大值均在NaCl浓度6‰处理后,较对照分别上升12.5%、10.9%,在NaCl浓度9‰处理下,叶绿素a、叶绿素b、类胡萝卜素质量浓度较对照分别下降46.9%、38.9%、30.8%,达到最小值。日本荚蒾的叶绿素a、叶绿素b、类胡萝卜素质量浓度的变化趋势均表现为在低浓度处理(3‰)上升,较对照分别上升19.6%、22.1%、12.1%;之后随NaCl浓度的增加持续下降,在NaCl浓度9‰处理下较对照分别下降14.5%、12.1%、26.3%达到最小值。
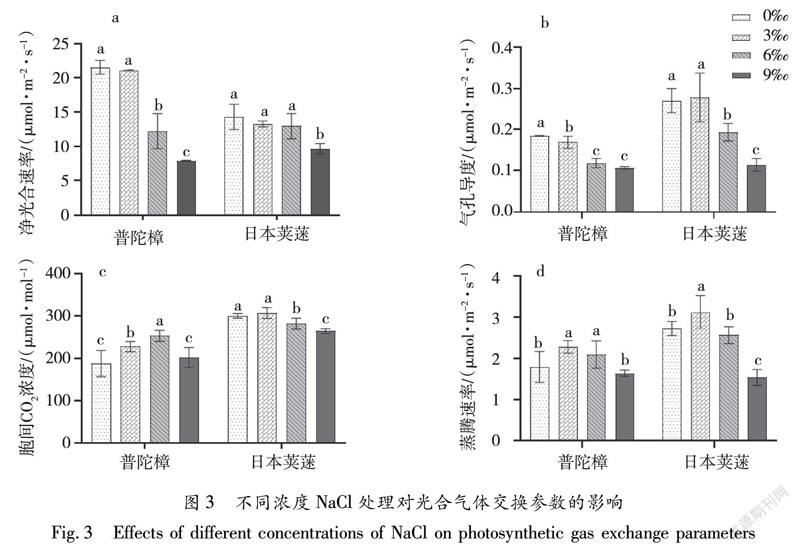
2.3 不同浓度NaCl处理对光合气体交换参数的影响
如图3所示,普陀樟和日本荚蒾在NaCl处理后,净光合速率(Pn)均出现不同程度的下降。普陀樟在NaCl浓度≤3‰处理下Pn较对照差异不显著,之后随着NaCl浓度增加Pn较对照显著下降,在6‰和9‰处理后较对照分别下降43.2%、63.3%。日本荚蒾在3‰、6‰处理下Pn较对照降低但无显著差异,在9‰处理下,Pn较对照下降32.7%(P<0.05)。在NaCl处理后,普陀樟Gs持续下降,Ci与Tr随Gs的下降呈上升趋势;普陀樟在NaCl浓度3‰、6‰、9‰处理下,Gs较对照分别下降8.6%、36.2%、42.7%,而Ci在NaCl浓度≤6‰处理下持续上升,较对照最大上升幅度为34.6%,在NaCl浓度9‰处理下开始下降,但较对照仍高出7.4%,同时Tr在NaCl浓度3‰和6‰处理后较对照分别上升26.7%和16.7%, 9‰处理后下降8.9%。日本荚蒾Gs、Ci与Tr均先升后降,在3‰处理下分别上升3.0%、2.3%和14.7%达到最大值,在9‰处理下出现最小值,较对照分别下降57.8%、12.0%和43.6%。
2.4 不同浓度NaCl处理对叶绿体荧光参数的影响
由图4可以发现,普陀樟和日本荚蒾的最大光化学效率(Fv/Fm)和潜在光化学效率(Fv/Fo)均呈先升后降的趋势,在NaCl浓度3‰处理下达到最大值,之后随NaCl浓度增加开始下降,在NaCl浓度6‰处理下仍高于对照,在NaCl浓度9‰处理下较对照显著下降,普陀樟和日本荚蒾的Fv/Fm和Fv/Fo较对照分别下降9.6%、32.6%和4.2%、13.0%。普陀樟的实际光化学量子效率(YⅡ)和光化学猝灭系数(qP)的变化趋势相同,均随NaCl浓度升高逐步下降,在NaCl浓度3‰处理下YⅡ和qP较对照分别下降38.8%、34.9%,且在NaCl浓度3‰和6‰处理下较对照无显著差异,在NaCl浓度9‰处理下较对照分别下降59.7%、34.8%。日本荚蒾的YⅡ在NaCl处理后虽有下降但较对照差异均不显著,而qP的变化规律与YⅡ相反,随NaCl浓度的提高持续上升,在NaCl浓度9‰处理下较对照上升13.9%(P<0.05)。
2.5 不同浓度NaCl处理后叶片台盼蓝染色
如图5所示,台盼蓝染色的结果显示,随着NaCl浓度的逐渐提高,日本荚蒾叶片的死亡细胞不断增加,而普陀樟的叶片并未显示细胞死亡的现象。在3‰和6‰浓度NaCl处理后日本荚蒾的叶片只有小部分叶片表面出现蓝色斑点,当NaCl浓度提高至9‰后日本荚蒾叶片全部区域均着色,着色面积显著大于其他浓度NaCl处理后的叶片。
2.6 不同浓度NaCl处理后对叶片解剖结构的影响
由图6可知,NaCl处理后普陀樟和日本荚蒾的栅栏组织厚度下降,而海绵组织的厚度上升。对照组普陀樟的栅栏组织细胞发达,呈长柱状排列整齐紧密,海绵组织细胞数量较多;日本荚蒾栅栏组织呈大小均匀的短柱形,排列整齐紧密,海绵组织细胞较大。普陀樟在3‰盐处理后,栅栏组织细胞变大,厚度增加,海绵组织细胞也变大,同时细胞间隙变大,之后随处理盐浓度的提高,栅栏组织细胞体积下降,细胞间隙较对照明显增大,在9‰盐处理后,栅栏组织厚度较对照减小,且细胞大小形状不一,排列疏松不整,海绵组织细胞变小,细胞间隙较对照变大。日本荚蒾的栅栏组织细胞大小在NaCl处理后较对照显著变小,海绵组织细胞逐渐变大,在9‰NaCl处理下,栅栏组织厚度较对照显著变小。
3 结论与讨论
NaCl处理导致植物膜系统遭到破坏,造成细胞中物质渗透规律被破坏,相对电导率和丙二醛含量可以反映植物细胞膜系统在NaCl处理后的受害情况[12-13]。在本研究中,普陀樟和日本荚蒾的相对电导率在NaCl处理后持续下降,在9‰处理下日本荚蒾的相对电导率虽有上升但与对照无显著差异,这与盐穗木的研究结果相似[14],说明两种植物在试验设置的NaCl浓度范围内膜系统受害不严重,反而具有促进生长的作用。MDA含量变化也说明了这一结论,在NaCl处理后普陀樟的MDA含量较对照无显著差异,日本荚蒾的MDA含量虽有上升但上升幅度较NaCl胁迫后的望春玉兰[15]、四季秋海棠[16]等植物的上升幅度较小,说明普陀樟与日本荚蒾在NaCl处理下植物细胞膜系统并未受到过度损害。
光合色素作为植物进行光合作用的重要物质,其含量的变化可以反映植物光合能力的大小,可作为盐胁迫下植物抗逆能力的重要指标[17]。在本研究中,两种植物的光合色素含量均呈现在低浓度NaCl处理下较对照小幅度上升但无显著差异,随着NaCl浓度的进一步提高光合色素含量开始出现下降趋势,这与薄荷的研究相似[18],说明两种植物均具备通过提高光合色素含量来抵抗逆境的能力,但是随着NaCl浓度的持续增加,这种调节机制失效,植物光合色素无法继续合成导致含量下降。
植物净光合速率(Pn)是植物光合作用的直观指标。一般认为Gs下降的情况下Ci与Tr若也表现为下降趋势,则认为造成Pn下降的主要原因为气孔限制,而当Gs下降的情况下Ci与Tr上升或稳定时,则认为造成Pn下降的主要原因为非气孔限制[19]。在本研究中,普陀樟在经过NaCl处理后Pn呈下降趋势,且随着NaCl浓度的提高,这种下降幅度也在增加,与此同时普陀樟的Gs也随NaCl的处理呈相同的下降趋势,但是Ci与Tr则表现为先升后降的趋势,这与红花玉兰的研究结果相同,说明造成普陀樟Pn下降的主要原因为非气孔限制[20]。日本荚蒾的Pn和Gs在NaCl处理后与普陀樟的变化趋势相同呈下降趋势,而Ci和Tr的变化与普陀樟不同,表现为与Gs相同的变化规律,一般认为造成日本荚蒾的Pn下降的原因为气孔限制[21]。
植物叶绿素荧光参数的变化可以反映植物在逆境中对光能吸收、转化、传递的综合能力[21]。在本研究中,低浓度NaCl处理后,两种植物的Fv/Fm、Fv/Fo均显著上升,之后随处理浓度增加Fv/Fm、Fv/Fo开始下降,这与NaCl处理对小麦的影响结果相似[7],说明低浓度NaCl处理对两种植物的的PsⅡ光化学效率有促进作用,而在高浓度处理下植物的PsⅡ反应中心受损,植物光合能力下降。普陀樟的YⅡ和qP的下降说明其在NaCl处理后植物光合作用的电子传递受阻,光合同化能力下降,日本荚蒾与普陀樟不同的是YⅡ较对照无显著差异的情况下qP却出现显著的上升,說明日本荚蒾通过改变某种激发能的分配方式,来达到对植物的保护作用[7,22]。
植物表观和解剖结构的变化是反映植物在遭受胁迫后适应能力的直观体现[9]。在本研究中,普陀樟在盐胁迫后叶片受害不显著,而日本荚蒾在NaCl处理后叶片受害程度随NaCl浓度的提高而增加,这与夏菊和苹果砧木在胁迫下产生的变化一致,说明普陀樟在NaCl胁迫下受害程度显著低于日本荚蒾[9,23]。对解剖结构的变化观察,发现NaCl处理后叶片栅栏组织变薄,海绵组织变厚,叶肉细胞变小细胞间距变大的的情况与美洲红树的研究结果相似[24],说明NaCl处理造成水分供应不足,阻碍叶片的水分代谢,导致叶肉细胞分裂受阻,限制了植物叶片的正常生长。日本荚蒾的栅栏组织厚度和细胞形状的变化较普陀樟更显著,说明日本荚蒾的盐环境适应能力显著低于普陀樟。
综上各项指标说明,普陀樟和日本荚蒾在NaCl浓度≤6‰盐胁迫下生长受到促进,随着NaCl浓度的进一步增高,两种植物的生长受到抑制,但普陀樟在NaCl处理后植物膜系统受害程度更小,表明对高浓度盐环境的应激和适应能力更强。
参 考 文 献:
[1] 袁佳.舟山群岛普陀樟群落特征研究[D].杭州:浙江农林大学,2020.
[2] 夏云飞,李瑞娇,杨在娟,等.光照强度对日本荚蒾幼苗生长和生理特性的影响[J].浙江林业科技,2020,40(3):16-21.
[3] 张晓婷,王雪松,贾文飞,等.植物在盐处理下的研究进展[J].北方园艺,2021(6):137-143.
[4] 廖祥儒,贺普超,朱新产.盐渍对葡萄光合色素含量的影响[J].园艺学报,1996(3):94-96.
[5] ABDOUL K M H,申孝军,陈津赛,等.水盐胁迫下棉花叶片光合的气孔与非气孔限制[J].灌溉排水学报,2020,39(11):13-18.
[6] 方怡然,薛立.盐胁迫对植物叶绿素荧光影响的研究进展[J].生态科学,2019,38(3):225-234.
[7] 豆昕桐,王英杰,王华忠,等.两个小麦品种对NaCl胁迫的生理响应及耐盐性差异[J].生态学报,2021(12):1-17.
[8] 王晓峰,陈建励.植物生理学实验技术[M].北京:中国农业出版社,2006:64-84.
[9] 张德,王双成,张仲兴,等.盐胁迫对两种抗性苹果砧木叶片生理及解剖结构的影响[J].果树学报,2021:1-13.
[10] ARNON D I.Copper enzymes in isolated chloroplasts.Polyphenoloxidase in Beta vulgaris[J].Plant Physiology,1949,24(1):1.
[11] 林建东.不同逆境胁迫对杉木幼苗生长及根尖分生组织的影响[D].福州:福建农林大学,2018.
[12] EHLERT B,HINCHA D K.Chlorophyll fluorescence imaging accurately quantifies freezing damage and cold acclimation responses in Arabidopsis leaves[J].Plant Methods,2008,4(1):1-7.
[13] 熊兴伟,杨浩,张文娥.蔗糖浓度对大丽花瓶插寿命及生理特性的影响[J].山地农业生物学报,2021,40(1):85-89.
[14] 赵恩峰,李玲,曾幼玲.盐胁迫对盐生植物盐穗木生理特性的变化分析[J].新疆农业科学,2012,49(4):716-722.
[15] 沈徐悦,张浪,陈蓉蓉,等.盐胁迫对望春玉兰幼苗形态和相关生理指标的影响[J].浙江农林大学学报,2021,38(2):289-295.
[16] 姜云天,李玉梅,陈晨霞,等.盐胁迫对四季秋海棠幼苗生理特性的影响[J].北方园艺,2020(16):62-69.
[17] 刘筱玮,夏斌,陈斌,等.盐胁迫对野菊和神农香菊及其杂交F_1代光合生理的影响[J].东北林业大学学报,2021,49(5):32-39.
[18] 严卓立,李爱,张源一,等.十二种薄荷对NaCl胁迫的生理响应与综合评价[J].植物生理学报,2021,57(1):159-168.
[19] FARQUHAR G D,SHARKEY T D.Stomatal conductance and photosynthesis[J].Annual Review of Plant Physiology,1982,33(1):317-345.
[20] 趙秀婷,王延双,段劼,等.盐胁迫对红花玉兰嫁接苗生长和光合特性的影响[J].林业科学,2021,57(4):43-53.
[21] 王明泉,付立新,李国良,等.玉米抗感种质资源苗期耐盐性的光合作用机制研究[J].中国农学通报,2021,37(5):8-14.
[22] 胡爱双,肖丹丹,张小栋,等.盐胁迫对2个八棱海棠株系生长与光合荧光特性的影响[J].经济林研究,2020,38(3):208-215.
[23] 孔令接,陈言博,王亚琴.不同夏菊品种的耐热性研究[J].园艺学报,2019,46(12):2437-2448.
[24] PARIDA A K,DAS A B,MITTRA B.Effects of salt on growth,ion accumulation,photosynthesis and leaf anatomy of the mangrove,Bruguiera parviflora[J].Trees,2004,18(2):167-174.
通讯作者:王世伟(1984—),男,博士,副教授,主要从事林木栽培与生理研究,E-mail:wsw850204@163.com.
