NaCl胁迫对喜盐鸢尾和马蔺部分生理代谢的影响
2017-03-21原海燕张永侠马晶晶
原海燕+张永侠+马晶晶

摘要:采用溶液培养,研究1.5% 高浓度NaCl胁迫对喜盐鸢尾和马蔺部分生理代谢的影响,结果表明,随高浓度盐胁迫时间的延长,喜盐鸢尾和马蔺叶片内的MDA含量呈先升高后降低趋势,而脯氨酸含量、SOD酶活性及可溶性蛋白含量呈逐渐增加趋势;喜盐鸢尾叶片内的可溶性蛋白含量显著高于对照,鸢尾对逆境胁迫具有较强的抗氧化和渗透调节能力;鸢尾叶片和根系内的Na+含量显著高于对照,且根系内Na+含量随时间的延长而逐渐增加,并显著高于叶片中的Na+含量。将大部分盐分离子封存于根系中,可能是喜盐鸢尾和马蔺盐胁迫诱导抗性机制之一。
关键词:喜盐鸢尾;马蔺;NaCl胁迫;生理代谢
中图分类号: S682.1+90.1 文献标志码: A
文章编号:1002-1302(2016)11-0212-04
植物对盐渍环境的适应有的是通过改变自身结构,有的是靠改变外部形态而调节生理机能[1],植物的抗盐能力往往是植物通过形态结构及生理等改变而适应环境的综合表现结果;因此,探讨植物盐抗性响应的相应生理指标变化,是研究植物抗盐机理和抗盐能力评价的方法之一。
不同植物有不同的耐盐方式和抗性机制,其体内通过生理生化代谢物质变化的调节机制也不尽相同[2]。研究表明,在盐碱胁迫环境中,无论是农作物、草本或是木本观赏植物,其植物体内的生理代谢包括代谢物质含量、酶活性等均可能受到不同程度的影响而发生变化[3-7]。植物在盐碱胁迫下发生的渗透胁迫、离子毒害等伤害作用,也可以通过各种生理生化物质含量的变化来反映,植物体内诱导响应的生理生化代谢调节使植物最大限度地维持植物自身的正常生长,而植物体内各种生理生化物质的含量和代谢的变化,最终也可以通过植物自身的生长状况来反映。
1 材料与方法
1.1 材料
供试材料为喜盐鸢尾(Iris halophila)和马蔺(I. lactea var. chinensis)无性繁殖群体自然结实种子的实生苗。
1.2 材料培养与处理
试验在江苏省中国科学院植物研究所培养温室中进行,挑选籽粒饱满的马蔺和喜盐鸢尾种子,用0.5% NaClO消毒20 min;用自来水冲洗浸泡数次,在适宜温、湿度条件下催芽;选择萌发一致的种子,播于干净的石英砂中保湿培养;待幼苗长到约15 cm,挑选长势基本一致且生长健壮的幼苗,置于 1/2 Hoagland营养液中培养;将幼苗用泡沫板和海绵固定,采用容积约为2 L的塑料容器培养1周,待幼苗缓苗生长;分别选用浓度为0(CK)、1.5%的NaCl溶液进行盐胁迫处理,每处理5株苗,重复6次;分别在NaCl处理7、14、21、28 d后测定植物地上部的含水量,叶片MDA、脯氨酸、SOD活性、可溶性蛋白含量,以及叶片、根系中Na+、K+含量。
1.3 测定方法
1.3.1 地上部分含水量的测定 将植物材料从营养液中取出,用自来水冲洗干净;用吸水纸反复擦拭,直至将叶片表面水分擦干;去除根系,保留地上部分,在分析天平上称其鲜质量;将材料置于烘箱中105 ℃杀青30 min;烘箱中60 ℃烘干至恒质量,测定干质量。叶片组织含水量计算公式为:叶片组织含水量=(地上部鲜质量-地上部干质量)/地上部鲜质量×100%。
1.3.2 生理指标测定 MDA含量、脯氨酸含量、SOD活性、可溶性蛋白分别采用硫代巴比妥酸法、酸性茚三酮法、NBT光还原法、考马斯亮蓝法测定。
1.3.3 Na+和K+含量测定 将植物叶片和根系充分洗净,105 ℃杀青;60 ℃烘干至恒质量,称取0.2 g干样,磨碎;用HNO3-HClO4消煮法提取离子,用Hitachi 180-80火焰原子吸收分光光度计测定。
2 结果与分析
2.1 NaCl胁迫对喜盐鸢尾和马蔺地上部含水量的影响
由表1可见,随盐胁迫时间的延长,喜盐鸢尾地上部组织内含水量不断降低,处理28 d时其含水量为处理7 d时的92.93%,约为对照的95.52%,含水量变化明显;马蔺地上部的含水量在胁迫处理21~28 d时趋于相对稳定状态;盐胁迫处理28 d,马蔺地上部组织内含水量为对照的98.15%,为处理7 d时的94.84%,含水量變化不明显,这表明与喜盐鸢尾相比,马蔺在盐胁迫下地上部分的吸水、保水能力相对更强。
2.2 NaCl胁迫对喜盐鸢尾和马蔺脯氨酸含量的影响
脯氨酸是水溶性很强的一种氨基酸,水合能力很强,在细胞渗透调节、结构保护、自由基清除、参与氮代谢和能量代谢等方面具有重要的作用[8]。在不良环境胁迫下,植物体内的脯氨酸可以和蛋白质作用形成疏水骨架,以此来维持植物细胞膜结构的稳定性,保护生物大分子结构免遭破坏[9]。有研究发现,在盐胁迫条件下,脯氨酸可以保护植物根部线粒体的电子传递链复合体Ⅱ免受伤害[10],进而通过维持光合活性的方式以保护植物体。盐碱胁迫下,植物叶片在一定程度上通过积累大量脯氨酸以减缓盐分对植物地上部的伤害。由图1、图2可见,随着胁迫时间的延长,喜盐鸢尾和马蔺体内的脯氨酸含量均呈增加趋势;盐胁迫28 d时,喜盐鸢尾叶片内脯氨酸含量为对照的3.62倍;马蔺在1.5% NaCl处理14 d时体内的脯氨酸含量达到较高水平,在盐胁迫28 d达到最高,脯氨酸含量约为对照的1.16倍。这表明喜盐鸢尾和马蔺均具有较强胁迫诱导脯氨酸积累的能力,与许玉凤等的研究结果[11]相一致。
2.3 NaCl胁迫对喜盐鸢尾和马蔺MDA含量的影响
MDA是膜质过氧化的产物之一[12],具有细胞毒性,能与膜结构上的蛋白质和酶相结合,交联后使之失去活性,进而破坏各种膜结构,其含量高低与植物膜质受损害程度有关,一定程度上反映植物抗逆境胁迫能力的大小[13]。由图3、图4可见,1.5% NaCl胁迫处理28 d内,喜盐鸢尾和马蔺叶片内的MDA含量均呈先升高后降低的趋势,盐胁迫处理21 d时达到最大值。这说明NaCl胁迫处理前期,喜盐鸢尾和马蔺膜质受到一定伤害,导致MDA积累增加,之后,喜盐鸢尾和马蔺通过一定的自身抗性调节,体内MDA含量降低,同时对膜质的氧化伤害减弱。
2.4 NaCl胁迫对喜盐鸢尾和马蔺SOD含量的影响
植物在逆境中产生过多的活性氧,会对膜系统造成不同程度的伤害,同时对植物体正常的生理代谢也会产生影响。植物体为适应不良环境的影响,自身形成一系列清除活性氧的保护酶系统,抗氧化物歧化酶(SOD)是其中重要的抗氧化酶之一。有试验表明,盐胁迫条件下,植物体内SOD活性与植物的抗氧化胁迫能力呈正相关[14]。由图5、图6可见,随NaCl胁迫时间的延长,喜盐鸢尾SOD含量呈逐渐增加的趋势,处理28 d时SOD含量是对照的97.84%,为处理7 d时的2.31倍,喜盐鸢尾在高盐胁迫下有较强清除活性氧的能力;随盐胁迫时间延长,马蔺的SOD含量呈先降低后激增趋势,盐胁迫处理28 d时,马蔺SOD含量明显高于对照,为处理7 d时的2.44倍,这表明随胁迫时间延长,马蔺的抗氧化保护能力增强。
2.5 NaCl胁迫对喜盐鸢尾和马蔺可溶性蛋白含量的影响
可溶性蛋白是植物体内重要的营养组成成分之一,在植物生理代谢过程中发挥着重要的作用。在逆境中,植物体内部分蛋白合成受阻,而部分蛋白质的含量却显著增加,最终使植物体内总蛋白质的含量发生变化[15]。植物在逆境胁迫中会积累部分可溶性蛋白参与渗透调节作用,降低盐分对植物的伤害作用。由图7、图8可见,1.5% NaCl处理28 d内,喜盐鸢尾和马蔺叶片内的可溶性蛋白含量均呈逐渐增加的趋势,这表明2种植物均具有较强胁迫诱导可溶性蛋白合成及积累的能力;喜盐鸢尾的可溶性蛋白含量均高于对照,喜盐鸢尾对可溶性蛋白的积累能力相对较强,而马蔺的可溶性蛋白含量均低于对照,其积累能力弱于喜盐鸢尾。
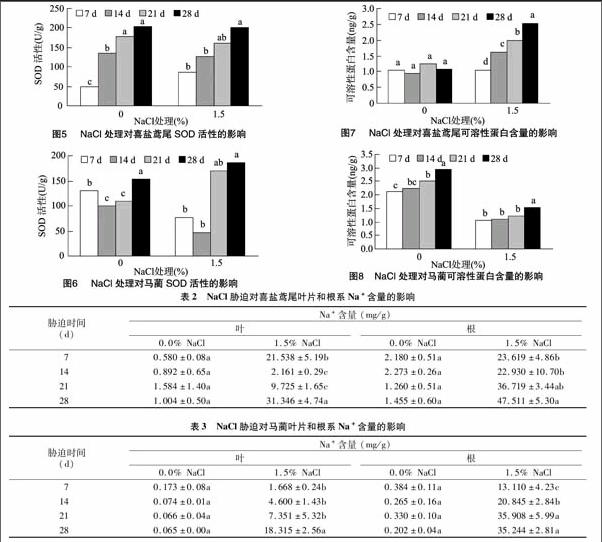
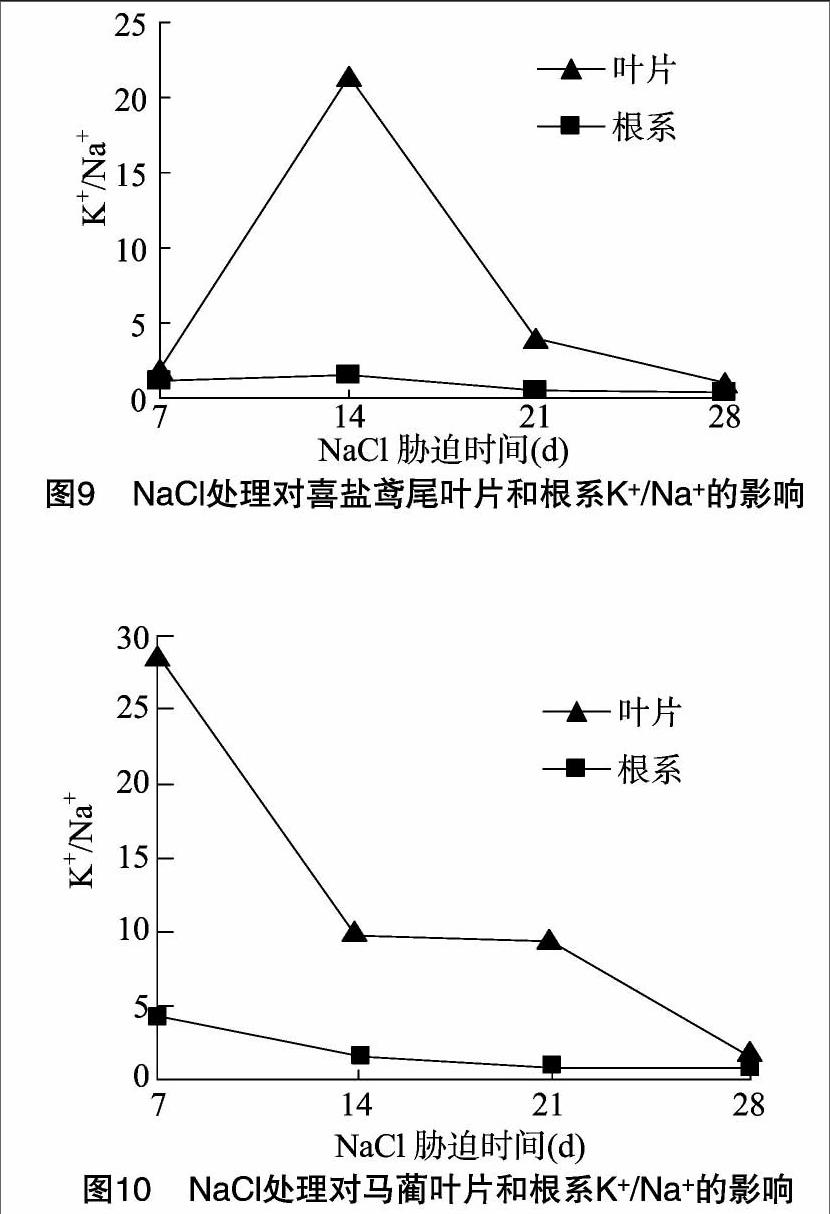
2.6 NaCl胁迫对喜盐鸢尾和马蔺Na+含量、K+/Na+的影响
由表2、表3可见,随盐胁迫处理的延长,喜盐鸢尾根系中Na+含量呈逐渐增加的趋势,而叶片中的Na+含量则呈倒 “S”形增减趋势;盐胁迫处理28 d时,喜盐鸢尾根系中 Na+含量为对照的32.65倍,是叶片中含量的1.52倍;随盐胁迫处理的延长,马蔺叶片和根系中的Na+含量均呈逐渐增加趋势,盐胁迫处理28 d时,马蔺根系中Na+含量是叶片中的1.92倍,为处理7 d时的2.69倍。尽管高盐胁迫下喜盐鸢尾和马蔺的叶片和根系中积累了大量的Na+离子,但2种植物仍能够维持一定的生长,表现出较强的抗盐能力。另外,二者根系中的Na+含量均远高于叶片中的Na+含量,这可能是因为喜盐鸢尾和马蔺将吸收到体内的大部分Na+贮藏于植物根系内,减少了植物根系中Na+向地上部叶片的运输,降低了高盐分离子对植物地上部的伤害,从而最大限度地维持地上部的代谢和生长,这也是耐盐植物诱导抗性调节的机理之一。
植物在高盐胁迫下,地上部叶片K+/Na+含量比高,则其抗盐性较强[16]。由图9、图10可见,盐胁迫处理28 d内,喜盐鸢尾叶片中K+/Na+的含量比均高于根系;喜盐鸢尾叶片中K+/Na+的含量比呈先骤升后明显下降趋势,盐胁迫14 d时达到最大值,为根系的14.4倍,盐胁迫处理21 d时,喜盐鸢尾叶片中K+/Na+的含量比仍为根系的7.3倍,根系中的K+/Na+含量比变化幅度不大;马蔺叶片和根系中的K+/Na+离子含量比均随胁迫时间的延长呈下降趋势,但与喜盐鸢尾相同的是,叶片中K+/Na+含量比始终高于根系。因此,通过提高叶片K+/Na+含量比可能是喜盐鸢尾和马蔺高盐诱导抗性的调节途径之一。
3 讨论
植物抗盐碱胁迫的生理机制较为复杂,参与渗透调节的物质种类多样,参与渗透调节的物质无论是无机离子还是有机物质,其调节机制均有可能不同。有些植物可能在某种渗透调节物质上有较强的积累能力,而对另一些渗透调节物质积累量却很少,则该种植物就以某一主要积累的渗透调节物为主导进行渗透调节;有些植物可能通过多种渗透调节物质参与渗透调节以抵御盐碱胁迫带来的伤害。喜盐鸢尾和马蔺对脯氨酸表现出较强的积累能力,这说明脯氨酸在这2种耐盐植物的抗盐胁迫诱导参与渗透调节方面可能具有相对更为重要的作用。随高盐胁迫时间的延长,马蔺的可溶性蛋白含量虽呈增加趨势,但可溶性蛋白含量却始终低于对照,这说明马蔺体内的可溶性蛋白可能有一部分发生分解,形成了脯氨酸等小分子物质参与到渗透调节;而随高盐胁迫时间的延长,喜盐鸢尾和马蔺膜质过氧化产物MDA含量呈先升高后降低趋势,这是否与2种植物的SOD含量持续增加有一定相关性还有待进一步研究。
Na+含量和Na+与K+的平衡是评估植物受盐害程度和植物耐盐性强弱的一个重要指标。1.5% NaCl胁迫下,随胁迫时间的延长,喜盐鸢尾和马蔺根系和叶片内均积累了较高含量的Na+离子,但从植株的生长状况看,喜盐鸢尾和马蔺并没有出现严重的受害状况,这说明喜盐鸢尾和马蔺对进入体内的盐分离子均具有一定的忍耐能力,可能是由于二者体内有多种渗透物质参与了渗透调节,也可能有其他的无机离子如Ca2+等共同参与渗透调节,以抵抗盐分离子的毒害作用,其耐盐相关的分子调控机制等也有待进一步研究。喜盐鸢尾和马蔺地上部叶片中的Na+含量一直低于根系,这说明喜盐鸢尾和马蔺的根系抗盐能力更强,将盐分离子封存在根系中可能是盐胁迫诱导抗性机制之一。而白文波研究认为,马蔺的耐盐机制为拒盐[17],高盐胁迫下马蔺茎叶会分泌出一定的盐分[1]。因此,对喜盐鸢尾和马蔺的耐盐机制同样有待深入研究。另外,Walker等认为,植株地上部分Na+含量低、K+/Na+ 高,则植物的耐盐性较强[16,18]。喜盐鸢尾和马蔺叶片中的K+/Na+比值始终高于根系,这表明喜盐鸢尾和马蔺均具有较强的抗盐能力;随胁迫时间延长,喜盐鸢尾和马蔺叶片及根系内的K+/Na+会降低,可能是由于在高Na+胁迫下,植物对K+的吸收和积累出现显著减少[1]。
参考文献:
[1]白文波,李品芳. 盐胁迫对马蔺生长及K+、Na+吸收与运输的影响[J]. 土壤,2005,37(4):415-420.
[2]赵功强,赵 萍. 8个高羊茅品种幼苗期抗盐性比较[J]. 安徽农业科学,2008,36(20):8447-8449,8452.
[3]姚彩艷,汪晓丽,盛海君,等. 等渗NaCl和PEG胁迫对玉米游离脯氨酸和可溶性糖含量的影响[J]. 扬州大学学报,2009,30(1):90-94.
[4]樊怀福,郭世荣,杜长霞,等. 外源NO对NaCl胁迫下黄瓜幼苗氮化合物和硝酸还原酶的影响[J]. 西北植物学报,2006,26(10):2063-2068.
[5]王伟华,张希明,闫海龙,等. 盐处理对多枝柽柳光合作用和渗调物质的影响[J]. 干旱区研究,2009,26(4):561-568.
[6]张华新,宋 丹,刘正祥. 盐胁迫下11个树种生理特性及其耐盐性研究[J]. 林业科学研究,2008,21(2):168-175.
[7]田晓艳,刘延吉,张 蕾,等. 盐胁迫对景天三七保护酶系统、MDA、Pro及可溶性糖的影响[J]. 草原与草坪,2009(6):11-14.
[8]焦 蓉,刘好宝,刘贯山,等. 论脯氨酸累积与植物抗渗透胁迫[J]. 中国农学通报,2011,27(7):216-221.
[9]陈吉宝,赵丽英,景蕊莲,等. 植物脯氨酸合成酶基因工程研究进展[J]. 生物技术通报,2010(2):8-10,23.
[10]Hamilton E W,Heckathorn S A. Mitochondrial adaptations to NaCl. Complex Ⅰ is protected by anti-oxidants and small heat shock proteins,whereas complex Ⅱ is protected by proline and betaine[J]. Plant Physiology,2001,126(3):1266-1274.
[11]许玉凤,王 雷. 马蔺(Iris lacteal var. chinensis)抗盐生理特性的研究[J]. 植物研究,2009,29(5):549-552.
[12]何开跃,李晓储,黄利斌,等. 3种含笑耐寒生理机制研究[J]. 南京林业大学学报:自然科学版,2004,28(4):62-64.
[13]宋 丹,张华新,耿来林,等. 植物耐盐种植资源评价及耐盐生理研究进展[J]. 世界林业研究,2006,19(3):27-31.
[14]赵可夫. 植物抗盐生理[M]. 北京:中国科学技术出版社,1993.
[15]毛桂莲,哈新芳,孙 婕,等. NaCl胁迫下枸杞愈伤组织可溶性蛋白含量的变化[J]. 宁夏大学学报:自然科学版,2005,26(1):64-66.
[16]Walker R R. Sodium exclusion and potassium-sodium selectivity in salt-treated trifoliate orange(Poncirus trifoliata)and cleopatra mandarin(Citrus reticulate)plants[J]. Austtralian Journal of Plant Physiology,1986,13(2):293-303.
[17]白文波. 马蔺生物学特性及耐盐适应性机制研究[D]. 北京:中国农业大学,2007.
[18]汪良驹,马 凯,姜卫兵,等. NaCl胁迫下石榴和桃植株Na+、K+含量与耐盐性研究[J]. 园艺学报,1995,22(4):336-340.
