氢氧直接合成的过氧化氢原位氧化反应研究进展
2021-01-11巩笑笑张晓昕宗保宁
巩笑笑,张晓昕,宗保宁
(中国石化石油化工科学研究院石油化工催化材料与反应工程国家重点实验室,北京 100083)
过氧化氢(H2O2)作为一种重要的无机化工原料和绿色基础化学品,已被列为世界上最重要的100种化学品之一[1]。其活性氧含量高(质量分数为47%)且降解副产物只有水,省去了反应后的分离和纯化过程,成为工业常用的氧化剂t-BuOOH、HNO3、N2O和高锰酸盐等的替代物。与分子氧相比,H2O2可以在温和的液相环境、酸性或碱性条件下进行氧化反应,是一种高效的多功能强氧化剂[2-3]。现今已有大量的研究工作以H2O2为氧化剂应用于烯烃的环氧化[4-7]、芳烃的羟基化[8-10]、酮的氨氧化[11-14]及烷烃的氧化[15-17]等反应中,因选择性高、反应条件温和、绿色环保等优势而具有良好的工业应用前景。
目前,工业上生产H2O2的方法主要为蒽醌法。此方法工业技术成熟,但存在设备投入量大、工艺流程复杂、环境污染等问题。受工艺成本限制,H2O2生产厂常建于偏远地区,工业应用中需经储存和运输至使用点稀释,而高浓度H2O2不稳定,极易分解,储运成本高,且存在安全隐患。由H2和O2直接合成H2O2的技术因具有原子经济性高、环境效益好等优势而成为研究热点,其适合于低成本、小规模生产H2O2。该反应的机理为H2解离吸附形成H·,与O2非解离吸附形成的O—O·作用,经·OOH中间体生成H2O2。反应过程存在大量的氢过氧化物和活性氧物种,均为H2O2作用于氧化反应的活性物种。近些年的许多研究指出,将 H2和O2直接合成H2O2反应与丙烯环氧化、污水处理等化工过程或其他氧化反应耦合,不仅可以省去H2O2的生产、储存和运输过程,大大降低成本,简化生产工艺,甚至可以合成指定浓度的H2O2以满足不同的氧化反应需求,因而此工艺路线具有广阔的研究意义和工业应用前景。以下以国内外广泛研究的几个特征反应为例,综述H2O2的合成用于原位氧化反应的研究进展及关键问题,以期为今后的研究工作提供思路。
1 H2和O2直接合成H2O2的反应
H2和O2直接合成H2O2的过程涉及气、液、固3相,其反应路径如图1所示。将H2和O2混合气体通入分散有催化剂的悬浮液中,反应物进入溶剂介质与固体催化剂表面的Pd物种接触,除生成H2O2外,还存在H2和O2直接反应生成 H2O、产物H2O2的分解和H2O2加氢3个副反应。由热力学数据可知,H2与O2反应极易生成H2O,导致H2O2的浓度较低。
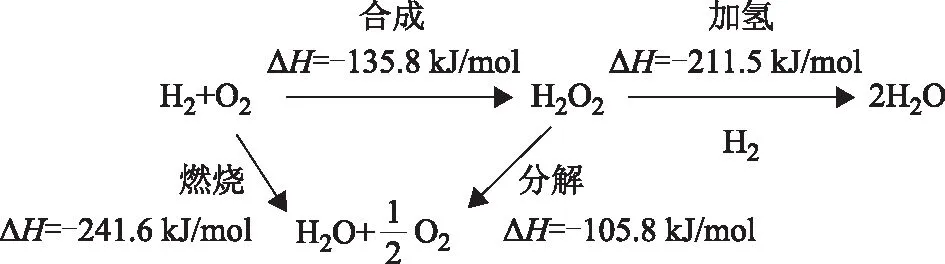
图1 H2和O2直接合成H2O2的反应路径
Lunsford等[18-19]研究发现,以上反应的微观过程存在大量的活性H,O,OH,OOH物种的生成和转化。用*表示金属催化剂上的表面物种,反应微观过程解释如下:首先,H2被吸附在催化剂活性位点上,解离为活性H原子:H2→H2*→2H*;接着,O2非解离吸附并与活性H原子生成反应中间体OOH物种:O2→O2*,O2*+H*→OOH*;然后,OOH物种氢化为产物H2O2:OOH*+H*→H2O2。吸附和加氢步骤是合成H2O2的主要反应步骤。如果O2,OOH,H2O2在催化剂表面强吸附,发生O—O键的断裂或氢化,则生成OH*和H2O,即为副反应的主要路径:O2*→2O*,O*+H*→OH*;OOH*→O*+OH*;OOH*+H*→H2O*+O*;OOH*+H*→2OH*;H2O2*→2OH*;H2O2*+H*→H2O*+OH*。
因此,H2和O2直接合成H2O2的本质反应为活性H,O,OH,OOH物种的生成和转化。这些物种在H2O2的原位氧化反应中发挥重要作用。
2 H2O2原位氧化反应
2.1 丙烯环氧化制环氧丙烷
环氧丙烷(PO)是一种高价值含氧有机物和基本有机化工原料,主要用于生产聚醚多元醇、丙二醇和各类非离子表面活性剂等重要化学品,其生产和应用在石油、化工、农药、纺织、日化等行业具有重要意义。目前工业生产PO的方法主要为氯醇法和共氧化法,但氯醇法对环境污染严重,受环保要求限制;共氧化法虽没有污染,但会副产市场需求低于PO的叔丁醇和苯乙烯,设备投资较大,工艺流程复杂。H2O2直接氧化法(HPPO)具有操作简单,原子经济性高,反应条件温和,环境友好等优点[20],成为当今研究开发的重点。
工业上HPPO工艺以 H2O2溶液和丙烯气体为原料,H2O甲醇为反应溶剂,选用合适的钛硅催化剂在相对温和的条件下进行直接氧化[21],需就近建立H2O2工厂作为配套,以降低高浓度H2O2溶液的储运成本[22]。探索以H2、O2和丙烯为原料,用H2和O2直接生成的H2O2原位氧化丙烯,可以去除预先制备H2O2的工艺,在经济、环保及未来发展等各方面均具有优势。文献报道中,以Au,Pd,Pt贵金属或其组合形式作为催化剂活性组分,TS-1[23-28]、Ti-MCM-41[29-31]及其氧化物[32-34]等钛材料为载体,组成双功能催化剂;生成的H2O2在温和条件下由载体内孤立的Ti4+位点活化,此为反应的速控步骤。其反应机理如图2所示:H2与O2在金属表面产生·OOH自由基或H2O2;丙烯吸附在钛材料载体上,生成双配位丙氧基化合物;·OOH自由基与双配位丙氧化合物相互作用并于催化剂表面脱附生成PO和H2O[35-36]。载体本身较大的孔结构有利于反应物和产物的扩散。
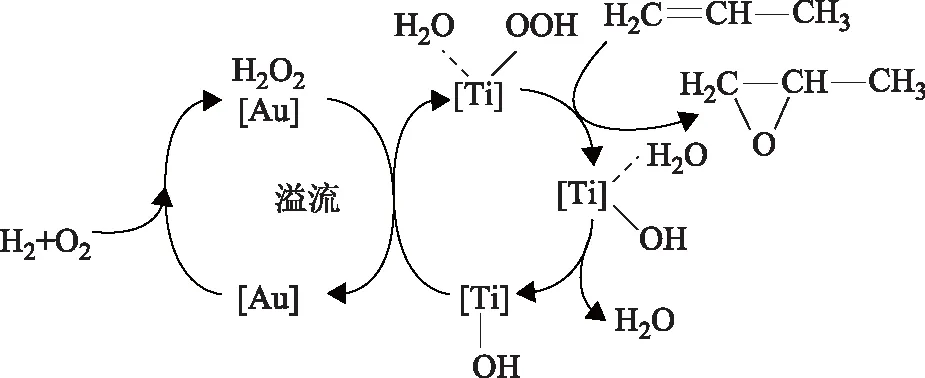
图2 钛硅分子筛负载的Au基催化剂上H2O2原位氧化合成环氧丙烷机理
反应体系中加入Cs2CO3[37],CsNO3[38],CsCl[29]等无机盐,可抑制丙烯加氢、PO水解及PO与甲醇反应等诸多副反应的发生,提高PO产率。Chen Qi等[39]发现,当使用0.2%PdTS-1+0.02%PtTS-1催化剂并以醋酸铵为抑制剂时,在压缩的 CO2介质中可以得到28.7%的丙烯转化率和81.8%的PO选择性。Qi Caixia等[40]认为副反应丙烯加氢与Au纳米团簇的大小及是否存在碱性促进剂有关,2~5 nm的Au颗粒及碱性促进剂均可促进环氧化反应。Lu Jiqing等[41]研究了第二组分对AuTS-1催化剂的影响,发现加入碱金属(K,Cs)对金属负载无影响但可提高催化活性,碱土金属(Mg,Ca,Sr,Ba)对Au负载量和催化活性均存在促进作用,其中以Mg为最优。此外,Ge的添加对AuTS-1催化剂活性中心产生配体效应,可以降低环氧反应的活化能,从而影响丙烯的转化率和PO选择性[42]。
HPPO是当前发展较快且工艺成熟的工业化生产技术,开发以H2、O2和丙烯为初始原料的绿色新技术,可从根本上解决H2O2的供应来源问题。国内对这方面的研究还相对薄弱,因而需开发高活性、高稳定性的催化剂,加大力度研发具有自主知识产权的绿色PO生产新工艺。
2.2 Fenton反应
含酚废水是指主要含有苯酚、甲酚、硝基甲酚等高毒性、难降解有机物的工业废水,来源于石化、制药、塑料及树脂等生产过程,对人体、水生生物和自然环境存在巨大危害,已被许多国家列入重点污染物的黑名单。工业上根据废水中酚类物质组成、浓度及酸碱度不同,采用物化、化学、生化等不同方式处理[43-45]。Fenton反应是指将有机污染物通过H2O2与Fe2+的混合溶液,H2O2经歧化反应生成具有强氧化能力的·OH自由基及其他活性氧物种,在温和条件下采用化学方法氧化分解有机物以达到去除目的,适用于中低浓度废水有机污染物的降解,是一种非常具有潜力的高级催化氧化技术[46-51]。
Esplugas等[52]对比了O3、紫外光、H2O2、Fe2+及光催化等不同催化体系氧化降解苯酚的效果,Fenton试剂对苯酚的降解速率最大,而选用H2O2为氧化剂时,其氧化产物只有H2O和O2等环境友好物种,且此过程具有操作简单(在室温和常压下操作)和无毒、反应快、降解完全等优点。商业上多为蒽醌法生产的高浓度H2O2,其运输、稀释成本较高,因此探究原位生成H2O2的技术直接用于Fenton废水处理具有重要意义和巨大优势。先前的研究者考察了两种不同的催化体系:负载型Pd基催化剂与均相Fe2+催化剂组成的半均相体系,Pd-Fe负载于不同载体上的非均相体系。Triki等[53]认为Pd-Fe合金虽可产生较多的H2O2但并不利于苯酚降解,但Pd与Fe2O3的协同作用可以有效地促进Fenton反应。
Yalfani等[54-57]为解决H2O2合成过程中H2和O2直接接触的安全性问题,采用甲酸、肼和羟胺等替代H2作氢源,研究结果表明,O2甲酸混合物在有机物的氧化阶段可控制H2O2的生成量,O2肼更适用于中性及弱碱性废水的处理。Yuan Songhu等[58]研究采用PdC催化剂和分段电解技术,先电解水生成H2和O2再生成H2O2,并探究与Fenton反应联合降解罗丹明 B的效果,结果表明,在pH为2和100 mA电流作用下,H2O2可在120 min内达到最高质量浓度53.1 mgL,与Fe2+形成Fenton试剂,30 min内完全降解罗丹明B(准一级速率常数为0.109 min-1±0.009 min-1),反应过程和结果见图3。Osegueda等[59]将Pd负载于过渡金属氧化物上制备膜催化反应器作用于H2和O2直接生成H2O2,发现Fe2+加入后反应体系表现出良好的苯酚氧化活性,此研究证明了H2O2原位生成与Fenton反应结合用于废水处理的可行性。
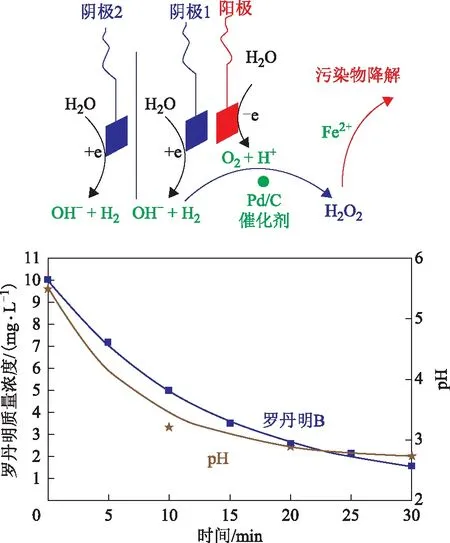
图3 H2O2原位生成与Fenton反应结合用于废水处理
Underhill等[60]在负载型Pd-Fe双金属催化剂上进行了原位生成的H2O2与后添加的商用H2O2的苯酚降解性能对比,发现前者具有更好的作用效果和活性,可能是商业H2O2在反应前一次性大量加入,导致了自由基物种的自终止。此外,苯酚氧化的中间产物导致催化剂中活性组分Fe析出,影响了催化剂的稳定性和使用寿命。在以后的研究中可以通过对催化剂的优化或反应体系的改进,提高催化剂的寿命和稳定性,保持苯酚的高降解活性。上述研究结果表明,原位生成的H2O2在Fenton处理有机物氧化反应中具有巨大潜力,工艺上具有操作过程简单、反应易得、运行成本低廉、设备投资少且环境友好等优点,可有效规避氧化剂H2O2生产成本高的问题。
2.3 甲烷氧化制甲醇
甲烷是天然气、油田气及页岩气的主要成分,在自然界中分布极广且储量丰富,实现甲烷分子活化或选择性转化为甲醇等液体燃料和其他化工产品可以实现天然气的有效利用,对调整能源结构及绿色化工生产意义重大。甲烷直接部分氧化合成甲醇被称为“梦幻工艺”,一直以来都是科研领域具有挑战性的研究课题。甲烷分子中包含4个相同的C—H键,形成高度对称的四面体构型,C—H键非常稳定且活化能很高(440 kJmol),因此,甲烷氧化需要强酸、高温等较为苛刻的反应条件。但甲醇、甲醛等甲烷氧化产物反应活性高,更易深度氧化为CO、CO2等副产物,因而难以在实现高转化率的同时得到较好的选择性。
在现代石化工业中,甲烷转化常采用间接转化方式,即在高温条件下将甲烷C—H键完全断裂转化为合成气(CO+H2),再通过费-托合成得到甲醇等基础化学品,如图4所示[61]。此工艺需要两个独立的工艺步骤,反应条件苛刻,对工艺设备要求高。研究发现,沸石负载的Cu或Fe基催化剂在高温高压下以O2N2O作氧化剂,进行循环氧化可以得到甲醇和甲醛,此气相氧化法要求反应条件苛刻(>400 ℃)且易过度氧化,反应进程难以控制,产品总收率低[62]。甲烷液相氧化反应可显著降低反应温度,以一系列Hg,Pt,Pd,Au,Ru,Rh,V的配合物为均相催化剂,在较为温和的条件下(室温~200 ℃)可以将甲烷选择性氧化为甲醇。反应需以硫酸、三氟乙酸、盐酸或氢溴酸等强酸作为反应介质,先生成中间产物硫酸甲酯,再经水解得到甲醇。该反应中强酸物质的使用对设备提出更高的要求,并产生废酸等污染物[63-69]。
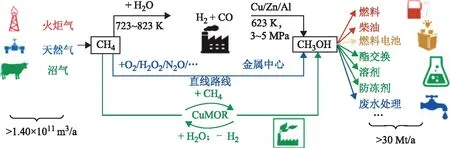
图4 当前工业甲烷转化制甲醇涉及的化工过程
探索新型友好的绿色氧化剂(如H2O2)替代浓硫酸或O2等常用氧化剂,实现甲烷在较温和的反应条件下选择性氧化生产甲醇,在经济和环境方面均具有重要意义[70-71]。Yuan Qiang等[70]考察了不同过渡金属氯化物在水介质中以H2O2为氧化剂,选择性氧化甲烷和乙烷的结果,证实H2O2的分解和甲烷的氧化均为自由基反应,H2O2在过渡金属表面上生成活性氧物种HOO·和HO·,活性氧物种活化C—H键生成甲基自由基CH3·,可以测得中间产物CH3OOH的存在,最后得到产物CH3OH和HCHO。但是商用H2O2价格较高且在反应过程中大量分解,成本损耗较大。相比外部添加H2O2的方式,以O2CH4H2为反应原料,实现H2O2的原位合成与氧化反应的一步耦合更具经济效益。早期的研究工作集中在O2COH2O反应体系[71],首先发生水煤气变换反应生成H2,H2与O2作用直接合成H2O2,H2O2再对甲烷、乙烷和丁烷进行选择性氧化,反应过程见图5。Lin Minren等[72-73]采用RhCl3或PdC和CuCl2K2PdCl4催化体系,卤素离子稳定催化剂的活性组分Pd,Pd及其氧化物负责H2O2的原位生成、甲烷的活化及甲酸的生成,Cu基催化剂负责C—H键的活化并促使其转化为相应的醇。Fan Yafang等[74]发现在PdC催化体系中加入四氯苯醌(TCQ)可对甲烷氧化产物HCOOH或CF3COOCH3进行调节。
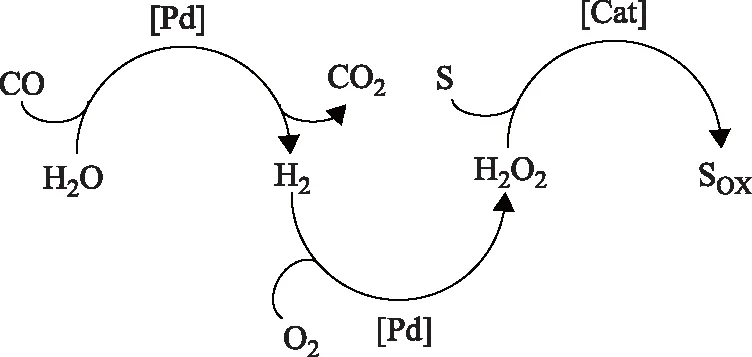
图5 O2COH2O反应体系中H2O2的合成与低链烷烃的氧化反应集成S—基底; SOX—氧化态基底; Cat—Pd或其他
与O2COH2O反应体系相比,直接使用H2O2作为反应原料气能够省去水煤气变换反应步骤,反应过程更简单,低温活性更高。Park等[75-76]通过考察PdC和Cu(CH3COO)2催化剂或V化合物用于H2O2体系甲烷氧化反应的催化效果,证明了CuV化合物对甲烷活化的重要作用。Min等[77]探究了一系列杂多酸化合物的催化效果,其中Pd0.08Cs2.5H0.34PVMo11O40效果最好,其酸性中心Pd促进了活性氧物种的生成,而活性氧与甲烷相互作用为反应的决速步骤,羟基化则发生在杂多化合物结构内部。
Hutchings等[78-79]最早提出负载的Au-PdTiO2双金属催化剂在无酸或卤素离子作稳定剂的情况下仍具有较好的H2和O2直接合成H2O2催化性能,后将此催化剂用于H2O2原位生成与甲烷氧化反应。该过程与添加商用H2O2时相比,虽然产率相同,但H2O2原位合成更有利于O2的捕获和液相中活性氧物种的生成,因此原位合成具有更好的氧化效率和甲醇选择性。采用ZSM-5替代最初的载体TiO2,可以调变载体的硅铝比和酸碱度,从而影响反应活性,效果优于其他氧化物载体上的同类催化剂[80]。后续研究发现,无需载体的AuPd纳米粒子经聚乙烯吡咯烷酮(PVP)保护后可形成稳定的胶体状态,此催化剂不存在金属-载体的相互作用,可以有效减少生成的H2O2在催化剂表面进一步地加氢和分解,使得甲醇选择性高达92%。采用同位素标记法追踪O原子,推断反应以H2O2与O2共同作为氧化剂,H2O2存在两种活化路径,机理如图6所示[81]。第一种路径是:H2O2在催化剂表面生成HO·,HO·与CH4作用夺取H·生成CH3·,CH3·与O2反应生成关键的中间产物CH3OOH,最后分解产生CH3OH。第二条路径为:H2O2分解生成O2和HOO·,与CH3·生成CH3OOH。
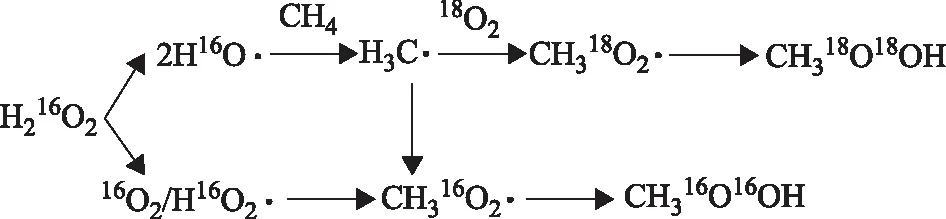
图6 H2和O2直接合成H2O2的原位氧化甲烷反应机理
Zhu Jin等[82]认为影响甲醇产率的关键在于H2O2浓度,因而以提高H2和O2的合成效率,降低甚至抑制生成的H2O2分解和进一步加氢为研究的重点。该课题组提出“分子围栏”概念,设计了一种在温和条件下(70 ℃)原位生成H2O2高效氧化甲烷的催化剂,如图7所示。其将Au-Pd合金纳米颗粒封装在硅酸盐分子筛内部,通过有机硅烷改性对载体进行疏水处理,制备了一系列AuPd@ZSM-5-C3,AuPd@ZSM-5-C6,AuPd@ZSM-5-C16催化剂。H2和O2通过传质进入沸石晶体中生成H2O2,沸石外层的疏水基团可以有效阻碍亲水的H2O2扩散,H2O2局部浓度得以提高。甲烷分子通过疏水层进入沸石内部与H2O2发生反应。改性后的疏水沸石不影响H2、O2和甲烷的扩散,通过提高氧化剂H2O2的局部浓度,显著提高了反应效率,得到目前报道的最高甲醇收率91.6 mmol(h·g)。
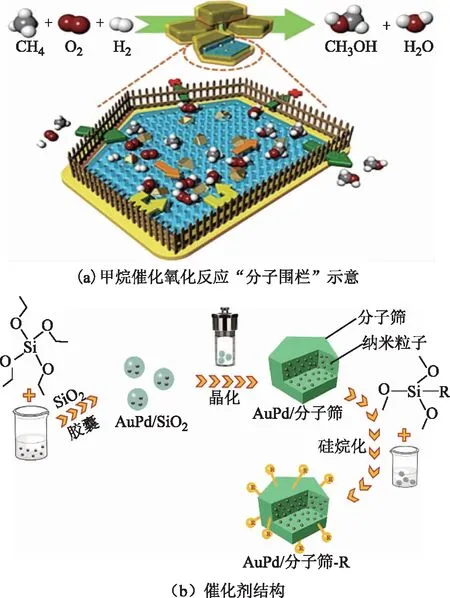
图7 甲烷催化氧化反应“分子围栏”示意与催化剂的结构[82]
先前的研究已经证明了原位生成的H2O2选择性氧化短链烷烃的可行性,该工艺可以很好地控制反应进程,并在一定程度上规避了含氧产物过度氧化为CO2的问题,具有良好的开发前景和工艺优势。但产品甲醇的收率仍然很低,与工业应用所需值相差甚远。因此,通过设计、开发高活性催化剂或改进反应器及工艺路线等方式提高甲醇收率,仍然是未来研究的重大挑战。
2.4 其他氧化反应
Remias等[83]报道了钒和铁氧化物负载的Pd催化剂在H2和O2中原位生成H2O2并用于苯和环己烷羟基化反应的机理研究,采用原位生成H2O2时的产物选择性优于添加H2O2时的选择性。膜反应器被大量应用于H2、O2和苯羟基化体系,但苯酚产率仍较低。对于钛硅分子筛催化剂与H2O2氧化剂联合应用于化学品合成的研究已经有大量报道。如在TS-1[84],HTS[85],KIT-6负载的磷酸矾[86]等催化剂上进行环己烷氧化制环己酮和环己醇试验,反应活性均较低。活性较高的反应体系一般采用均相催化剂,但存在催化剂与反应物难以分离的问题。Kuznetsova等[87-88]以H2、O2和环己烷为原料,通过原位生成的H2O2实现环己烷的氧化,发现少量离子液体添加剂可以显著改善PtC-H3PMo12O40催化剂在O2和H2混合液中原位生成H2O2氧化环己烷的催化性能。离子液体中的Br-和阴离子可稳定活性过氧化物和抑制环己醇的二次氧化,降低H2O2的降解速率,提高环己醇环己酮(KA油)产率。Shetti等[89]认为H2O2与钛硅分子筛作用会生成Ti—O—O-·和HO—Ti—OO-·两种不同的含Ti过氧基团,第一种对环氧化反应有良好的选择性。大连理工大学Li Gang等[90-92]采用AuTS-1、AuTi-HMS等催化剂,探究H2、O2共存时H2O2原位合成并用于液相氧化脱除燃油中的硫化物。其反应机理与H2、O2、丙烯环氧化反应类似:Au主要用于催化合成H2O2过程,H2O2物种迁移至骨架钛活性位上,Ti与·OOH物种形成过渡态,此过程为硫化物氧化反应的速控步骤;大分子硫化物的底物先被氧化为具有一个O的亚砜化合物,进而氧化为砜。催化剂在连续使用5次后仍可保持几乎100%的硫去除率。Karmee等[93]在超临界CO2H2O双相体系中采用PdTiO2催化剂催化H2和O2直接生成H2O2,再在TiO2上将硫茴香醚选择性氧化制备甲基亚砜。H2O2作为绿色氧化剂用于工业过程的研究较多,因而原位生成与氧化反应的集成研究也较广泛,但现阶段的研究因受到产品产率限制而仍处于实验室研究阶段。
3 总结与展望
由H2和O2原位生成的H2O2进行选择性氧化是一种具有潜力的替代当前工艺的方法;与现代工业常用的工艺相比,该反应条件温和,绿色环保,可以很好地控制反应进程,避免高温自氧化产生副产物;与添加市售的H2O2相比,采用来源丰富的分子氧作为原料,无需在氧化现场储存大量H2O2,可有效降低生产和设备成本,避免了商用H2O2的分解造成的成本损耗。但是,此方法目前仅停留在实验室研究阶段,这是由于直接生成的H2O2在无稳定剂情况下产率较低,酸与卤素等稳定剂存在时又会降低催化剂和反应器的使用寿命,这些均是合成反应中亟需解决的科学问题。此外,此工艺包括H2O2的合成及目标底物氧化两个反应的串联过程,这一系列过程微观机理复杂,涉及各组分在活性位点的吸附、脱附及扩散,同时还需考虑生成的H2O2分解,因而,对于未来催化剂的设计侧重同时可进行两种反应的活性位,避免生成的H2O2受到扩散限制。经证实集成系统原位生成了大量的氢过氧化物和活性氧物种,促进非活性 C—H 键氧化为相应的含氧化合物,效果优于直接添加的H2O2。可根据类似策略进行推广与设计,加深对反应机理的认识,制定进一步的策略,通过催化剂设计、工艺参数、系统控制等手段提高整体产品收率,实现工艺路线的经济可行性。此外,提高催化剂在选择性氧化过程中的稳定性,防止金属组分流失或毒化,以及考虑到反应系统的安全问题,控制系统中H2O2混合物比例,都是影响未来工业应用的关键。
在过去的几十年中,国外许多研究机构开展了H2和O2直接合成H2O2及原位氧化反应的研究,包括一些传统 H2O2制造商:Evonik,Solvay,Mitsubishi等,已取得阶段性成果,直接合成技术和HPPO技术联产,使人们看到产业化的希望。在我国,H2O2绿色合成技术的报道较多,但与氧化反应的集成研究相对薄弱。通过开发高效、高活性的多功能催化剂以及工艺、设备的优化与设计,探索以H2、O2和有机物为原料的原位氧化体系,无论是从化学品市场角度还是安全生产来看,都具有重要的开发和研究意义。
