大豆荚甾醇提取动力学与热力学的研究
2021-01-09诸爱士金志强潘明纬高婷婷沈菁菁
吴 洁 诸爱士 金志强 潘明纬 高婷婷 沈菁菁
(浙江科技学院生物与化学工程学院,杭州 310023)
中国是世界大豆生产和消费大国。在大豆生产、消费的同时产生了另一种生物质资源-大豆荚[1],每年有数百万吨[2],但没有被充分利用,一般被作为废弃物,部分被作为饲料或燃料。据报道,大豆荚中含有类黄酮、粗蛋白、糖类、粗纤维、粗脂肪、甾醇等多种营养成分[1,3,4]。近年来,有研究者在如何利用这一丰富的生物质资源方面做了相关研究,如王义英等[5]用大豆荚吸附废水中的酚;于芮等[6]用大豆荚作为吸附材料来处理含重金属离子的废水;韦学玉等[7]将大豆荚制成纳米零价磁性生物炭复合材料。植物甾醇是广泛存在于植物中的一种三萜醇类化合物,具有许多生物活性,对健康有益[8-10],因此植物甾醇现已被广泛应用于许多行业的产品中。有效成分的提取过程符合一定的规律,用一个合适的数学模型来表达有效成分提取这一动态过程,可准确说明提取过程机理、精确控制提取过程,进一步为产业应用提供依据,从而可实现工艺和设备的优化。大豆荚甾醇提取过程的动力学及热力学研究鲜见文献报道,本研究综合考虑文献提取植物甾醇的报道[11]和溶剂的安全与有效性等因素,选用乙醇水溶液作为提取剂,从大豆荚中提取甾醇,经单因素考察预实验,选择合适的物料形状、搅拌速度、乙醇体积分数和液料比,着重研究了提取液中甾醇质量浓度与提取温度和提取时间的关系;考虑到物料是片状,尝试用基于费克第二定律的一级平板动力学模型对实验数据进行了拟合;计算了提取过程的表观活化能、甾醇质量浓度的半衰期、物质分子的内扩散系数及甾醇的相对萃余率等动力学参数;同时计算了提取过程的吉布斯自由能、焓变及熵变等热力学参数,以期为工业化应用提供参考。
1 材料与方法
1.1 材料、试剂及仪器
大豆荚(老,晒干);豆甾醇(标准品)、CH3CH2OH(100%,AR)、H2SO4(98%,AR)、H3PO4(85%,AR)、FeCl3·6H2O(AR)。
HL-26型多功能食品粉碎机,DK-S24型电热恒温水浴锅,WFJ型可见分光光度计,800B型离心机。
1.2 方法
1.2.1 原料预处理
将大豆荚用粉碎机粉碎成小碎片(尺寸约为5~10 mm),再置于鼓风烘箱50 ℃下干燥至恒重,后根据实验投料量称量、包装待用。
1.2.2 甾醇提取
设置恒温水浴,安装三口烧瓶和回流冷凝器,取原料样,加入三口烧瓶,按一定的液料比将相关体积分数的乙醇溶液亦投入三口烧瓶,150 r/min搅拌,甾醇提取。预实验时,到预定时间结束提取,取样,离心,取上清液,测定。动力学实验时,每个提取实验均每隔一定时间取样,离心,取样,分析,至甾醇浓度不再升高时结束。
1.2.3 甾醇质量浓度测定和计算
甾醇的质量浓度参照文献[11,12]所述的磷硫铁法进行分析测定,基本步骤为:
磷硫铁显色剂配制:先用浓磷酸配制10%的FeCl3溶液,再取其用浓硫酸配制磷硫铁显色剂。
标准曲线绘制:精密称取豆甾醇标样,用无水乙醇溶解并定容,再配制所需浓度的豆甾醇使用液,取一系列不同量的使用液分别用无水乙醇定体积,加入同样量磷硫铁显色剂,室温显色15 min,待冷却后于520 nm波长在分光光度计中测各吸光度,建立横坐标为质量浓度、纵坐标为吸光度的图线,线性拟合出两者的关系式。
样品测定:准确取样,加无水乙醇稀释,再加磷硫铁显色剂,显色,测吸光度,用标准曲线计算出样品液中的总甾醇质量浓度。
因动力学实验需对每个提取实验每隔一定时间取一次样,而每次取样均会使继续提取的溶液体积减小,进而会使所测得浓度发生偏差,故需对每次取样测定的甾醇质量浓度按式(1)进行校正[13]。
(1)
式中:Cn为第n次取样分析得到的甾醇质量浓度修正值/mg/mL;C'n为第n次取样分析得到的甾醇质量浓度测定值/mg/mL;Ci为第i次取样分析得到的甾醇质量浓度修正值/mg/mL;VT为投料初始提取液的总体积/mL;Vi为第i次取样的样品体积/mL。
1.2.4 实验设计
先进行单因素考察预备实验,确定合适的物料形状、搅拌速度、乙醇体积分数和液料比;后在适宜的提取条件下研究提取液甾醇质量浓度与提取温度、提取时间的关系,每次实验每隔适当的时间进行取样和分析,计算和校正样品甾醇质量浓度,实验至甾醇质量浓度不再升高时结束。
1.2.5 动力学模型与参数
1.2.5.1 动力学模型
从固体物料中提取有效成分的过程,机理比较复杂,不同的成分或多或少同时被萃出,但一般由三步构成整个过程,先是溶剂向固体物料内部渗透、将物料浸润并将有效成分溶解;再是被溶解到溶剂中的成分在浓度差的作用下以分子扩散的形式从物料内部传递迁移到固液界面;最后是有效成分穿过界面从固相向液相传递、进一步或以分子扩散或以对流传质形式向溶液主体传递[13]。在有搅拌的情况下,由于是强制对流传质,固液界面间与界面到溶液主体的传质阻力可以忽略,则提取过程的传质阻力基本集中在固相,即提取过程属内扩散控制;物料中的有效成分一迁移到固相表面,迅即传递至液相主体,液相浓度均匀。有效成分的提取过程由于随提取时间的推移其固相浓度不断减小、液相浓度不断升高,传质推动力不断减小,最后达到平衡,故该过程是不稳定扩散。考虑到大豆荚物料呈片状,为了便于分析,现尝试将一定温度下从大豆荚中提取甾醇的过程用基于费克第二定律的一级平板动力学模型来描述。以单片物料为对象,并假设:1)物料小碎片的厚度均匀;2)有效成分的传质方向是沿碎片厚度方向进行;3)提取初始碎片内各成分均匀分布;4)忽略碎片表面的传质阻力且有效成分的内扩散系数保持不变;5)碎片物料与溶液的温度相同,且温度稳定;则提取过程可用式(2)表达[13]。
(2)
式中:C0为提取液中甾醇的初始质量浓度/mg/mL;Ct为t时刻甾醇的质量浓度(取样分析后的修正值,下同)/mg/mL;C*为提取平衡时的甾醇质量浓度/mg/mL;t为提取时间/min;Ds为内扩散系数/m2/min;L为分子扩散传质距离,物料片厚度的一半/m。
不稳定传质的浓度分布式是一无穷级数,计算时一般取第一项即可,故式(2)可简化为式(3)。
(3)
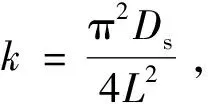
(4)
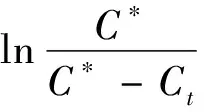
1.2.5.2 表观活化能
传质速率常数k、提取温度T两者间的关系符合阿累尼乌斯方程,如式(5)[13-15]。
k=k0e-Ea/(RT)
(5)
式中:k为传质速率常数/1/min;k0为指前因子/1/min;R为气体常数,8.314 J/(mol·K);T为提取温度/K;Ea为表观活化能/J/mol。将式(5)两边取对数,转化为式(6):
(6)
将lnk与1/T作图,线性拟合,由直线斜率即可求得表观活化能Ea之值。
1.2.5.3 半衰期
当物料中甾醇质量浓度降至其原有质量浓度一半时所需的提取时间称为半衰期(t1/2),即:当t=t1/2时,Ct=C*/2,将其代入式(4)即可整理出计算半衰期的式(7)[15]:
(7)
将各提取温度下求得的k、C0和C*值代入式(7)可求得各提取温度下的半衰期。作t1/2~T图,拟合,可得t1/2与T两者间关系式。
1.2.5.4 内扩散系数
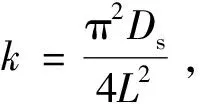
1.2.5.5 相对萃余率
相对萃余率Y是指经萃取后溶质留在物料中的量的比例,采用质量浓度来表达,则Y的表达式可写为式(8)[16]:
(8)
利用实验数据即可求出各提取温度下的Y值,并通过作Y~t图,拟合出两者间的关系式。
1.2.6 热力学分析
当甾醇的提取达到动态平衡时,提取过程的平衡常数K、热力学参数吉布斯自由能ΔG、焓变ΔH和熵变ΔS及提取温度T之间的关系可由范特霍夫方程表达[16,17],见式(9)。
(9)
式中:K为提取过程中的平衡常数;C∞为提取的甾醇最大质量浓度/mg/mL;ΔG为过程吉布斯自由能/kJ/mol;ΔH为过程焓变/kJ/mol;ΔS为过程熵变/J/(mol·K);C*、R与T如上。
由式(12)就可计算出大豆荚甾醇提取过程的K、ΔG、ΔH和ΔS值。
2 结果与讨论
2.1 提取实验
2.1.1 预备实验
在进行动力学提取实验之前,为了确定比较合适的提取条件,进行了单因素考察实验。分别研究了物料形状、搅拌速度、乙醇体积分数、液料比等对甾醇提取的影响。结果得出:5~10 mm的小片状物料(将整个豆荚破碎)、搅拌速度150 r/min、乙醇体积分数70.0%、液料比25.0 mL/g下提取甾醇有较好的效果。因此动力学提取实验,即提取温度、提取时间对甾醇提取的影响实验,采用小片状物料、150 r/min搅拌、乙醇体积分数70.0%、液料比25.0 mL/g。
2.1.2 动力学提取实验
小片状物料、70.0%乙醇体积分数、25.0 mL/g的液料比,在搅拌速度为150 r/min下,进行了323、333、343、353与363 K下的动力学提取实验,测定不同提取温度下提取液中甾醇质量浓度随时间的变化关系,结果见图1。随着提取温度的升高,相同提取时间得到的甾醇质量浓度越高,提取液中甾醇质量浓度达到最高值所需时间就越短,能达到的最高质量浓度也越高。这是因为随着提取温度的升高,细胞破壁时间缩短、物质分子渗透能力增强、扩散系数增大、从而甾醇能更快地被从物料中提出;同时甾醇在溶液中的溶解度增加,溶液黏度的降低又减少了传质阻力,进而加快了传质速度,使得甾醇提出加快、量增多、时间缩短[18]。
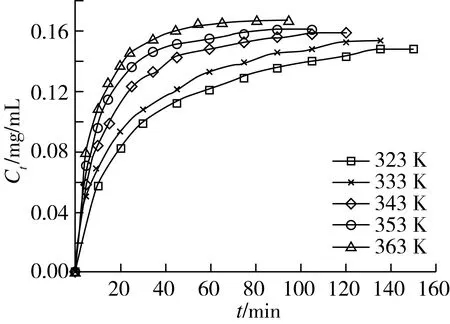
图1 不同温度下Ct~t的关系
2.2 动力学
2.2.1 模型拟合
将2.1.2获得的不同提取温度下不同提取时间甾醇质量浓度的实验数据,用一级平板动力学模型进行拟合,即转换成ln[C*/(C*-Ct)],并将其对提取时间t作图,结果见图2。图2中各实验温度下实验点线性拟合及计算得到的结果见表1。
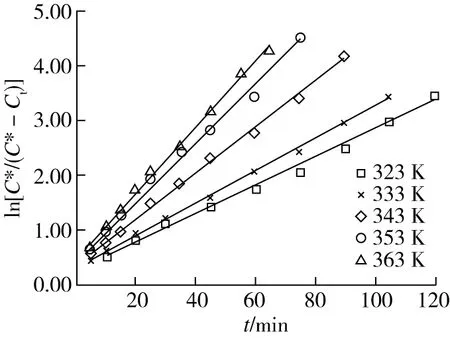
图2 不同温度下ln[C*/(C*-Ct)]~t的关系
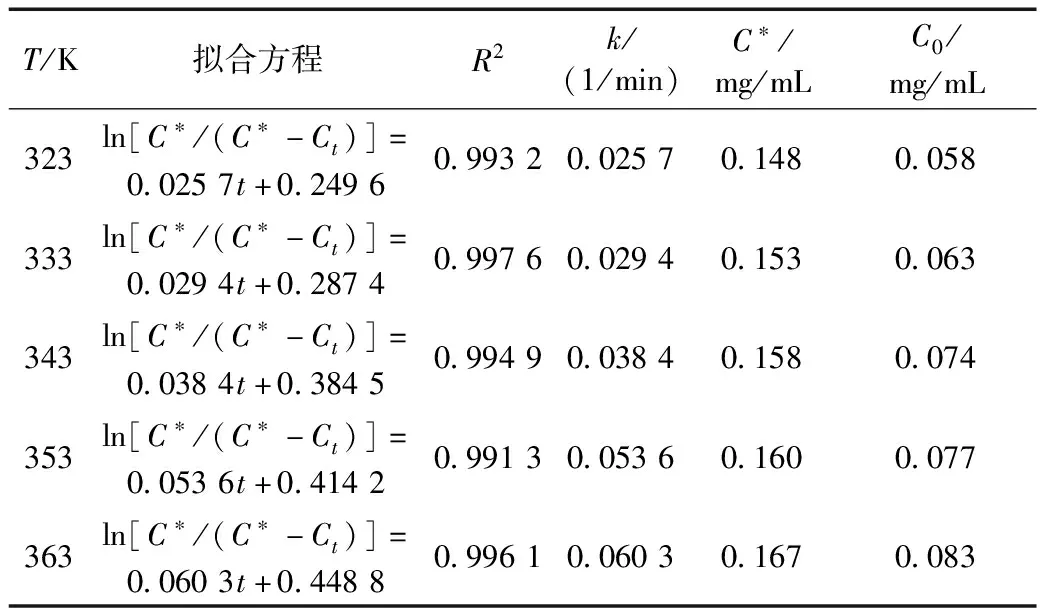
表1 不同温度下ln[C*/(C*-Ct)]和t的关系及参数
从表1数据可看出,各提取温度下实验数据拟合得到的关系线性良好,线性回归系数R2均大于0.99,表明可用一级平板动力学模型来描述大豆荚甾醇提取过程;同时表1数据显示随提取温度增大,直线斜率k值逐渐增大,表明升高提取温度有利于大豆荚甾醇的提取,即甾醇提取速率获得增大;其主要原因是增大了分子扩散系数、降低了液体黏度、增加了溶解度等。
2.2.2 表观活化能
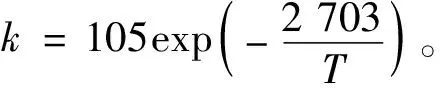
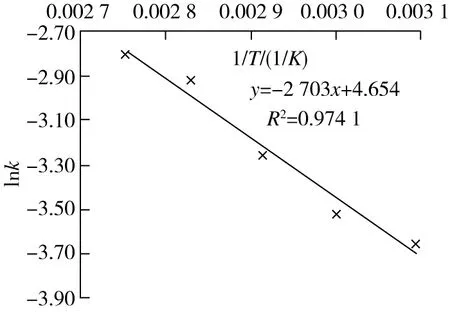
图3 lnk~1/T的关系
2.2.3 半衰期
将表1中各提取温度下的k值、C0值与C*值代入式(7),计算可得各提取温度下的半衰期t1/2,作t1/2~T图,结果见图4。从图4可以得到结果:半衰期t1/2与提取温度T可以拟合成幂函数,两者间关系为t1/2=4×1034T-13.27,回归系数R2>0.95,关系良好;半衰期随提取温度的增大而减少,提取温度从323 K升高到363 K,半衰期从17.3 min降至4.1 min;原因是提取温度升高使甾醇提取速率加快。
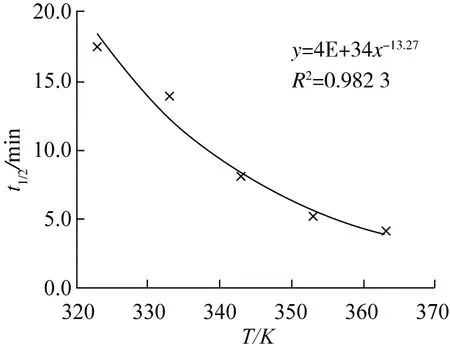
图4 t1/2~T的关系
2.2.4 内扩散系数
干大豆荚片厚大约为0.000 2 m,由于组织结构紧致,故在溶液中也没有明显膨胀;因传质距离为片厚的一半,故L取0.000 1 m。用表1中各提取温度下的k值据其的定义式,可求得对应的内扩散系数Ds,并作Ds~T图,结果见图5。Ds值随提取温度从323 K升至363 K而从1.04×10-10m2/min增大到2.45×10-10m2/min,这是因为提取温度越高,溶液黏度越小,分子热运动越强,分子扩散就越快。图5表达了两者可拟合成幂函数关系,回归系数R2>0.95,Ds与T的关系可表示成Ds=2×10-20T7.898 4。
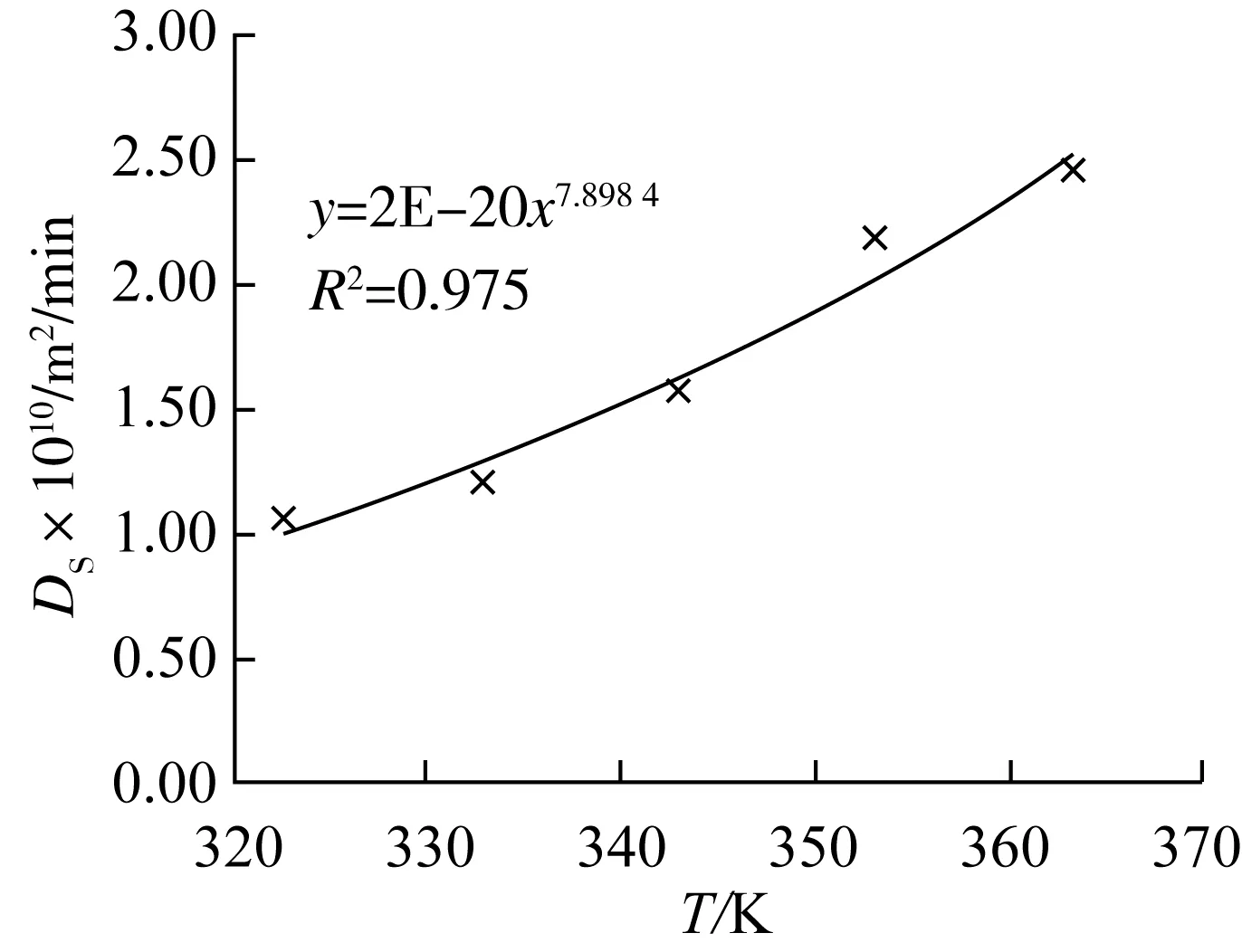
图5 Ds~T的关系
2.2.4 相对萃余率
根据实验数据按式(9)计算各提取温度下的相对萃余率Y并作Y~t图,结果见图6。随提取温度升高或提取时间延长,相对萃余率降低;同一提取温度下随时间的降幅先快后慢,说明在提取的前期,特别是前10 min,溶质会被大量提出,但中后期速度放慢,所以综合考虑提取效果和设备大小、能力等,并不是提取时间越长越好。图6同时显示了各提取温度下Y与t呈现指数关系,各关系式见图6,各式的R2>0.98。
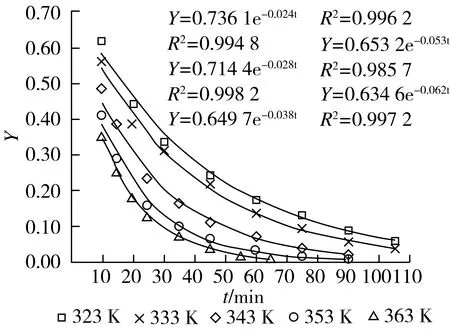
图6 Y~t的关系
2.3 热力学分析
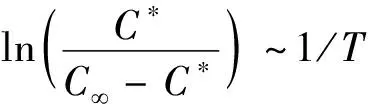
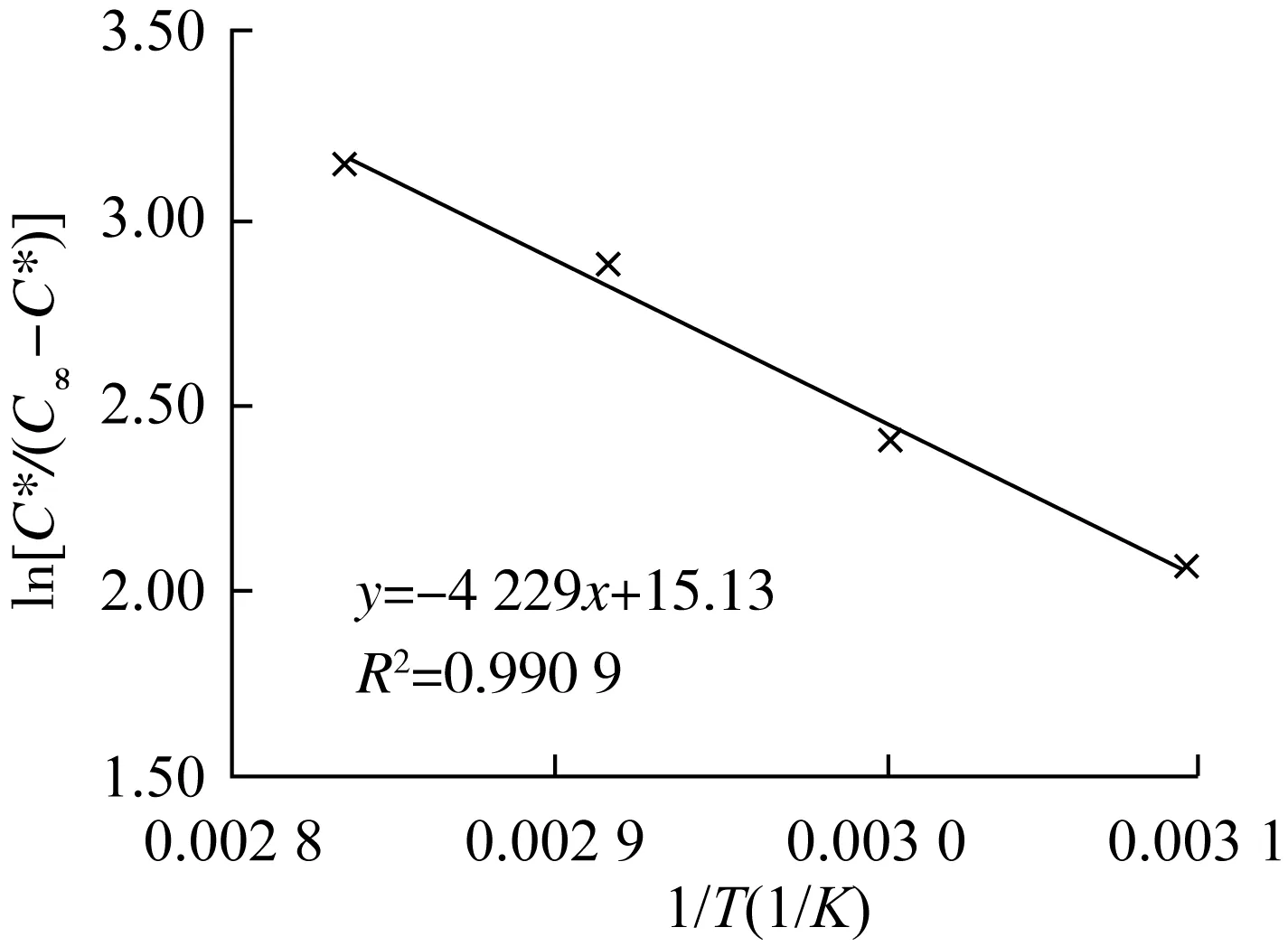
图7 ln[C*/(C∞-C*)]~1/T的关系
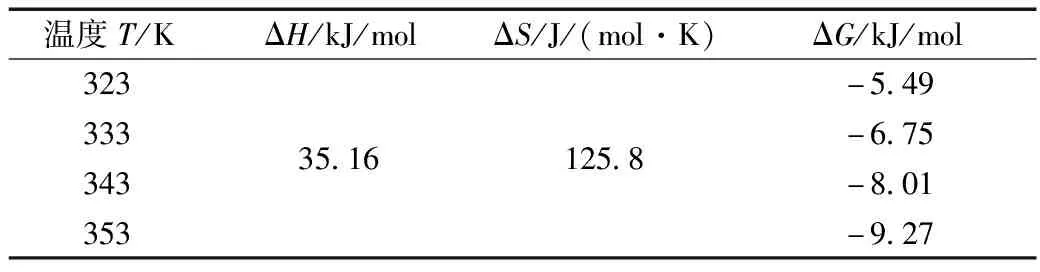
表2 不同温度下的ΔH、ΔS、ΔG值
在实验的提取温度范围内,提取过程的ΔH值和ΔS值分别为35.16 kJ/mol和125.8 J/(mol·K),均大于零,表明该甾醇提取过程吸热、熵增;各提取温度下的ΔG值均小于零,表明提取过程可自发进行,且ΔG值随提取温度增大而逐渐减小,表明增大提取温度可使提取更易进行[18]。
3 结论
研究了用乙醇溶液从碎片状的大豆荚中提取甾醇,在研究条件内,随提取温度的升高,提取液中甾醇的平衡质量浓度增大,达到提取平衡所需的时间缩短;一级平板动力学提取模型能较好地描述甾醇的提取过程;得到甾醇提取过程的表观活化能为Ea=22.47 kJ/mol,半衰期与提取温度的关系式可表达为t1/2=4×1034T-12.27,表现为半衰期随提取温度增大而减小;内扩散系数与温度的关系式可表达为Ds=2×10-20T7.898 4,表现为内扩散系数随提取温度增大而增大;该提取过程的吉布斯自由能ΔG小于零,表明提取过程能自发进行;提取过程的焓变大于零,ΔH=35.16 kJ/mol,表明提取过程是一个吸热过程;提取过程的熵变大于零,ΔS=125.8 J/(mol·K),表明过程熵增。研究结果可为大豆荚甾醇提取工艺条件设计与优化、设备设计及过程控制等提供参考。
