大豆β-伴球蛋白脱糖基化及其酶解后抗原活性变化
2021-01-09王章存安广杰胡金强赵学伟贺志铮
王章存 刘 洋 安广杰 胡金强 赵学伟 贺志铮
(郑州轻工业大学食品与生物工程学院1,郑州 450001)(河南省食品安全国际联合实验室2,郑州 450001)
大豆蛋白是食品工业中常用的植物蛋白。但大豆也是国际公认的八大过敏原食物之一,可引起人体腹泻、皮疹、咽喉水肿和急性哮喘等症状[1],影响了大豆蛋白的食用价值。大豆中的致敏成分均是蛋白质,目前在大豆中发现有38种蛋白质具有致敏现象。大豆中的储藏蛋白也是主要的致敏蛋白,其中大豆β-伴球蛋白是大豆中最重要的一种抗原蛋白[2]。该蛋白是由α′(57~83 ku)、α(57~76 ku)和β(42~53 ku)3种亚基组成的分子质量为150~210 ku的三聚体,其聚合形式包括ααα、ααα′、αα′β、ααβ、αββ、α′ββ等)[3]。常规的食品加热和酶解处理难以消除大豆β-伴球蛋白的抗原活性[4-7],但酶解处理相较而言是更有效的手段,能在显著降低大豆蛋白抗原性的同时提高蛋白的多种功能特性如溶解性、乳化性、发泡性等[8,9],风味蛋白酶是蛋白质酶解时常用的酶制剂之一,与其它酶制剂相比,其特点是可以从肽链羧基末端切除氨基酸,在去除苦味,改善口感的同时,还能提高蛋白有效利用率并降低生产成本。此外有研究表明糖基化反应能通过大豆蛋白与糖结合后发生结构变化降低蛋白抗原性[10]。β-伴球蛋白是含糖量约为5%的糖蛋白[11],其3个亚基被N-糖链所修饰[12],它们富含甘露糖[13]。糖基化修饰蛋白质不仅影响蛋白质的空间构象、生物活性、运输和定位,而且在分子识别、细胞通信、信号转导等特定生物过程中发挥着至关重要的作用[14,15],而β-伴球蛋白中的糖组分在其致敏反应中的地位和作用是目前研究的重要内容[16,17]。本研究通过β-伴球蛋白脱糖前后及其在酶解过程中蛋白质分子成分和抗原性的变化,研究糖链对β-伴球蛋白的抗原活性的影响及其在酶解过程中的作用,为有效降低或消除大豆蛋白的抗原性提供参考。
1 材料与方法
1.1 主要材料与试剂
大豆β-伴球蛋白(参考Nagano方法[18]实验室自制,纯度约92%),风味蛋白酶,N-糖苷酶PNGase F,大豆β-伴球蛋白酶联免疫分析(ELISA)试剂盒,标准分子质量蛋白质,考马斯亮兰R250,其它化学试剂均为分析纯。
1.2 主要仪器与设备
DF-101S集热式磁力搅拌器,DYY-7C 型电泳仪,DYCZ-24DN型电泳槽,iMark酶标仪,FD-1A-50冷冻干燥机,UV-8100B紫外-可见分光光度计。
1.3 方法
1.3.1 β-伴球蛋白的脱糖基化
参照Amigo-Benavent方法[17]释放N-糖链。主要步骤:取β-伴球蛋白冻干样品每8 mg溶于800 μL蛋白变性液(0.4 mol/L DTT, 5% SDS),于沸水中加热10 min。待样品冷却至室温后,加入80 μL的磷酸缓冲液(0.5 mol/L, pH 7.5), 80 μL的NP-40(10%)和8 μL的PNGase F溶液,于37 ℃恒温酶解24 h后100 ℃水浴加热10 min灭酶。之后将样品用Sep-Park C18微柱将糖和蛋白质分离。
1.3.2 糖含量分析
苯酚-硫酸法测定。参考张惟杰方法[19]进行。主要过程,样品1.0 mL、6%苯酚0.5 mL、浓硫酸5.0 mL,混匀后并在室温静置10 min后,于490 nm处测定光吸收值。以葡萄糖为标准品制作工作曲线。
1.3.3 β-消去反应判断糖蛋白质O-连接
参考文献[20]方法。主要步骤是:将大豆β-伴球蛋白溶解在0.1 mol/L NaOH溶液,并于45 ℃保温18 h。反应结束后,冷却至室温,于220~270 nm进行光谱扫描。对照样品用水处理。比较两种样品在240 nm处光谱变化。
1.3.4 脱糖和原始β-伴球蛋白的酶解
β-伴球蛋白的酶解:将β-伴球蛋白配制成5 mg/mL的溶液,按1.3.1方法加入蛋白变性液并沸水浴加热10 min。冷却水温至55 ℃后,用2 mol/L的HCL溶液调节pH 6.5,按照酶与蛋白质比例1∶100(E/S)加入风味蛋白酶,磁力搅拌器恒温搅拌下酶解反应;在酶解0、10、30、60、90、120、150、180 min时分别吸取100 μL酶解液于离心管,立即置于100 ℃水浴加热10 min终止酶解反应。然后样品于-20 ℃保存备用。
脱糖后β-伴球蛋白也按上述相同的方法和条件酶解、取样和保存。
1.3.5 SDS-PAGE分析
根据Laemmli[21]的方法,采用不连续垂直SDS-PAGE系统。分离胶质量分数为12%,浓缩胶质量分数为5%,上样量为15 μL。浓缩胶恒压80 V,分离胶恒压110 V。考马斯亮蓝R250染色,脱色后拍照。
1.3.6 酶解产物抗原活性测定
采用竞争法大豆β-伴球蛋白ELISA试剂盒测定。样品用纯水稀释50倍后,按照试剂盒说明书的步骤操作,在酶标仪中测定β-伴球蛋白标准品和测试样品的OD值。每份样品重复三次。以标准品的工作曲线计算样品测定结果。数据采用ORIGIN 8.0软件处理。以未酶解原β-伴球蛋白的抗原活性为基数,计算脱糖和未脱糖样品及其酶解产物的抗原活性剩余率,即:抗原活性剩余率=(样品抗原活性÷原β-伴球蛋白抗原活性)×100%
2 结果与讨论
2.1 大豆β-伴球蛋白的脱糖效果分析
糖与苯酚-硫酸反应的产物有特征性光吸收特征,在490 nm处有最大吸光值。根据此原理,将脱糖前后的β-伴球蛋白经硫酸-苯酚反应后的光吸收曲线如图1所示。可以看出,β-伴球蛋白的反应产物在490 nm处吸光值较高,脱糖后的β-伴球蛋白吸光值很低,表明糖苷酶起到了较好的脱糖效果。
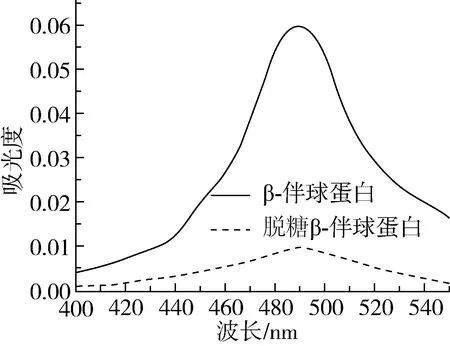
图1 脱糖前后β-伴球蛋白与苯酚-硫酸反应物光吸收特征
为了进一步验证β-伴球蛋白经脱糖酶PNGase F处理后脱下的糖含量,将脱糖样品经苯酚-硫酸反应后,并用葡萄糖为标准品制作工作曲线,测定结果换算为β-伴球蛋白含糖量为(4.13±0.6)%,与文献中报道的含糖量5%的结果接近[11]。需要说明的是,关于大豆β-伴球蛋白含糖量的文献报道极少,而且除了N—连接的糖链外,还含有O—连接糖成分[22]。
为了进一步确定大豆β-伴球蛋白O—糖链的存在,本研究通过β-消去反应分析反应前后蛋白质样品光吸收特征(图2)。可见经β-消去反应后,大豆β-伴球蛋白在240 nm处凸起一个明显的峰,表明大豆β-伴球蛋白中含有O-糖肽键。本研究仅采用PNGase F酶特异地切除糖蛋白中的N—糖肽键,它可以在释放N—糖链的同时保持蛋白质肽链的完整性。

图2 大豆β-伴球蛋白经β-消去反应前后的光吸收曲线
2.2 脱糖前后β-伴球蛋白组分在酶解过程中的变化
将脱去N-糖链的大豆β-伴球蛋白和原β-伴球蛋白分别在相同的条件下,用风味蛋白酶水解,将不同酶解时间的产物做SDS-PAGE,结果如图3所示。
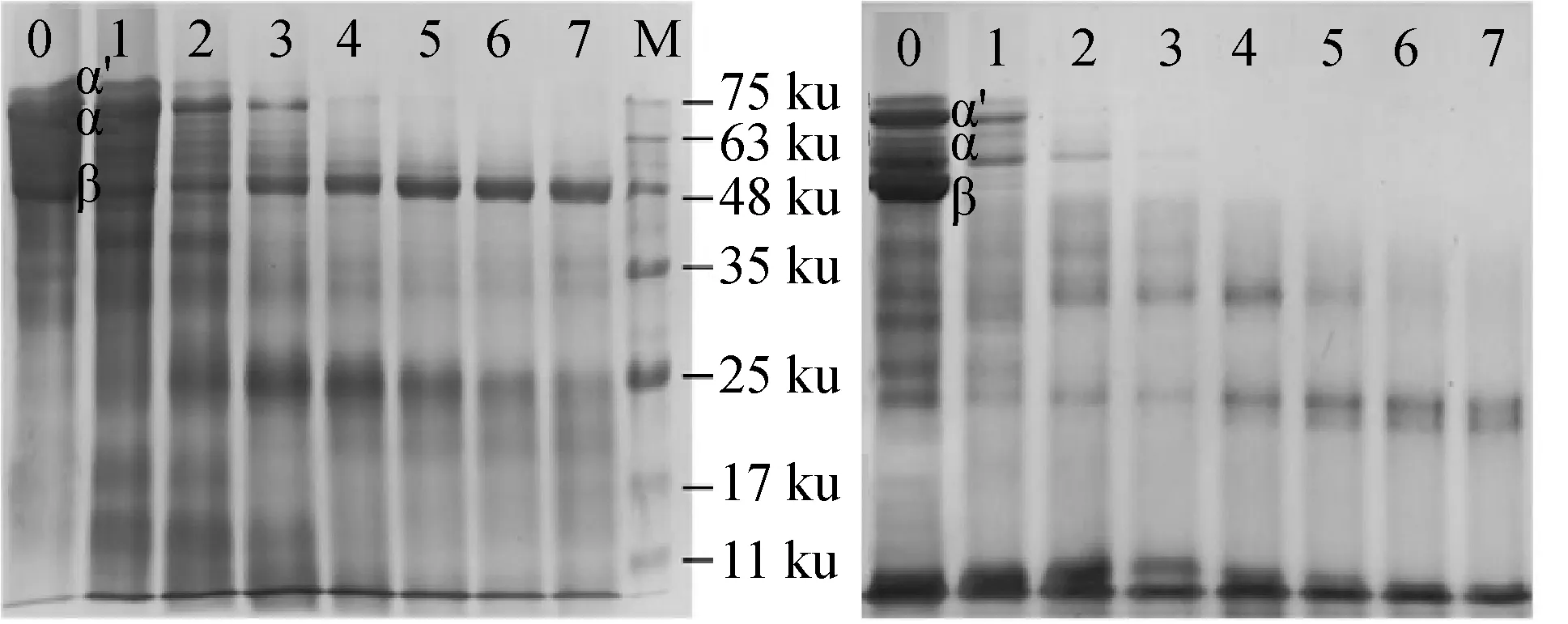
a 未脱糖β-伴球蛋白酶解物 b 脱糖β-伴球蛋白酶解物
从图3可知,脱糖与未脱糖β-伴球蛋白的酶解产物的电泳行为有显著差异:原β-伴球蛋白α-、和α′-亚基在酶解的初始阶段很快消失,β-亚基在持续酶解180 min内变化不大,酶解时新生成了25 ku组分,在延长酶解时间过程中,这些新成分也难以消失。这种现象与文献中报道的用碱性蛋白酶、胃蛋白酶水解时的结果相似[7,23]。
脱糖后的β-伴球蛋白在酶解的前10 min时就几乎完全消失,同时新生成了约37、33 ku的肽链,酶解90 min时又新生成25 ku组分。而原β-伴球蛋白酶解过程中没有产生37、33 ku组份。Amigo-Benavent等[17]研究发现,用胃肠液酶解2 h后,原β-伴球蛋白β-亚基仍然存在,而脱糖后的β-伴球蛋白β-亚基则完全消失。但该文献没有考查不同酶解时间条件下两种蛋白质谱带的变化规律。以上结果表明,β-伴球蛋白中糖链的存在,影响蛋白酶的水解行为。
2.3 脱糖与未脱糖β-伴球蛋白酶解过程中的抗原性变化
根据图4可看出,β-伴球蛋白经过脱糖处理后,其抗原活性明显降低,仅有原β-伴球蛋白抗原活性的60.1%。此结果表明,β-伴球蛋白中的糖成分对其抗原活性有很大的贡献。
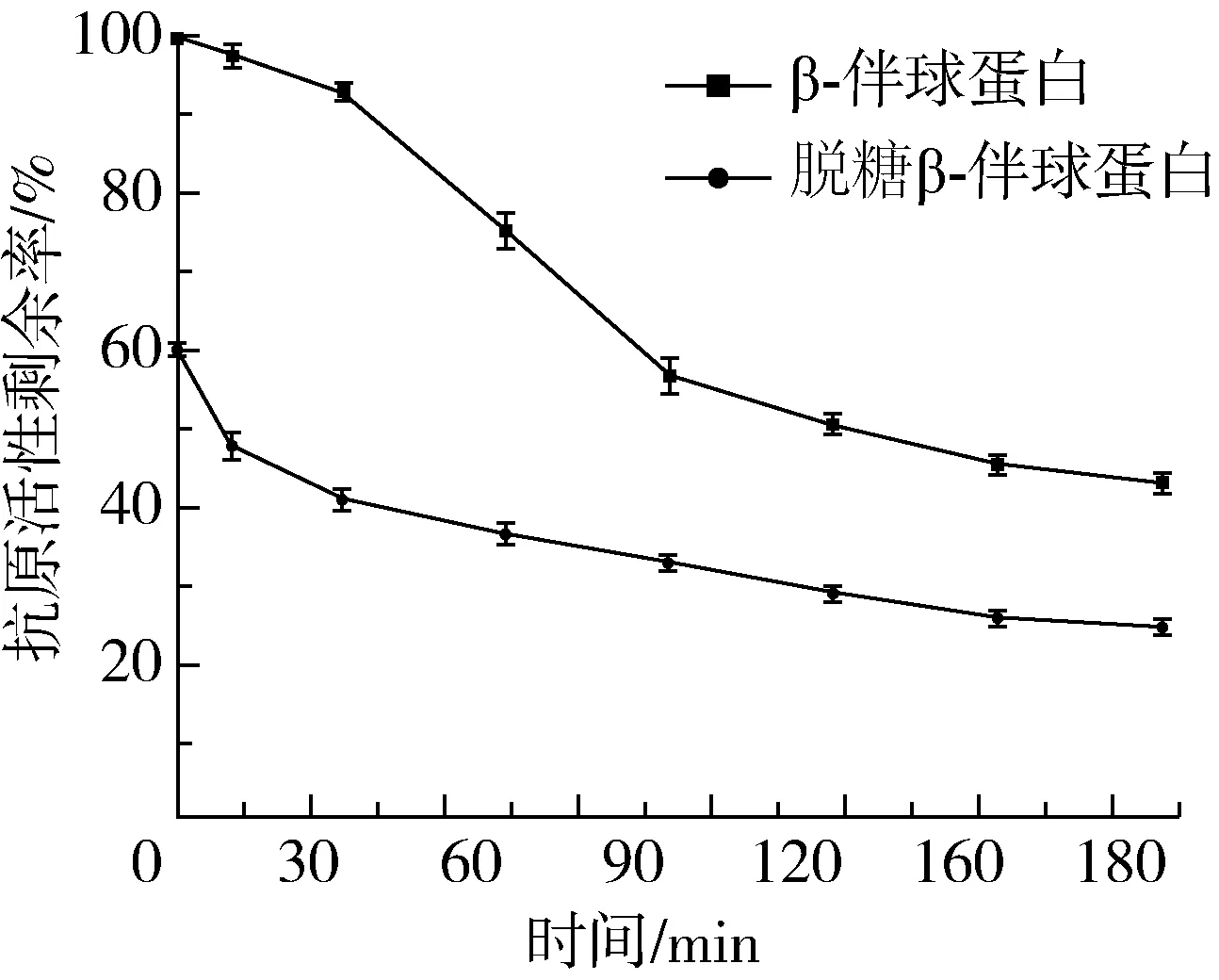
图4 酶解过程中原始与脱糖β-伴球蛋白的抗原活性剩余率
β-伴球蛋白酶解反应前期抗原活性降低幅度较大,酶解90 min下降为57.0%,此阶段也是α′-和α-亚基条带逐渐消失的时间(图3),这一阶段抗原活性的降低,可能是由于α′、α亚基被酶解后,其空间结构发生变化,构象表位遭到破坏,也可能有序列型抗原表位被破坏,从而降低了其抗原活性。在90~180 min时,抗原活性下降的趋势有所减弱,180 min时抗原活性剩余43.4%,可能是随着构象表位的减少,酶与抗原蛋白的结合位点也随之减少、酶解速率下降,减小了抗原活性的下降幅度。这种变化趋势与文献中的研究结果相似[3,24]。
脱糖后的β-伴球蛋白酶解过程中抗原性的变化行为与原β-伴球蛋白也有明显不同。虽然随着酶解时间的延长其抗原性逐渐降低,但没有明显的断崖式降低现象,酶解180 min后抗原活性剩余25.0%。这表明与糖链存在有相关性。此结果不仅支持文献[25]中β-伴球蛋白去糖基化后与其IgE抗体特异性结合的活性降低或消失的结论,而且也证明蛋白质脱糖后酶解行为与酶解产物的抗原活性的变化有直接关系。关于β-伴球蛋白中糖与蛋白的连接位点、糖链成分、结构信息及其影响酶解和抗原性的机制有待于进一步深入研究。
3 结论
用PNGase F酶可以有效脱除大豆β-伴球蛋白中N-糖肽键,但β-消去反应证明该蛋白质中还有O-连接糖成分;脱糖后的蛋白抗原活性显著降低;脱去N-糖链前后的β-伴球蛋白在风味蛋白酶水解过程中,其亚基组分和抗原性的变化趋势具有明显差异。结果表明N-连接糖组分的存在是β-伴球蛋白具有抗原性的重要因素。
