戊二醛制备工艺的关键技术研究
2021-01-09
(中国石化上海石油化工股份有限公司,上海 200540)
戊二醛(GA)是一种极为重要的化工原料,因其具有优良的固化、胶联蛋白质的功能,被誉为第三代化学灭菌剂,同时它还是优良的鞣革剂,组织固化剂、蛋白质胶联剂和高效杀菌消毒剂[1-3]。目前广泛应用于石油开采、医疗卫生、生物化学、蛋白质交联剂、皮革柔软剂、生物酶和细胞的固化、食品和化妆品的防腐、微胶囊固化、电子显象管的坚膜剂以及有机合成等方面。其中,作为杀菌剂和皮革柔软剂的用量最大,国内市场基本依赖进口。
戊二醛合成方法主要有吡喃法(丙烯醛法)、吡啶法、多元醇氧化法、戊二酸法、环戊烯法等[4-8],其中吡啶法因其原料消耗大、成本高、污染大、产品质量差而被淘汰;戊二醇氧化法虽然反应路线短,但其氧化深度不易控制、收率低、原料短缺且生产成本高,实现工业化的可能性也并不大;吡喃法[9-11]所用原料丙烯醛价格昂贵,而且丙烯醛和乙烯基乙醚沸点低,运输不便。因此以环戊烯为原料,通过选择性氧化制备戊二醛受到青睐,该法具有原料丰富,反应条件易实现等优点。
环戊烯氧化制备戊二醛的催化过程主要包括均相和非均相催化。从已报道[12-14]的催化反应体系结果来看,以钨基非均相(多相)催化剂效果最佳(戊二醛收率往往超过50%)。而对于以钨酸为催化剂的制备工艺,虽然具有反应温度低,常压操作,转化率高和收率高的特点,但是均相催化反应结束后催化剂不易回收,因此最新的研究较多采用多相催化氧化,催化剂通常为含钨元素的固相催化剂,使用这些催化剂可使环戊烯获得一个较为理想的转化率,缺陷是目标产物的选择性比较低,戊二醛平均收率一般都在70%以下,且主要副产物1,2-环戊二醇、环戊烯环氧化合物和戊二酸等的沸点要高于戊二醛,加之戊二醛化学性质活泼、易聚合,在分离过程中易发生反应,难以制备出适于医用的戊二醛产品。
针对上述缺陷,本文进行了高性能负载型催化剂的制备和筛选,并通过反应进程的控制以及工艺条件的优化,提高反应的选择性,便于分离得到合格的产品。最终获得环境友好的绿色工艺路线。
1 实验部分
1.1 工艺流程
1.1.1 单釜工艺流程
单釜流程图见图1。在装有回流冷凝管的三口烧瓶中,按一定比例分别加入催化剂、溶剂叔丁醇(TBA)和30%的过氧化氢水溶液,加热至30℃时开始滴加环戊烯,然后保持反应温度至设定值,在不同时间取样分析戊二醛浓度。
1.1.2 多釜工艺流程
多釜工艺流程简图见图2,每釜的操作方法与单釜基本相同,按一定比例加入原料环戊烯、溶剂和催化剂,采用分段实验,双氧水(总加入量不变)分段加入第一氧化反应器、第二氧化反应器和第三氧化反应器,通过调整双氧水的加入量和过氧化氢在催化剂表面的浓度,以及反应时间从而控制反应的进程。
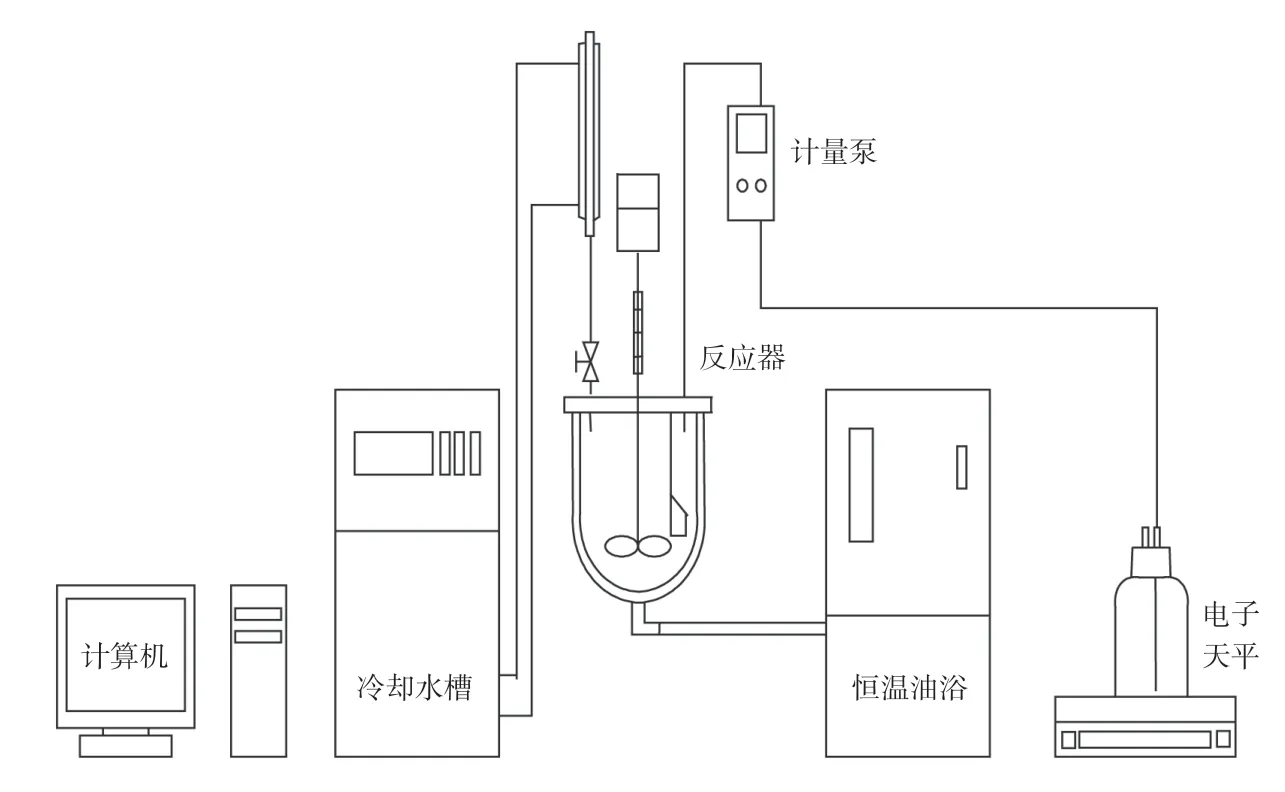
图1 单釜氧化工艺流程图Fig.1 Flow chart of single kettle oxidation process
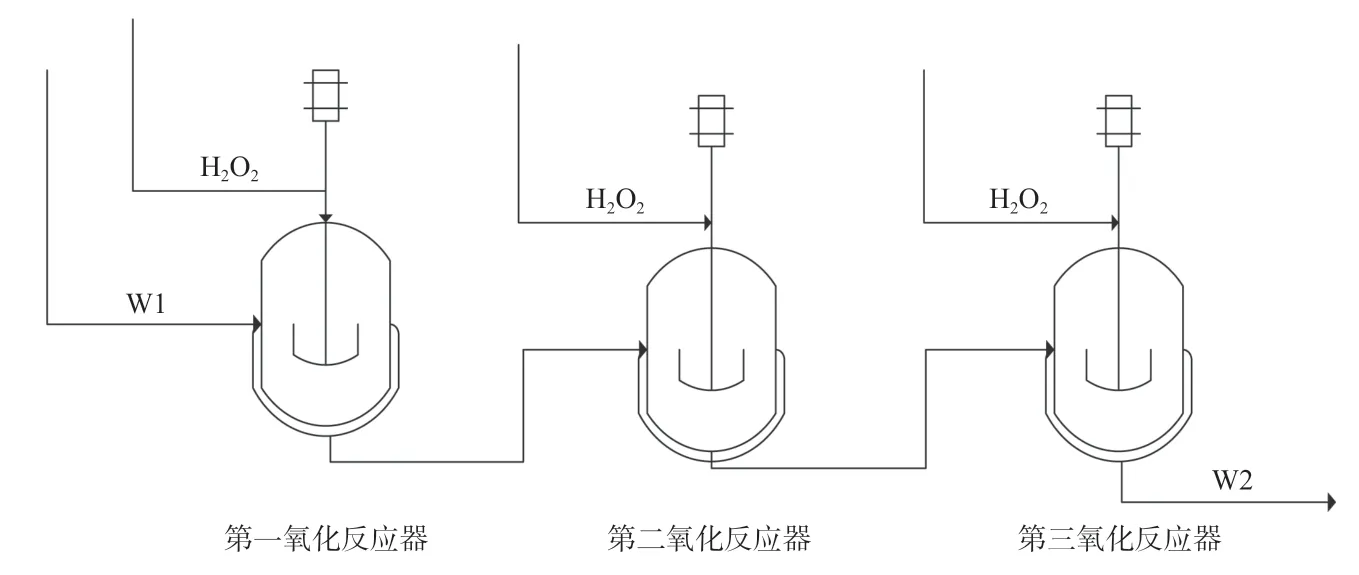
图2 多釜氧化工艺流程图Fig.2 Flow chart of multi-tank oxidation process
1.2 反应机理和主要方程式
根据文献[15-16]报道,在钨酸催化剂-有机溶剂(叔丁醇等醇类)体系中,环戊烯在催化剂的作用下,首先被过氧化氢氧化生成环戊烯氧化物(CPO),然后再转化成中间产物β-羟基环戊基过氧化氢,最后中间产物受WOOH 活性基团的催化,转化为戊二醛。主要副产物是1,2-环戊二醇和2-叔丁氧基-1-环戊醇,它们是环戊烯氧化物由水和醇通过亲核进攻生成,如图3所示。
如反应温度偏高或反应时间过长时,1,2-环戊二醇和戊二醛继续与过氧化氢反应生成戊二酸[17],反应方程式如下:
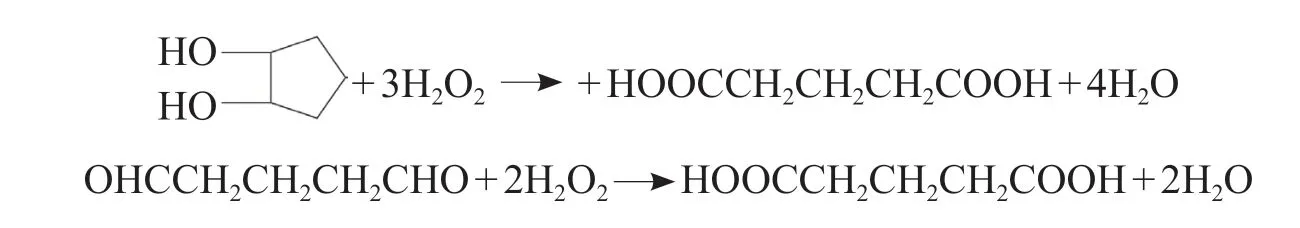
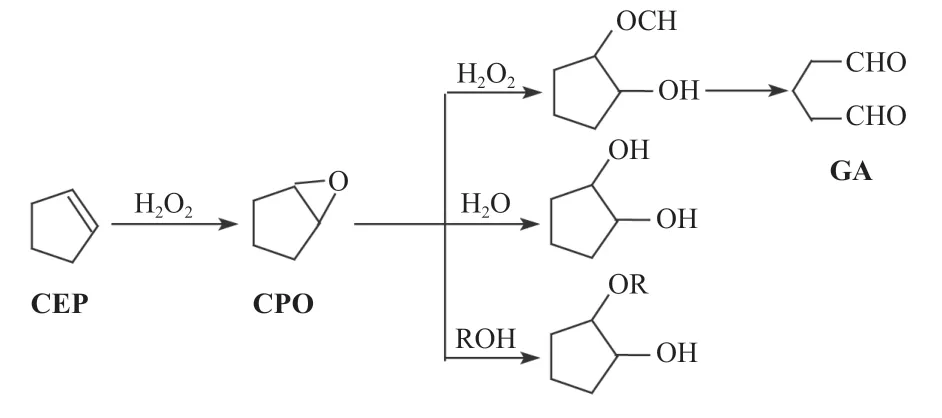
图3 环戊烯合成戊二醛反应历程Fig.3 Reaction process of cyclopentene synthesizing glutaraldehyde
1.3 分析方法
本课题实验内容主要涉及环戊烯氧化反应、戊二醛的分离以及催化剂等,分析方法见表1。

表1 实验涉及分析方法Tab.1 Analytical methods involved in the experiment
2 实验结果与讨论
对于环戊烯的氧化反应,催化剂的性能、溶剂的选择、工艺条件的优化及反应过程的控制是关键步骤,本次试验针对这四个方面展开研究。
2.1 催化剂的性能评价
制备了不同种类的负载型催化剂,并综合各因素的影响,在催化剂∶叔丁醇∶过氧化氢∶环戊烯(质量比)=0.2∶6∶3∶1,温度35 ℃,时间24 h 的条件下进行了试验和比较,其结果如表2所示。
从表2 可以看出,原位合成的一系列含钨介孔催化剂具有好于均相及传统浸渍方法制备的催化剂的催化性能,如采用催化剂W-SBA-15,环戊烯的转化率达到100%,戊二醛的收率大于75%,可作为环戊烯氧化工艺考察的催化剂。
2.2 溶剂的选择
从工业化角度来看,所用溶剂必须符合以下要求:(1)化学性质稳定,在反应体系中不易发生副反应;(2)对原料环戊烯和氧化剂均有一定的溶解性,使反应呈均相;(3)后处理简单方便、易于回收利用;(4)毒性较小、安全性好。
在钨基催化剂-有机溶剂体系中,环戊烯不能直接与过氧化氢相溶,有机溶剂的作用使环戊烯和过氧化氢形成均相而进行氧化反应。为了提高反应速率,有效改善质量传递过程,本次试验根据使用原则选择了常用的醇类和醚类作溶剂,首先通过试验确定了各溶剂适宜的配比和反应时间,并在常压、反应温度为35~37 ℃的条件下考察了溶剂对氧化反应的影响,其结果如表3所示。
从表3 可以看出:有机溶剂的种类和比例对于整个反应过程的影响十分显著,从分析结果上看,选用叔丁醇作溶剂时戊二醛的收率最高,在适宜的工艺条件下其选择性也较为理想。虽然异丙醇作溶剂时反应速度最快,但其选择性低,考虑副产物在后续处理中很难分离,因此,环戊烯氧化反应的工艺条件考察中,优先选用叔丁醇作溶剂。
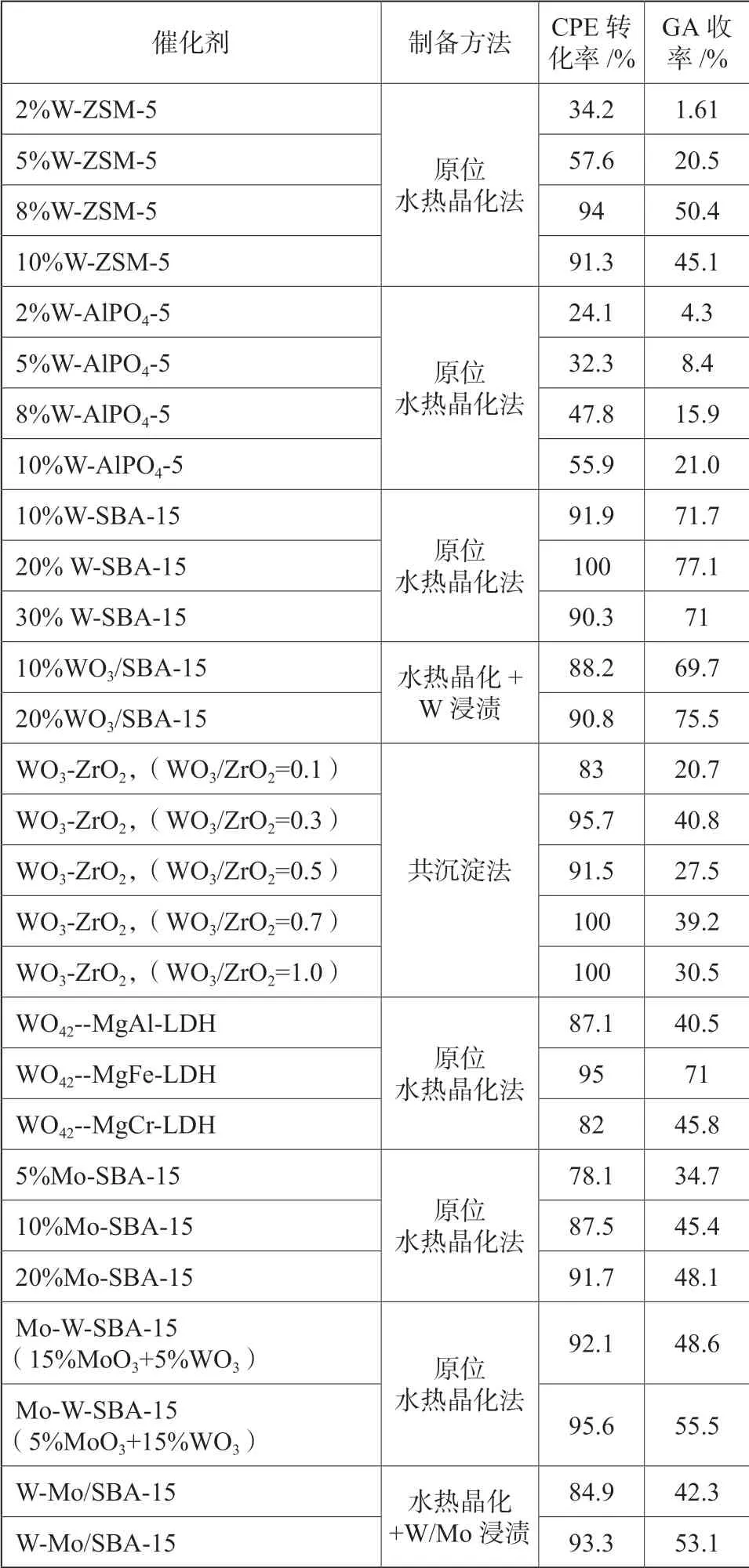
表2 不同催化剂的催化性能Tab.2 Catalytic performance of different catalysts
2.3 环戊烯氧化过程的分析
在反应器中,分别加入催化剂、叔丁醇、30%(wt)过氧化氢和环戊烯。催化剂∶叔丁醇∶过氧化氢∶环戊烯(质量比)=0.2∶6∶3∶1,在反应过程中,不断取样进行色谱和质谱分析。
由图4 可以看出,在未发生氧化反应前,反应体系内主要是溶剂叔丁醇和反应物环戊烯,由于我们是使用氢焰检测器进行色谱分析,水并不出峰。加入负载型钨酸催化剂W-SBA-15,反应温度35~37 ℃,并进行搅拌,随着反应时间的延长,通过质谱分析可以清晰地看出,环戊烯发生化学反应生成环戊烯环氧化物,质谱谱图见图5。

表3 不同溶剂对氧化反应的影响Tab.3 Effect of different solvents on oxidation reaction
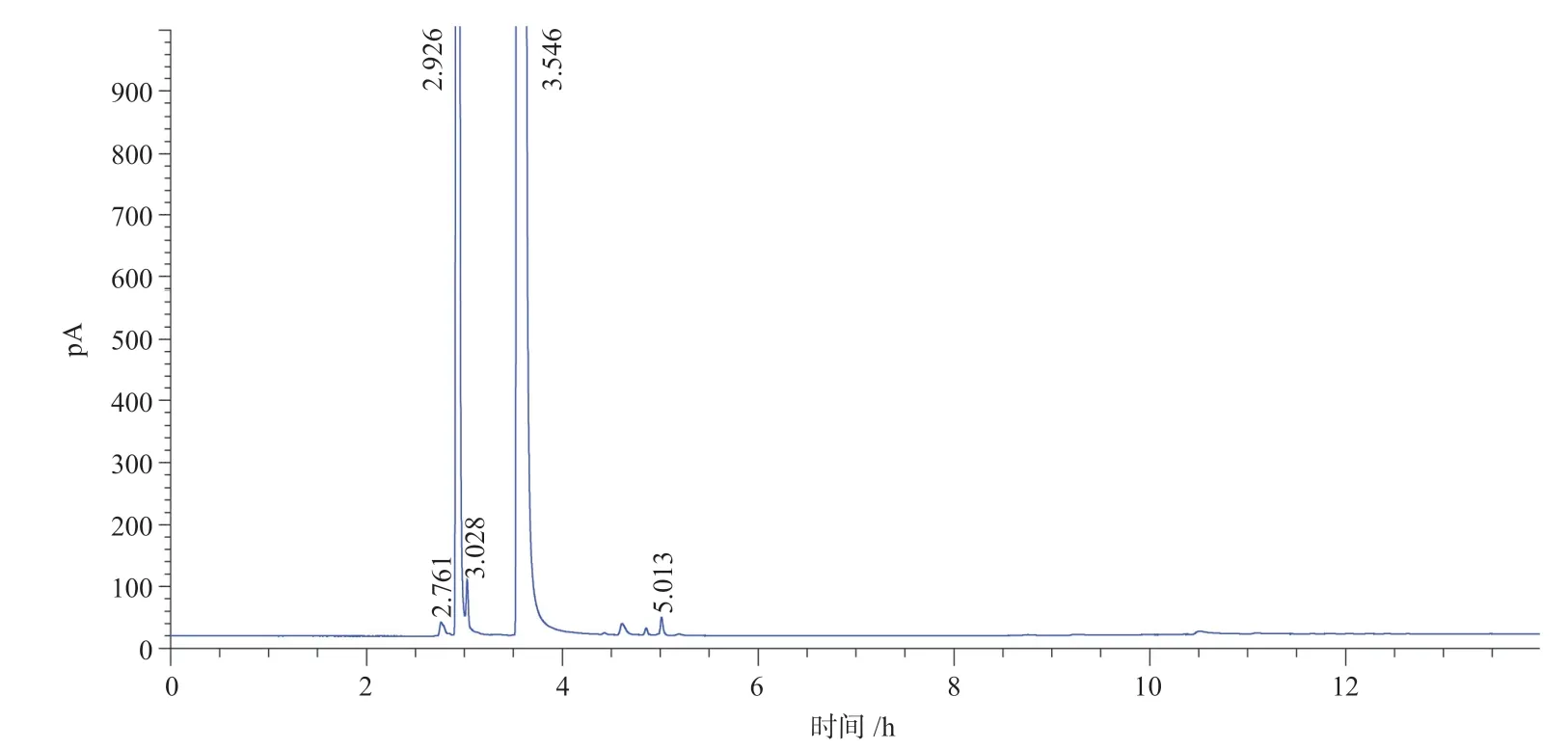
图4 反应前色谱分析图Fig.4 Chromatographic analysis before reaction
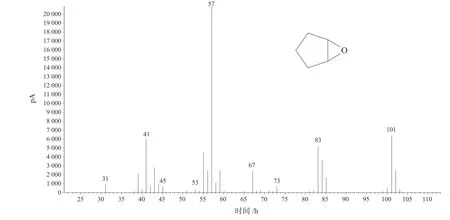
图5 环戊烯环氧化物质谱谱图Fig.5 Mass spectrum of cyclopentene epoxide
在反应条件下,在7 h 至9 h,环戊烯环氧化反应转化率接近100%,并开始有少量戊二醛生成。随着反应时间的延长,反应液中戊二醛含量不断增加。反应24 h 左右,环氧环戊烷基本转化完全,通过色谱图(由于是采用内标法分析戊二醛的含量,引进了环己酮作为内标物),如图6所示。质谱图如图7所示,红外谱图如图8所示,反应主产物为戊二醛,主要副产物为1,2-环戊二醇,同时还含有少量的2-叔丁氧基-1-环戊醇,质谱图如图9所示。
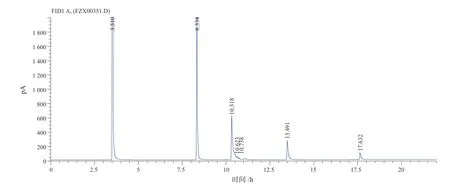
图6 反应后色谱分析图Fig.6 Chromatographic analysis after reaction
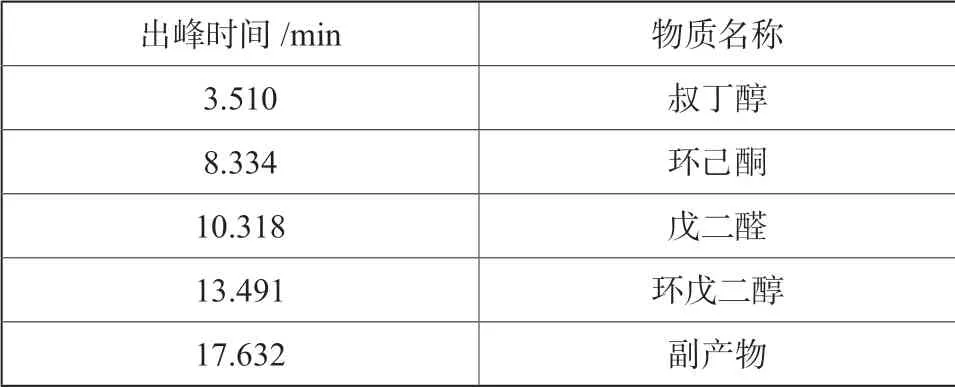
表4 色谱分析出峰时间表Tab.4 Peak time table of chromatographic analysis
2.4 单釜氧化工艺考察
对于环戊烯选择氧化制备环戊烯的过程,溶剂的用量、原料的配比、反应温度、反应时间是影响该过程的主要因素。因此,需要对这些因素进行选择比较,才能获得最佳工艺条件。
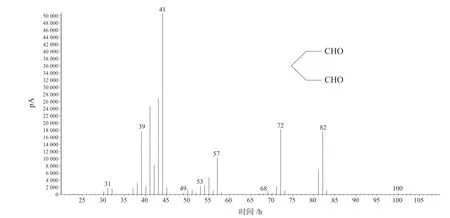
图7 戊二醛质谱谱图Fig.7 Mass spectrogram of glutaraldehyde
2.4.1 溶剂加入量对反应的影响
在W(过氧化氢)∶W(环戊烯)=3、反应温度为36 ℃、反应时间为24 h 条件下考察溶剂用量对反应的影响,实验结果如图10所示。
由图10 可以看出,溶剂量的增加会提高选择性,降低副产物的生成,使戊二醛收率随溶剂用量的增加而增加,但当溶剂比大于6 后,再增加叔丁醇的用量,戊二醛收率增加有限。综合生产成本,故合适的溶剂比为6 左右。
2.4.2 物料配比对反应的影响
在W(叔丁醇)∶W(环戊烯)=6、反应温度为36 ℃ 反应时间为24 h 条件下考察过氧化氢用量对反应的影响,实验结果如图11所示。
由图11 可以看出,物料配比对反应有显著的影响,戊二醛收率随过氧化氢用量的增加呈先升高再下降的趋势,这是由于双氧水加入量较低时氧化反应不充分;双氧水加入量较高时副反应增加,都会导致戊二醛收率偏低;当过氧化氢与环戊烯质量比为3 时,戊二醛收率最高,已达75.2%,故过氧化氢与环戊烯质量之比为3 左右时较为适宜。

图8 戊二醛红外谱图Fig.8 Infrared spectrum of glutaraldehyde
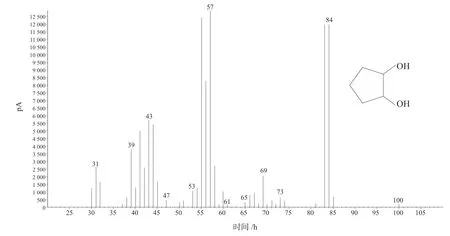
图9 Tran-1,2-环戊二醇质谱图Fig.9 Mass spectrum of tran-1,2-cyclopentanediol
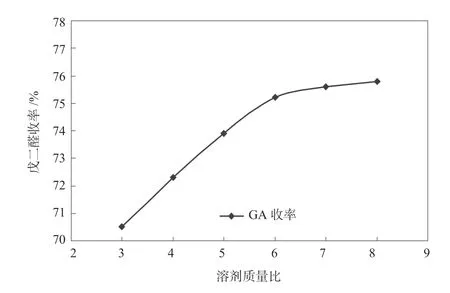
图10 溶剂加入量的影响Fig.10 Effect of solvent addition

图11 物料配比对反应的影响Fig.11 Effect of material ratio on reaction
2.4.3 氧化温度对反应的影响
在W(叔丁醇)∶W(环戊烯)=6、W(过氧化氢)∶W(环戊烯)=3、反应时间为24 h 条件下考察氧化温度对反应的影响,实验结果如图12所示。
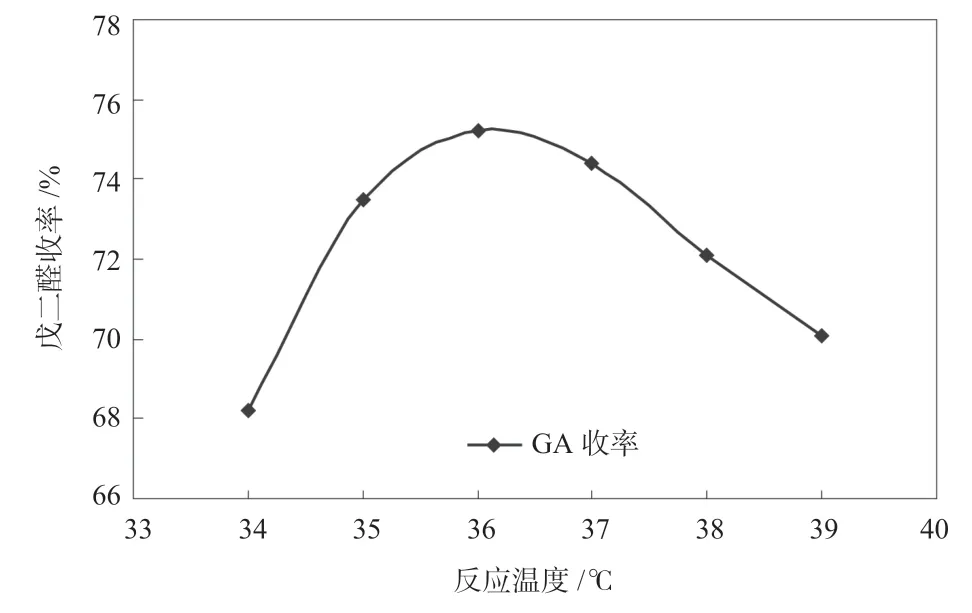
图12 氧化温度对反应的影响Fig.12 Effect of oxidation temperature on reaction
由图12 可以看出,温度对反应有显著的影响,温度低时反应速度慢,在设定的反应时间内,环氧化物还没有完全转化为戊二醛,而当温度过高则副反应明显增加,导致戊二醛收率降低;综合能耗、反应效率和收率,合适的反应温度应控制在35~37 ℃。
2.4.4 时间对反应的影响
在W(叔丁醇)∶W(环戊烯)=6、W(过氧化氢)∶W(环戊烯)=3、反应温度为36 ℃条件下,分别在反应进行到一定时间后进行取样分析。实验结果如图13所示。
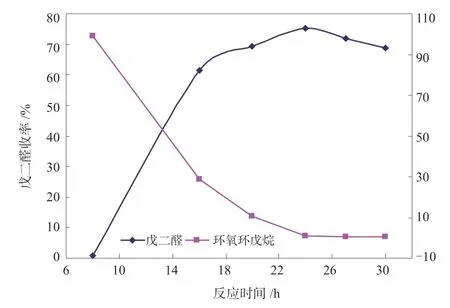
图13 时间对反应的影响Fig.13 Effect of time on reaction
从图13 可以看出:随着反应时间的增加,环戊烯(CPE)的转化率先上升,8h 后达到100%,此时环戊烯基本转化为环氧环戊烷;随着反应的进行,环氧环戊烷开始氧化生成戊二醛(GA),GA 的收率先上升后呈缓慢下降的趋势。值得关注的是反应24 h后,环氧环戊烷基本转化,会发生戊二醛进一步氧化成戊二酸的副反应,GA 的选择性和收率同时降低,考虑到戊二酸很难从产物中分离出来,适宜的反应时间控制在24 h 左右。
2.4.5 氧化条件的优化
根据单因素实验结果,考察了以叔丁醇为溶剂,各种因素对环戊烯氧化反应效果的影响规律,初步确定了适宜的环戊烯氧化实验条件,为排除各因素的交互影响,优化操作条件,采用正交实验设计表L9(34)寻找优化条件,每个影响因素考虑三个水平,正交设计方案见表5,正交实验结果见表6。
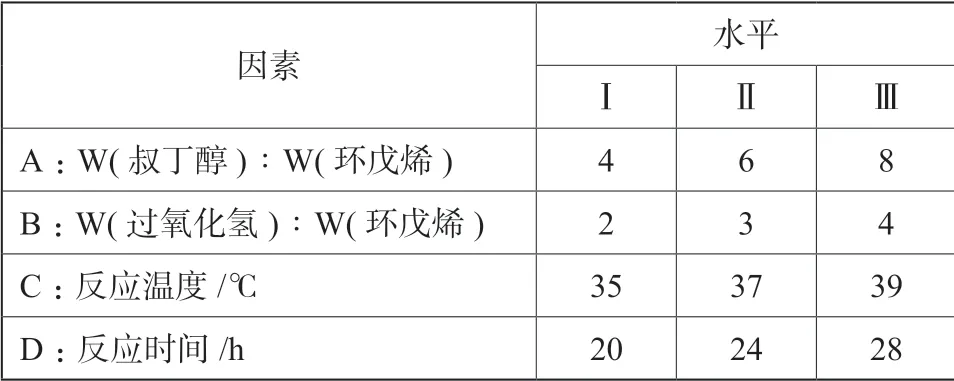
表5 正交设计方案Tab.5 Orthogonal design scheme
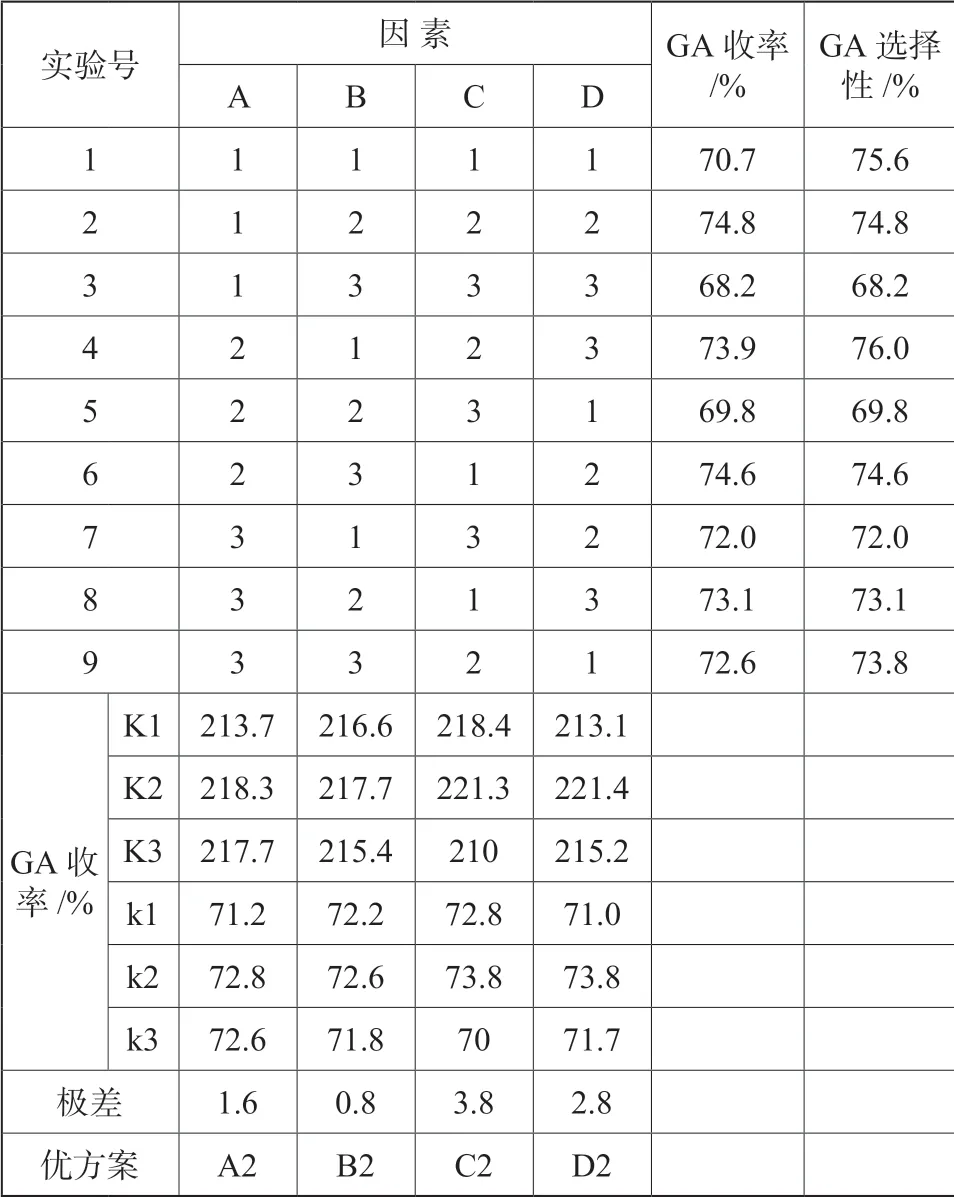
表6 氧化正交实验结果统计Tab.6 Statistics of oxidation orthogonal experiment results
从表6 可以看出:
(1)在所选定的条件范围内,各因素对氧化反应的影响次序为C >D >A >B,其中,反应温度和反应时间是主要影响因素,温度低、时间短,反应转化不充分;温度高、反应时间长则副产物增加。因此必须将反应温度和时间控制在在一定的范围内,兼顾氧化反应的转化率和戊二醛的选择性,确保目标产物获得理想的收率。
(2)溶剂比和原料配比相对反应温度和时间来说影响较小,是次要影响因素,在所选的范围内戊二醛收率变化较小,因此需要综合考虑生产成本和选择性(副产物少,对分离有利)来确定优化条件。
从优化实验结果看,优选方案为A2B2C2D2,再结合操作成本和后续分离(难分离的副产物少)两方面综合考虑,可以确定最佳的氧化工艺条件为:W(叔丁醇)∶W(环戊烯)=6、W(过氧化氢)∶W(环戊烯)=3、反应温度为35~37℃、反应时间24 h,在此条件下,戊二醛的收率在75%左右。
2.5 多釜串联氧化工艺考察
在环戊烯的氧化反应过程中,氧化反应受过氧钨酸与环戊烯的相互作用,以及串联反应中间过程的影响。因此实验在现有工艺的基础上进行了调整,以负载型杂多酸为催化剂,采用分段氧化工艺(即双氧水多次加入)进行实验,其溶剂比、双氧水总加入量、温度和反应总时间与单釜优化条件相同,单段双氧水加入量和氧化时间按次数平均分配,并与单釜实验进行对比,结果见图14。

图14 双氧水加入次数对反应的影响Fig.14 Effect of adding times of hydrogen peroxide on reaction
从图14 可以看出:
(1)采用分段实验,通过调整双氧水的加入量和过氧化氢在催化剂表面的浓度,可以控制反应的进程,在保证良好转化率的前提下,明显提高了反应的选择性,即多釜串联工艺戊二醛的收率均高于单釜工 艺。
(2)过氧化氢在催化剂表面的浓度对反应进程及戊二醛收率有非常显著的影响,当双氧水分三次加入其在催化剂表面的浓度最有利于主反应的进行,戊二醛的收率超过85%。
3 结论
(1)制备了多种环戊烯氧化催化剂,并对其氧化性能进行了考察,筛选出一种活性高、选择性好的催化剂,为工业化放大提供参考。
(2)通过对单釜环戊烯选择氧化制戊二醛的主要影响因素的考察以及工艺条件的优化,取得了比较适宜的氧化工艺条件:W(叔丁醇)∶W(环戊烯)=6、W(过氧化氢)∶W(环戊烯)=3、反应温度为35~37℃、反应时间24 h 左右。
(3)通过对反应过程的分析和多釜实验的研究,确定了理想的绿色工艺路线,在适宜的条件下采用三段氧化法可使环戊烯的转化率为100%,戊二醛的收率在85%以上。
