片状铋/钒酸铋复合催化剂的制备及其光催化性能
2021-01-08李书文汪铁林王为国王存文
冯 飞,李书文,汪铁林,2,王为国,2,王存文,2
(1.武汉工程大学化工与制药学院,湖北武汉430205;2.武汉工程大学绿色化工过程教育部重点实验室)
单斜相钒酸铋(BiVO4)具有价廉、无毒等优点[1],是一种优良的光催化材料。BiVO4的带隙较窄(2.4 eV)使其具有良好的可见光响应[2],因而可利用可见光降解有机污染物[3]、裂解水制氢[4]、还原CO2[5]。BiVO4的合成方法包括微波辅助法[6]、溶胶-凝胶法[7]、水热法[8]等。然而,BiVO4由于其光生电子-空穴的高复合率和表面缓慢的析氧动力学限制了其光催化性能[9]。因此,通过晶面调控[10]、元素掺杂[11]、异质结[12]、负载辅助催化剂[13]等有效的改性策略来提高BiVO4光催化效率是拓展其应用的关键。
已有的研究表明,贵金属/BiVO4复合光催化剂提高了光催化活性,Au 等贵金属表面的等离子体共振效应(SPR)提供了额外的可见光吸收和促进了电荷分离[14]。值得注意的是,金属Bi 具有SPR 效应[15],是贵金属的理想替代品,且可以避免外来元素造成的影响。
本文采用溶剂热法制备了片状Bi/BiVO4复合物,在Na3VO4用量及其他反应条件不变的情况下,通过改变BiCl3的用量,得到不同物质的量比的Bi/BiVO4复合光催化剂。以三水亚甲基蓝(MB)为目标降解物,考察了Bi/BiVO4催化剂的光催化性能。与纯BiVO4相比,所制备的Bi/BiVO4复合催化剂光催化活性明显提高,并对可能的光催化机理进行了探讨。
1 实验部分
1.1 实验药品
氯化铋、 正钒酸钠、 十六烷基三甲基溴化铵(CTAB)、乙二醇、无水乙醇、三水亚甲基蓝(MB)、氯化硝基四氮唑蓝(NBT)、氢氧化钾、氢氧化钠、二甲基亚砜(DMSO)、对苯二甲酸(PTA)、碘化钾,所用试剂均为分析纯;实验用水均为去离子水。
1.2 实验仪器
XD-5A 型X 射 线 衍 射 仪(XRD);ESCALAB 250XI 型X 射线光电子能谱仪(XPS);Tecnai G2 F20型透射电子显微镜(HRTEM);JSM-5510LV 型扫描电子显微镜(SEM);ASAP-2460 型物理吸附分析仪(BET);Optima 5300 DV 型电感耦合等离子体发射光谱仪(ICP-OES);UV2600 型紫外可见分光光度计(UV-vis-DRS);SP-150 型电化学工作站;Hitachi F 4600 型荧光分光光度计。
1.3 催化剂的制备
在80 mL 乙二醇中加入2.207 g BiCl3和1.050 g CTAB,超声震荡辅以搅拌30 min,再加入1.287 g Na3VO4,搅拌30 min 后得到淡黄色混合液。将混合液转入100 mL 聚四氟乙烯内衬的高压釜中密封,160 ℃反应3 h。自然冷却至室温,过滤收集最终产物。用无水乙醇和去离子水多次洗涤后在80 ℃干燥12 h,得到样品BiVO4。Na3VO4用量及其他反应条件不变,改变氯化铋的用量,使n(Bi)/n(V)分别为1.1、1.2、1.3、1.4,所得到的不同样品分别记为x-BiVO4(x=1,2,3,4)。
1.4 光催化降解MB
本实验通过光降解MB 来评价合成样品的光催化性能。采用500 W 氙灯模拟太阳光光源,常压25 ℃下进行反应。实验时,取0.05 g 催化剂粉末加入250 mL 质量浓度为20 mg/L MB 溶液中,超声5 min后将悬浮液置于暗处磁力搅拌0.5 h 以达到催化剂和溶液的吸附-脱附平衡。开启光源,每30 min 取样3 mL,持续3 h。所取样品经滤膜过滤并稀释一倍后,采用紫外可见分光光度计测定吸光度。为了测试所制备催化剂的稳定性,在前述条件下完成光催化反应后,将目标悬浮液过滤,将所收集的催化剂经蒸馏水多次洗涤、烘干后,在同样条件下重复进行光降解MB 实验。
1.5 活性氧自由基(ROS)的测定
超氧阴离子自由基(·O2-)的检测:取1 mL NBT(1 mmol/L)加入到250 mL 3-BiVO4悬浮液中(0.2 g/L)。暗反应30 min 后取样30 mL 作对照组; 打开光源,分别于30、60 min 时取样30 mL。离心,取上清液检测其中还原性产物的吸光度。向3 个样品离心所得沉淀中加入5 mL 45% KOH 和55% DMSO 混合溶液,充分搅拌后离心,检测上清液中还原性产物的吸光度。
羟自由基(·OH)的检测:取0.05 g 3-BiVO4催化剂加入到250 mL 5 mmol/L NaOH 和0.5 mmol/L PTA 混合溶液中,超声5 min 后暗反应30 min。打开光源,分别于0、30、60 min 时取样5 mL,上述条件不变,向混合溶液中加入1 mmol/L KI,于30、60 min 时取样,采用荧光分光光度计检测样品荧光强度。
2 实验结果与讨论
2.1 催化剂的形貌结构分析
2.1.1 XRD 分析
图1 为BiVO4和Bi/BiVO4样品的XRD 谱图。从图1 可以看出,样品的强衍射峰位于2θ=25.9、32.7、46.9°,分别对应斜方晶系BiVO4(JCPDS No.73-0474) 的111、113、024 晶面的衍射峰。样品曲线与Bi 的标准PDF 卡片JCPDS No.85-1331 比较,可观察到金属Bi 的特征衍射峰,随着n(Bi)/n(V)的增加,Bi 相特征峰峰强度逐渐增大。乙二醇具有还原性,在溶剂热反应中,游离的Bi3+在反应过程中可能被还原,在BiVO4的表面生成金属Bi 纳米粒子[16]。未观察到V 氧化物(如V2O5和V2O3)或Bi2O3相杂质引起的特征峰。

图1 BiVO4 和x-BiVO4 样品的XRD 谱图
2.1.2 XPS 分析
采用X 射线光电子能谱(XPS)测定了BiVO4和3-BiVO4样品的表面元素组成和价态。图2a 为BiVO4和3-BiVO4的XPS 全谱图,清楚地显示出C、Bi、V和O 峰的存在,C1s 峰应来自仪器环境。图2b 是样品的Bi4f 谱图,对应于Bi3+的Bi4f7/2和Bi4f5/2。BiVO4结合能位于164.7、159.4 eV,而3-BiVO4的这两个峰位移到164.5、159.2 eV,这种在峰值位置上的移位可能是样品中的金属Bi 和BiVO4相互作用引起的[15]。除此之外,3-BiVO4在163.1 eV 及157.7 eV 处还可以观察到两个强度非常弱的峰,对应于金属Bi 的特征峰,说明样品中存在少量金属Bi,这与XRD 分析结果一致。图2c 为样品V2p 谱,对应于V5+的V2p3/2和V2p1/2。BiVO4在524.6 eV 和517.3 eV 处显示的两个峰,3-BiVO4这两个峰位移到了524.4 eV 和517.1 eV。图2d 为样品的O1s 谱图,这两个峰对应于晶格氧和表面羟基。
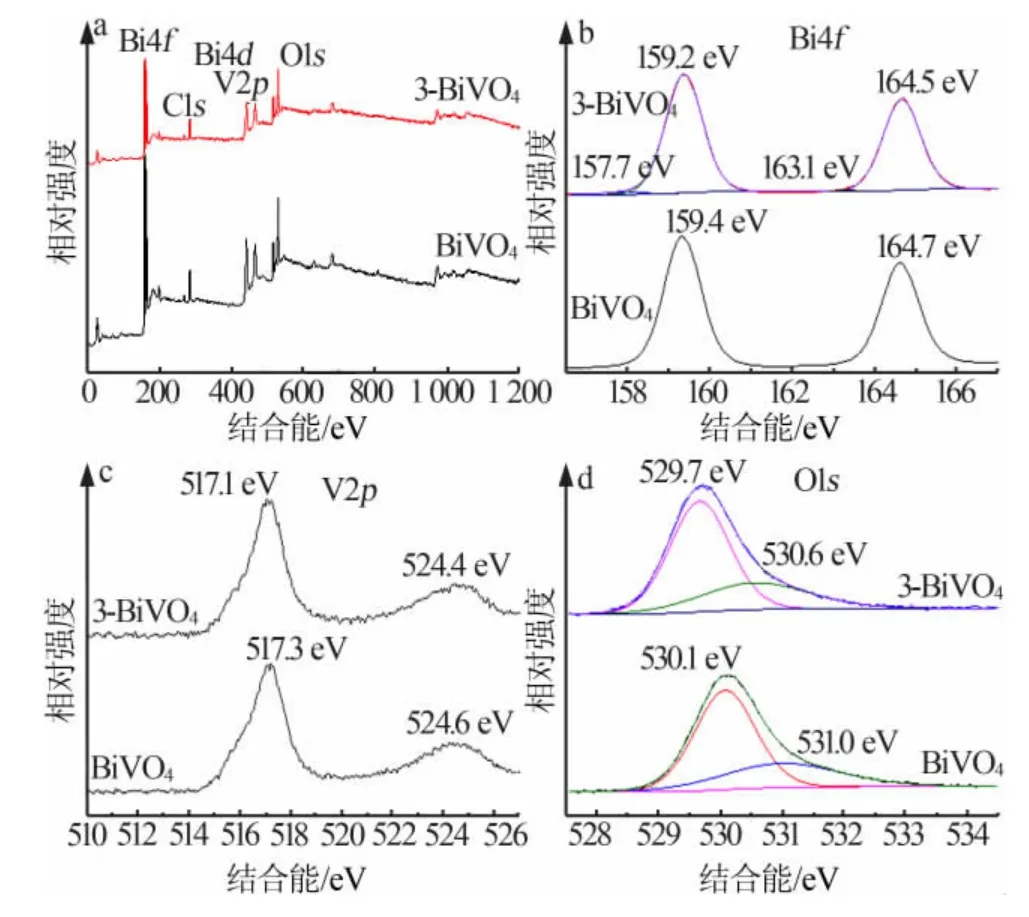
图2 BiVO4 和3-BiVO4 样品的XPS 能谱
2.1.3 SEM 分析
图3a、b 分别为所制备BiVO4和3-BiVO4样品的SEM 图,两者均为片状薄膜相互层叠、堆积构成多孔网状。在n(Bi)/n(V)由1.0 增大到1.3 后,3-BiVO4板块表面比BiVO4板块表面具有更多小颗粒,可能是由于3-BiVO4表面沉积了更多的金属Bi。图3c、d分别为所制备BiVO4、3-BiVO4样品的TEM 图,样品呈约30~80 nm 不规则薄片状。图3e、f 分别为所制备BiVO4、3-BiVO4样品的HRTEM 图,可以看到样品的晶格条纹间距为0.27 nm,为钒酸铋晶体(113)晶面。

图3 BiVO4 的SEM(a)、TEM(c)、HRTEM(e)图;3-BiVO4 的SEM(b)、TEM(d)和HRTEM(f)图
2.1.4 氮气吸附-脱附与ICP 分析
采用氮气吸附-脱附法比较研究了不同Bi 含量样品的孔径分布和比表面积等孔结构参数变化,结果如图4 和表1 所示。根据IUPAC 分类,在P/P0≥0.5 时,为H3 型滞后环[17],表明x-BiVO4具有介孔微观结构。由表1 可知,n(Bi)/n(V)在1.3 以内的样品比表面积变化不大,但当n(Bi)/n(V)超过1.3 后催化剂的比表面积减小。

图4 BiVO4 和x-BiVO4 样品氮吸附-脱附图
为了准确测定样品中元素的含量,采用ICPOES 测定了BiVO4与3-BiVO4中Bi 和V 元素的含量,结果见表1。反应物n(Bi)/n(V)在1∶1 条件下合成的BiVO4样品中n(Bi)/n(V)为1.21,这可能是催化剂表面存在钒空位所致[5]。而当反应物n(Bi)/n(V)为1.3∶1 时,在相同条件下合成的3-BiVO4样品中n(Bi)/n(V)为1.37,结合XRD 和XPS 表征结果可知,可能是部分Bi3+被还原成金属单质Bi,从而形成了Bi/BiVO4复合物。
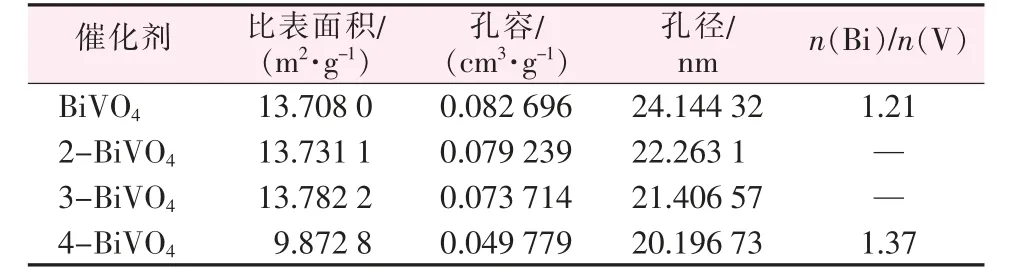
表1 BiVO4 和x-BiVO4 的孔结构参数
2.2 UV-vis DRS 分析
BiVO4和3-BiVO4UV-vis DRS 吸收光谱如图5所示。由图5 可见,除了紫外光区,样品在可见光区也有吸收。BiVO4、3-BiVO4的光吸收阈值分别约为550、540 nm。3-BiVO4在550~800 nm 范围内光吸收强度明显提高,这可能是由于金属Bi 作为一种非贵金属,表现出与贵金属(Ag、Au、Pt)相似的表面等离子体共振效应(SPR)。通过将(αhv)2对(hv)做切线到a=0[18],确定3-BiVO4带隙宽度为2.32 eV。

图5 BiVO4 和3-BiVO4 UV-vis DRS 吸收光谱
2.3 光电流与电化学阻抗测试
BiVO4和3-BiVO4的光电流密度图如图6 所示。由图6 可知,未光照时,BiVO4、3-BiVO4的光电流都较小。可见光照射时,两个样品均产生了明显的光电流,说明样品具有可见光响应。3-BiVO4的光电流强于BiVO4,说明BiVO4与金属Bi 复合后电子-空穴的分离能力增强。电化学阻抗谱分析结果如图7所示。阻抗谱曲线的曲率半径越小,电荷转移阻力越小,则电荷分离度越高[19]。从图7 可以看出,3-BiVO4曲率半径小于BiVO4的曲率半径,说明BiVO4与金属Bi 复合后电荷转移阻力降低,从而提高了电荷分离度。

图6 BiVO4 和3-BiVO4 的光电流密度图
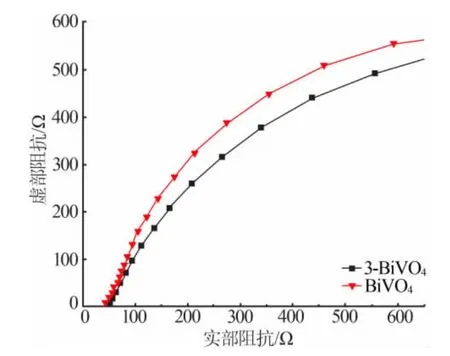
图7 BiVO4 和3-BiVO4 的阻抗谱图
2.4 光催化性能测试
不同的n(Bi)/n(V)下,x-BiVO4样品光催化降解MB 的时间变化曲线如图8 所示。随着Bi 复合量的增加,样品光催化活性先增强后减弱。3-BiVO4对MB 的降解表现出最佳的光催化活性。500 W 氙灯下反应3 h,0.2 g/L 3-BiVO4可使250 mL 初始质量浓度为20 mg/L 的MB 降解83%,而在相同条件下,BiVO4仅使MB 降解72%。3-BiVO4表现出最佳的光催化活性,可能是钒酸铋与Bi 复合后,光催化过程产生的光生载流子复合率降低,从而提高催化剂的活性。但当反应物中n(Bi)/n(V)过高时,复合物比表面积显著减小,反应活性位点数降低,因此催化剂的活性又开始下降。
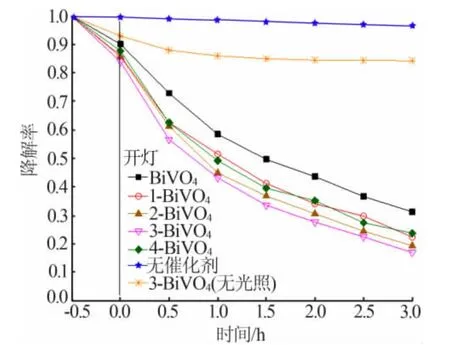
图8 光催化降解MB
除了催化剂的性质之外,光源、催化剂用量、MB起始浓度和降解时间等对染料降解率都具有一定的影响。本实验中催化剂用量较少(0.2 g/L),染料初始质量浓度较高(20 mg/L),反应时间较短(3 h)造成MB 降解率值偏低,但实际的MB 降解量比文献[3]报道值高。3-BiVO4样品稳定性测试如图9 所示。由图9 可知,循环4 次后,3-BiVO4催化降解效率基本保持不变,仍旧保持较高的光催化活性,说明所制备的钒酸铋光催化剂稳定性较高。
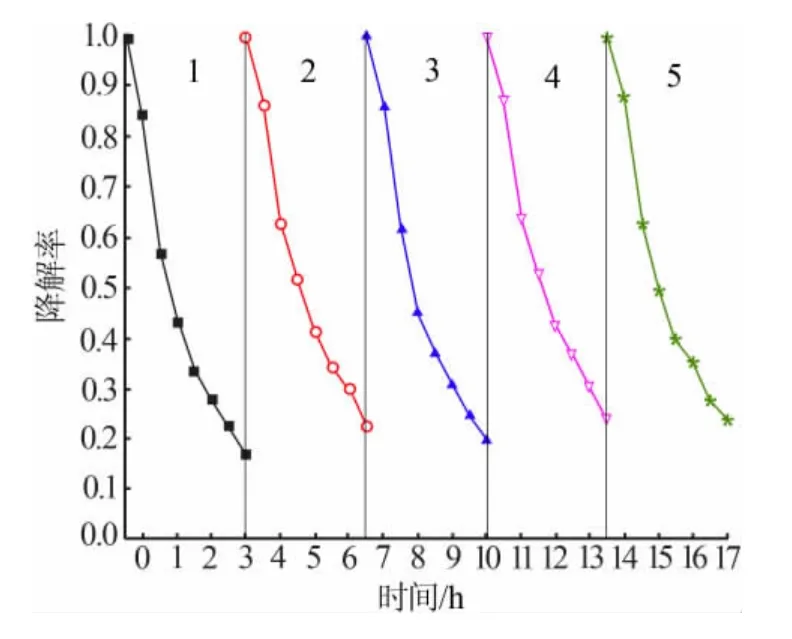
图9 3-BiVO4 样品稳定性测试
2.5 光催化机理探讨
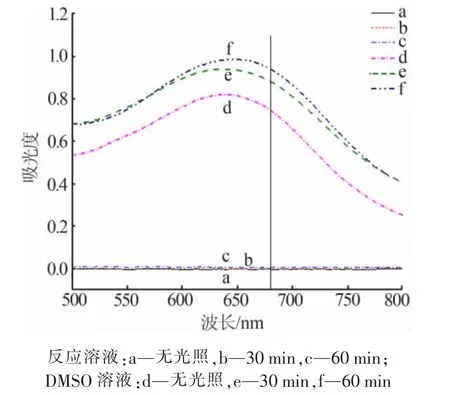
图10 不同反应时间下样品紫外吸收谱图
PTA 与·OH 反应可生成2-羟基对苯二甲酸,其发色波长约为425 nm。不同光照时间下样品荧光光谱图如图11 所示。由图11可见,未开启光源光照时,样品基本无荧光,开启光照后样品荧光强度随反应时间增长而增强,说明在光催化反应中产生了·OH。在加入KI 作h+牺牲剂后,样品的荧光强度减弱,表明h+在光降解中同时也对·OH 的产生起着重要作用。

图11 不同光照时间下样品荧光光谱图
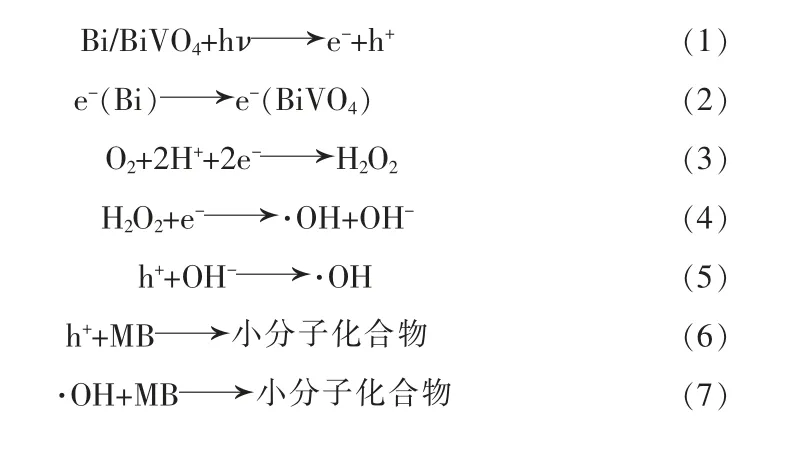
根据实验结果和文献已报道机理,Bi/BiVO4光催化降解MB 可能机理如式(1)~(7)和图12 所示。在可见光照射激发下,金属Bi 与BiVO4表面均形成了电子-空穴对。由于(-0.33 eV vs.NHE)[21]氧化还原电势比BiVO4的CB 电势(0.07 eV vs.NHE)[22]更负,使O2不能被还原成。而O2/H2O2(0.695 eV vs.NHE)[21]的氧化还原电势相对更正,Bi 自掺杂BiVO4催化剂表面上的吸附氧可捕获光生电子产生H2O2。由 于·OH/OH-(1.99 eV vs.NHE)[21]的 标 准 电 位 比BiVO4的VB 电位(2.47 eV vs.NHE)[22]更负,所以OH-可被空穴h+氧化生成·OH。最后,h+和·OH 将MB 降解为小分子化合物。
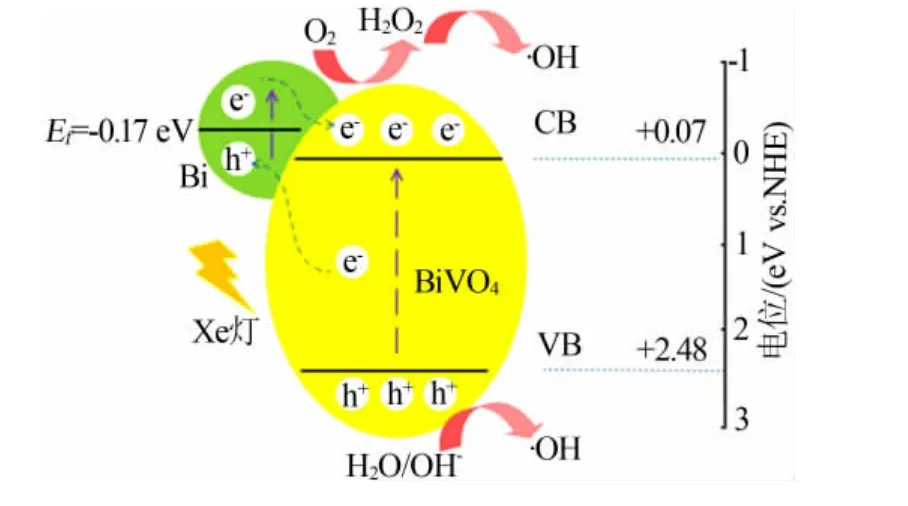
图12 Bi/BiVO4 光催化降解机理图
3 结论
采用溶剂热法成功合成了片状结构的Bi/BiVO4光催化剂。其中BiVO4为单斜相,金属Bi 与BiVO4形成复合物。与BiVO4相比,Bi/BiVO4复合催化剂的光催化活性明显提高,当反应物中Bi 元素与V 元素物质的量比为1.3 时,催化剂的活性最高。可能是Bi/BiVO4复合催化剂中金属Bi 与BiVO4界面的电子迁移过程有利于降低BiVO4半导体中电子-空穴对的复合,从而提高BiVO4的光催化效率。
