大孔吸附树脂结合HSCCC 分离小叶苦丁茶中2 个苯乙醇苷
2021-01-08张李成杨庆雄
张 军,袁 祥,张李成,胡 晔,杨庆雄*
(1.贵州师范大学化学与材料科学学院,贵州 贵阳 550001;2.贵州师范大学喀斯特学院,贵州 贵阳 550001)
小叶苦丁茶为木犀科女贞属植物粗壮女贞的叶,是贵州、云南、四川等西南地区常用的饮料植物,应用广泛,含有多种化学成分,并具有抗氧化、抗菌、抗炎、抗肿瘤转移、肝保护、神经保护、心血管保护、免疫调节[1-9]等多种药理活性。其中,含有量较高的阿克苷,紫茎女贞苷A被认为是小叶苦丁茶主要活性成分[9-11],He 等[12]用95%乙醇提取苦丁茶,再以D101 大孔吸附树脂、硅胶、Lichroprep RP-18 为填料,用水、氯仿-甲醇-水反复洗脱分离得到两者,但分离流程较长。
阿克苷作为多种植物的有效成分,制备分离方法较多,如Li 等[13]用硅胶柱、Sephadex LH-20 凝胶柱结合高速逆流色谱(HSCCC),从车前草中分离得到该成分;Lei 等[14]用75%乙醇提取肉苁蓉,再用石油醚、乙酸乙酯、正丁醇萃取提取物,最后以HSCCC 从正丁醇部位中分离得到该成分。阿克苷、紫茎女贞苷A 极性相近,常用硅胶柱色谱、反相硅胶柱色谱、HPLC 制备色谱等方法进行分离纯化,但过程繁琐,成本较高,尚无快速同时分离两者的报道。
因此,本实验采用大孔吸附树脂结合HSCCC,简洁、快速地分离小叶苦丁茶中阿克苷、紫茎女贞苷A,以期为后期该药材的深入研究和开发提供基础。
1 材料
1.1 试剂与药物 小叶苦丁茶采自贵州省余庆县,经贵州师范大学杨庆雄教授鉴定为正品。HP-20 大孔吸附树脂(日本三菱化学公司)。色谱纯乙腈、甲醇(德国默克公司);分析纯甲醇、氯仿、乙酸乙酯、正丁醇、甲酸(天津市富宇精细化工有限公司)。
1.2 仪器 TBE-300C 型高速逆流色谱仪(上海同田生物技术股份有限公司);LC-30AD 高效液相色谱仪 (配置SPD-M30A 二极管阵列检测器)、LCMS-2020 液相色谱-质谱联用仪(日本岛津公司);N-1300 型旋转蒸发仪(日本Eyela 公司);T-214 型电子天平[赛多利斯科学仪器(北京) 有限公司]。
2 方法
2.1 药材提取和大孔吸附树脂快速分段 取药材干燥叶3 kg,粉碎、冷水浸泡3 次(共20 L),每次12 h,将3 次浸取液合并过滤,滤液减压浓缩至5 L,取100 mL,减压浓缩除去溶剂待用,剩余滤液按料液比1∶1 上HP-20 非极性大孔吸附树脂,依次用水、50% 甲醇、甲醇梯度洗脱,每个梯度4 个柱体积,收集50%甲醇、甲醇洗脱部位,减压浓缩除去溶剂,得到相应部位(褐色粉末)。
2.2 HPLC 条件 Phenomenex ODS 色谱柱 (250 mm×4.6 mm);流动相水(含0.1%甲酸) (A) -乙腈(B),梯度洗脱(0~14 min,16%~18% B;14~27 min,18% B;27~40 min,18%~40%B;40~50 min,40%~100%B;50~55 min,100%B);体积流量0.7 mL/min;柱温30 ℃;检测波长320 nm。
2.3 HPLC-MS 条件
2.3.1 HPLC Phenomenex ODS 色谱柱 (150 mm ×4.6 mm);流动相水(含0.1%甲酸) (A) -乙腈(B),梯度洗脱(0~14 min,16%~18% B;14~30 min,18% B;30~35 min,100%B);体积流量0.5 mL/min;柱温30 ℃;检测波长320 nm。
2.3.2 MS 测定时间0~35 min;正负离子分析模式,扫描范围m/z 200~800;扫描速度1 250 u/s;雾化气体积流量1.5 L/min;加热块温度 400 ℃;干燥气 体积流量15 L/min。
2.4 HSCCC 溶剂系统筛选 根据目标化合物性质结合文献[15-20]确定溶剂系统。将对应比例的溶剂加入到分液漏斗中,上下充分振摇,静置后分液,称取分离样品约1 mg,精密量取上相、下相溶液各1 mL 将其溶解,充分振荡溶解,待两相平衡后再分别精密量取0.2 mL,挥干,1 mL甲醇溶解,进行HPLC 分析,计算不同溶剂系统中目标化合物的分配系数K,公式为K=目标化合物在上相溶液中的峰面积/目标化合物在下相溶液中的峰面积。
2.5 HSCCC 分离过程与方法 将上相、下相溶剂系统分液,超声处理15 min,各取5 mL,再取待分离样品约200 mg溶于其中,充分摇匀,静置分层(准备5 份样品连续进样)。以上相为固定相,下相为流动相,将泵体积流量设为40 mL/min,泵入上相溶剂至充满仪器后停泵,启动主机,将转速设为850 r/min,体积流量调为10 mL/min,泵入下相溶剂,待上相、下相溶剂同时流出且平衡后,计算保留率,公式为保留率=[(400-平衡后流出的上相体积)/370]×100%,从样品注射口加入用上相、下相溶解的样品,设定色谱检测波长313 nm,温度25 ℃,当上一针样品几乎完全流出时不停机,连续再次进样,按出峰收集分段。
3 结果
3.1 大孔吸附树脂分段 3 kg 药材干燥叶经水提取、大孔吸附树脂分段、蒸干收集洗脱大孔吸附树脂后,得到50%甲醇洗脱部位187 g、甲醇洗脱部位66 g,可知药材能被树脂吸附的组分主要集中在50%甲醇洗脱部位中,但小极性的甲醇洗脱部位也有约1/3 的量。取“2.1” 项下中未经树脂处理的水提物及50%甲醇、甲醇部分洗脱部位各4 mg,溶于1 mL 甲醇中,在“2.2” 项条件下进样2 μL,归一化法计算峰面积,结果见图1。由此可知,水提物中紫茎女贞苷A 占总量的24%,阿克苷占9%,经树脂处理后两者分别占42%、20%,并主要富集在50%甲醇洗脱部位,再用甲醇洗脱后基本检测不到两者。
3.2 HSCCC 溶剂系统筛选 根据文献[15-20]报道,本实验考察了氯仿-甲醇-水、乙酸乙酯-正丁醇-水,发现前者按4∶3∶2、5∶3∶2、4∶1∶5 比例洗脱时,阿克苷K 值分别为65、132、1.45,而紫茎女贞苷A 分别为113、212、0.33;后者按4∶0.6∶5、5∶2∶5、4∶3∶4 比例洗脱时,2 种成分K 值分别为1.07、3.6、5.71,0.18、0.98、1.7。由此可知,以乙酸乙酯-正丁醇-水(5∶2∶5) 洗脱时,阿克苷、紫茎女贞苷A 的分离度(两者K 值的比值) 为3.67,可较好地从混合体系中分离出来,故选择其作为溶剂系统。
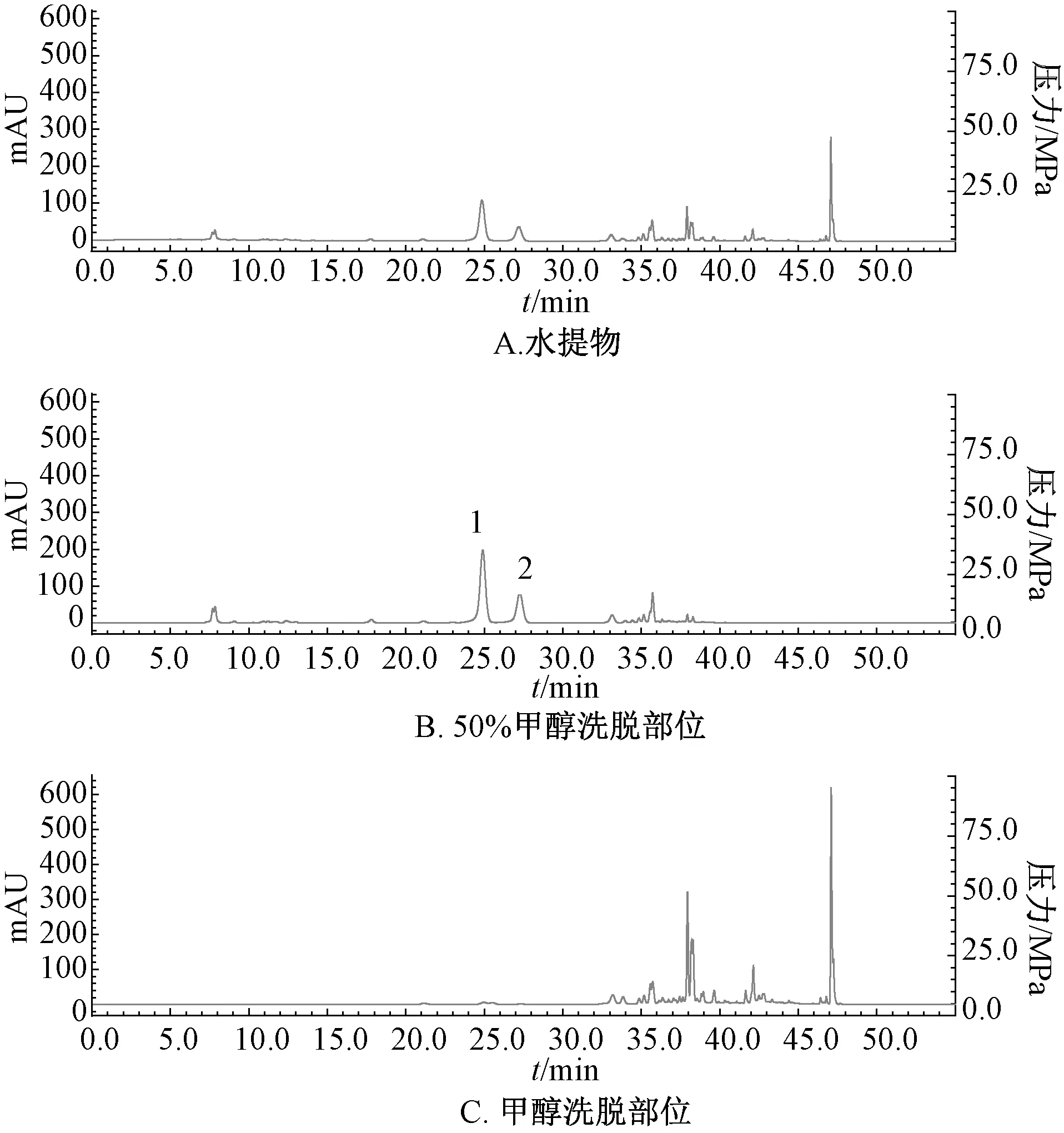
图1 2 种成分HPLC 色谱图
3.3 HSCCC 分离 用乙酸乙酯-正丁醇-水(5∶2∶5) 分离“2.1” 项下50%甲醇洗脱部分,按“2.5” 项下方法进样200 mg,结果见图2,可知各色谱峰分离度较好,固定相保留率为54%。取分离得到的Ⅰ号峰、Ⅱ号峰物质,在“2.2” 项条件下进样测定,并与图1B 进行对比,确定两者均为目标分离物。再将50%甲醇洗脱部位连续进样5 次,每次200 mg,结果见图3,可知HSCCC 中目标峰分离度仍良好。1 g 样品经500 min 分析后,得Ⅰ号峰265 mg,得率26.5%;Ⅱ号峰300 mg,得率30.0%,面积归一法测得两者纯度分别为96.5%、98%。
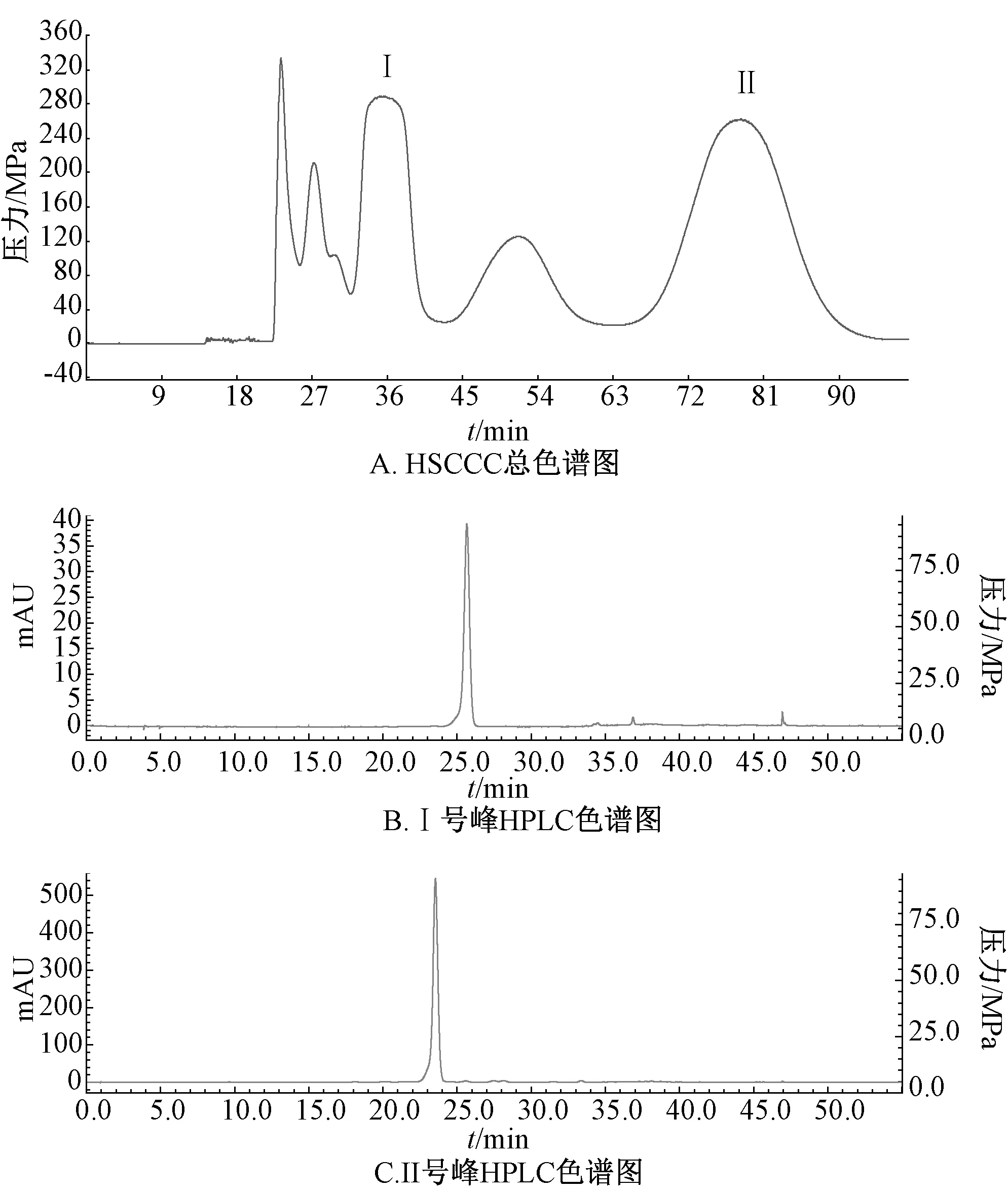
图2 50%甲醇洗脱部位单次进样HSCCC 分离情况
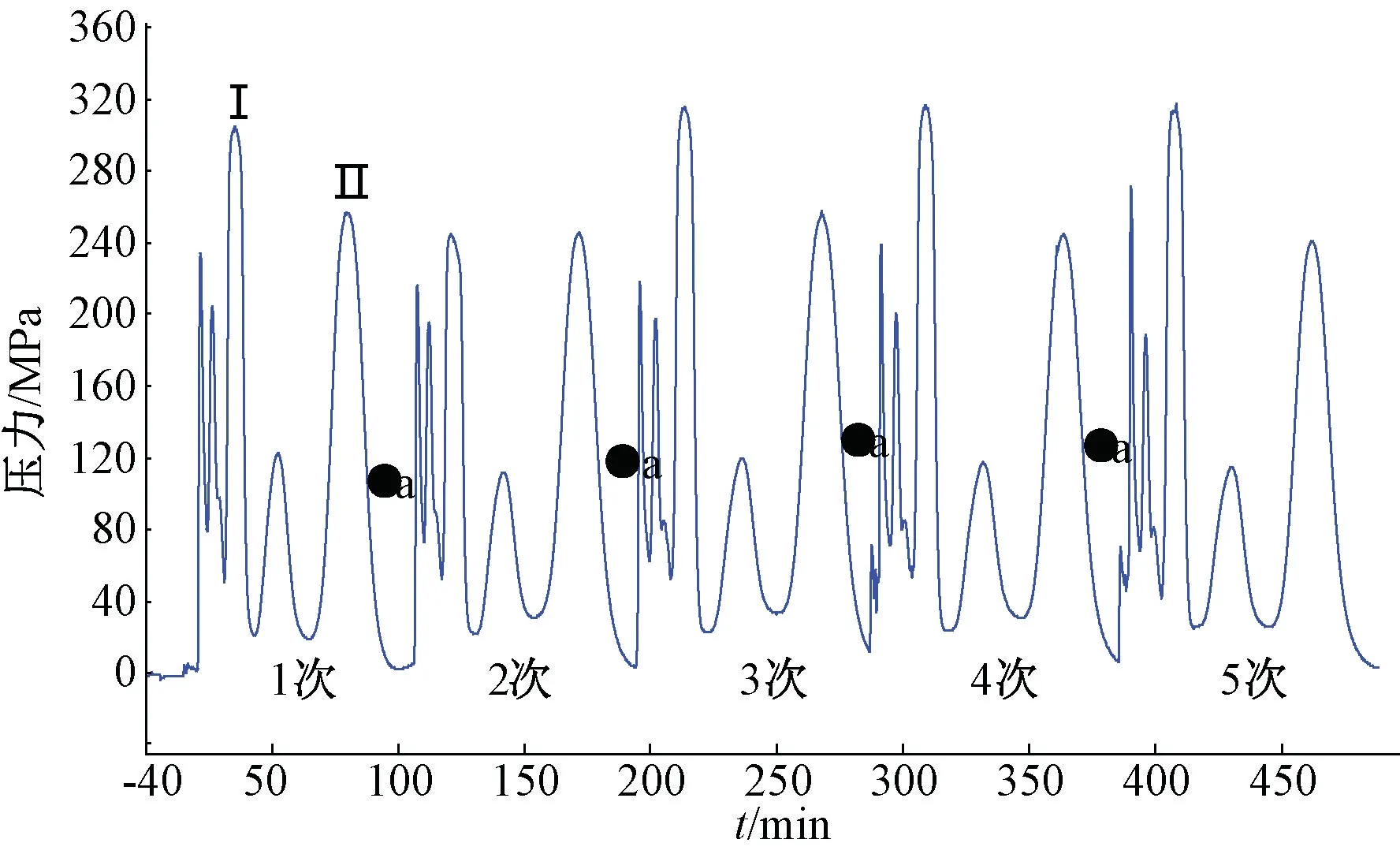
图3 50%甲醇洗脱部位连续进样HSCCC 分离情况
3.4 化合物鉴定 通过HPLC-MS 将Ⅰ号、Ⅱ号峰化合物与相应对照品进行比对,发现前者与紫茎女贞苷A 保留时间、紫外图谱、相对分子质量一致,后者与阿克苷保留时间、紫外图谱、相对分子质量一致。由此可知,2 个化合物分别为紫茎女贞苷A、阿克苷。
4 讨论
小叶苦丁茶水提取物经大孔树脂吸附后,不仅可除去糖类等大极性水溶性组分,而且能通过调节洗脱剂中甲醇体积分数,在50%时将目标分子完全洗脱下来,同时也除去了极性较小、在树脂柱上吸附较强的其他组分,达到了较好的预分离富集作用,并且该方法简便快速,成本低廉。在HSCCC 分离过程中采取单次进样,若进样量过大,则各物质的出峰分离度会降低,产物纯度也不足,但可在不重新灌注新固定相的情况下反复多次进样,采用相同色谱条件时分离效果可有效保持。本实验取200 mg 进样5 次,发现色谱峰基本保持相同的分离效果,可用于快速大量制备分离紫茎女贞苷A、阿克苷,无需停机、清洗、平衡,分离效率明显,而且5 次进样分离后由于固定相保留良好,还能继续使用,可见HSCCC 法可作为大量制备的基础,增加其规格时能较方便地放大规模。
5 结论
本实验在快速大量分离小叶苦丁茶中阿克苷、紫茎女贞苷A 时,首先以大孔吸附树脂对其水提物进行梯度洗脱分段,发现上述2 种成分能大量富集于50%甲醇部位,再选择乙酸乙酯-正丁醇-水(5∶2∶5) 作为HSCCC 的分离体系,并且在分离过程中采用不停机、多次少量连续进样的方法,可减小仪器负载,提高出峰成分分离度。结果显示,该方法稳定方便,能得到纯度较高阿克苷、紫茎女贞苷A,并且分离时间短,能很好地提高制备效率。由于连续进样5 次能得到稳定的分离效果,故今后研究可在此基础上再进行多次进样,从而进行更大量的分离。
