基于网络药理学探讨肝复乐防治原发性肝癌的作用机制
2021-01-08辉吴芳芳陈路曾杨丽李娟蒋益兰李顺祥
潘 宇 徐 菲 龚 辉吴芳芳陈 路曾杨丽李 娟蒋益兰*李顺祥*
(1.湖南中医药大学,湖南 长沙 410208;2.广西壮族自治区药用植物园,广西 南宁 530023;3.西南濒危药材资源开发国家工程实验室,广西 南宁 530023;4.湖南省中药活性物质筛选工程技术研究中心,湖南 长沙 410208;5.湖南中医药大学附属中西医结合医院,湖南 长沙 410006)
原发性肝癌(hepatocellular carcinoma,HCC)是我国最常见的恶性肿瘤之一,复发转移率、致死率较高[1-2],急需挖掘复方中药对肝癌的潜在治疗价值。肝复乐是国家名中医潘敏求教授经多年临床观察潜心研究而发明的国家级抗癌三类新药,治疗中晚期肝癌的疗效显著[3-6],但该方治疗肝癌发挥作用的药效物质基础、作用机制与作用靶点的国内外相关研究较少。课题组的前期网络药理学试验初步证实[7],磷脂酰肌醇 (phosphatidylinositol 3-kinase catalytic alpha,PIK3CA)、半胱氨酸蛋白酶8 (caspase-8,CASP8) 是肝复乐治疗肝癌的病理网络中的关键调控靶点,并且能影响PI3K-Akt/mTOR/JAkt-STAT/Wnt 等信号传导通路,前人研究[8-9]发现这4 条关键信号传导通路与肝癌的凋亡、增殖、转移、侵袭浸润等病理机制密切相关。本文观察肝复乐对人肝癌HepG-2 细胞的增殖、迁移和侵袭以及PIK3CA、CASP8 蛋白表达的影响,并与网络药理学的研究结果进行验证对比研究。
1 材料
1.1 仪器 RE-5205 型旋转蒸发仪(郑州巩义予华仪器有限责任公司);BSA124S-CW 电子天平(上海沪粤明科学仪器有限公司);BP211D 型万分之一天平(德国Sartorius 公司);SK3300H 型超声波清洗器(上海科导超声仪器有限公司);H1850离心机(上海赵迪仪器有限公司);680 型酶标仪(美国Bio-Rad 试剂公司);CO2恒温培养箱(日本SANYO 公司);754N 型紫外可见光分光光度计(上海天翔光学仪器有限公司);LX71 倒置荧光显微镜(日本奥林巴斯公司);PowerPac 系列电泳仪(美国Corning costar 公司)。
1.2 药物 肝复乐原生药材内的所有小分子化合物搜集来源于中草药在线数据库(TCM-ID、TCM Database@taiwan)。肝复乐21 味中药材饮片[清热解毒组(茵陈、败酱草、半枝莲、重楼)、健脾理气组 (党参、炒白术、黄芪、茯苓、薏苡仁、制香附、陈皮、柴胡、沉香、川木通)、活血化瘀组(醋鳖甲、土鳖虫、桃仁、苏木、生牡蛎、郁金、大黄) ]均由湖南国华制药厂提供,经湖南中医药大学药学院刘塔斯教授鉴定为正品,均符合2020 年版《中国药典》 一部各药材项下要求;盐酸阿霉素 (浙江海正药业股份有限公司,批号86904641000828,规格100 mg);肝复乐清热解毒组、活血化瘀组、健脾理气组、肝复乐全方组4 个醇溶部位;用磷酸缓冲盐溶液(PBS) 溶解,保存于-20 ℃备用,使用前用无血清培养基稀释至所需浓度。
1.3 细胞株 人肝癌细胞株HepG-2 (中南大学湘雅三医院,批号XY-H0203),采用含10% Gibco胎牛血清(FBS) (上海栩冉生物科技有限公司,批号172000-023) 改良,RPMI-1640 培养基常规培养。
1.4 试剂 PIK3CA 一抗(美国CST 公司,批号KL412265);山羊抗兔IgG 二抗(Goat Anti-Rabbit IgG/HRP Antibody) (美国KPL 公司,批号SC-2301);CCK-8 检测试剂盒(上海七海复泰生物科技有限公司,批号250120512);Transwell 试剂盒(美国BD Bioscience 公司,批号B190125);蛋白质定量试剂盒 (美国 Invitrogen 公司,批号L181230);ECL 化学发光试剂盒(美国Pierce 公司,批号P170450);96 细胞培养板(美国Corning costar 公司,批号C160353)。
1.5 数据库和软件 CambrigeSoft ChemOffice 2012(http://www.cambridgesoft.com/),Discovery Studio 2.55 (http://accelrys.com/),Cytoscape 3.7 (http://www.cytoscape.org/)。
2 方法
2.1 网络药理学构建多成分-多靶点-多途径-多疾病的相互作用模型 首先,从TCM-ID (http://www.megabionet.org/tcmid/)、TCM Database@taiwan (http://tcm.cmu.edu.tw/) 中草药数据库归纳整理974 个小分子化合物,并从ChemSpider(http://www.chemspider.com) 下载小分子2D&3D 的MOL 分子结构。然后,从OMIM (http://www.omim.org/) 获取8 个原发性肝癌靶标(AXIN1[10]、CASP8[11]、CTNNB1[12]、TP53[13]、PDGFRL[14]、APC[15]、PIK3CA[16]和MET[17],靶标蛋白信息见表1),靶点之间的相互关系利用String (http://string-db.org/) 在线分析;运用Discovery Studio 2.55 软件中口服生物利用度(OB)、类药性(DL) 作为筛选条件,设置OB≥30%、DL≥0.01,为了进一步筛选潜在活性较高的小分子化合物,继续预测上述筛选后的726个小分子化合物的代谢性质(ADME,吸收、分布、代谢、排泄),设置生物筛选指标(人体肠道吸收,6.1 <ALop < 9.6、25 ℃;水中溶解度,-4.0<log (Sw) <-2.0;穿透血脑屏障,-0.52 <BBB<0.0),逐步筛选出198 个具有潜在抗肝癌活性的小分子,对初步筛选后的小分子化合物与上述的8 个原发性肝癌靶标进行分子对接运算,在Discovery Studio 2.55 利用“Ligand Docking” (配体快速对接) 协议对这些优化后的小分子化合物与靶点蛋白进行分子对接,运用 binding energy、libdockscore、ligscore-1、ligscore-2、PLP-1和ligscore PLP-2 等多个打分函数进行一致性打分,选取亲和力最好的配体,筛选出69 个可能具有潜在活性最强的小分子化合物。分别从KEGG (http://www.genome.jp)、OMIM (http://www.ncbi.nlm.nih.gov/omim) 获取肝癌靶点相关的113 条生物作用途径;利用Cytoscape3.7 (http://www.cytoscape.org/) 软件建立“药物-化合物-靶点-途径-疾病” 的复杂网络相互作用关系模型直观图。

表1 原发性肝癌靶标蛋白Tab.1 Target protein of HCC
2.2 肝复乐药材提取制备 肝复乐全方药材以及3 个功效拆方组药材的溶剂提取法采用专利技术严格制备[18-20],各药材配伍量比关系严格按照其方法进行等比例配伍组方,并根据实验室的实际条件,改进提取工艺。肝复乐上述药材的含有量测定严格采用2010 年版《中国药典》 方法进行测定。肝复乐醇溶部位配制成1 g/mL 的母液,临用前用培养液稀释1 000 倍,使其终浓度小于0.1%。
2.3 细胞培养 人肝癌细胞株HepG-2 采用含10% FBS 改良,RPMI-1640 细胞培养基常规培养,于5% CO2、饱和湿度的37 ℃培养箱中培养,细胞贴壁生长,根据细胞生长状态更换新的培养基,待细胞融合度达90%时,用0.25%的胰蛋白酶消化传代,取对数生长期细胞用于实验。
2.4 分组 实验设置空白对照组、阿霉素组(2 μg/mL),肝复乐清热解毒组(醇溶部位)、肝复乐活血化瘀组(醇溶部位)、肝复乐健脾理气组(醇溶部位)、肝复乐全方组(醇溶部位) 4 个药物组,并分别设置低质量浓度组(2.5 μg/mL)、中质量浓度组(5 μg/mL)、高质量浓度组(10 μg/mL)。
2.5 CCK-8 法检测HepG-2 细胞的增殖影响 取生长良好的对数生长期HepG-2 细胞,接种于96 孔板进行细胞培养。将HepG-2 细胞按“2.4” 项下分组,加入0.1% 二甲基亚砜培养液进行培养,每组设置3 个复孔,培养24、48 h,往各孔细胞中缓慢滴入10 μL CCK-8 溶液,使用细胞酶标仪测定450 nm处的吸光度(OD),计算各组细胞增殖抑制率=(1-OD给药组/OD空白对照组) ×100%。
2.6 Transwell 法检测HepG-2 细胞的迁移能力HepG-2 细胞按“2.4” 项下分组,孵育24 h,常规消化,调整细胞浓度为3×105/mL;Transwell 小室中分别接种细胞200 μL,然后下室加入500 μL 10% FBS 的RPMI-1640 细胞培养基,孵育24 h;使用倒置荧光显微镜,观察附着于小室底膜下表面的细胞形态;在450 nm 波长处,使用酶标仪检测OD,并间接计算迁移的细胞数目。细胞迁移率=(空白对照组迁移细胞数-给药组迁移细胞数)/空白对照组迁移细胞数) ×100%。
2.7 Transwell 法检测HepG-2 细胞的侵袭能力制备Transwell 小室,细胞分组同“2.4” 项下,将各组细胞常规消化,室温孵育,调整细胞浓度为1×105/mL,Transwell 下室加入800 μL 含有15%FBS 的DMEM 细胞培养基;孵育48 h 后用倒置显微镜(200 倍) 观察穿过聚酯纤维膜的细胞,每组随机选取3 个不同的视野进行细胞计数。细胞侵袭率=(1-给药组穿膜细胞数目/空白对照组穿膜细胞数目) ×100%。
2.8 Western blot 法检测CASP8、PIK3CA 蛋白表达 实验按“2.4” 项下分组,收集各组处理后48 h的HepG-2 细胞,裂解10 min,提取细胞中总蛋白。使用BCA 蛋白浓度测定试剂盒对蛋白进行定量,采用聚丙烯酰胺凝胶电泳分离蛋白,以半干法转膜,将一抗用5%脱脂牛奶稀释至适当浓度,二抗用10×TBST 缓冲液稀释至适当浓度,室温下孵育1~2 h 后,洗涤3 次,进行化学发光反应,配置ECL 发光液,育膜5 min,显影、曝光。采用QuantityOne 软件分析,以甘油醛-3-磷酸脱氢酶(GAPDH) 标化,用凝胶图像处理系统进行灰度值分析。
2.9 统计学处理 采用SPSS19.0 统计软件进行统计学分析。计量资料以() 表示,多组间比较采用单因素方差分析,两两比较采用LSD-t 检验;不符合正态性,组间比较采用Wilcoxon 秩和检验;方差不齐时,多组间均数比较采用Dunnett T3 检验。以P≤0.05 为差异有统计学意义。
3 结果
3.1 网络药理学构建多成分-多靶点-多途径-多疾病的相互作用模型 网络相互作用关系模型图拓扑参数分析表明(图1),槲皮素(quercetin) (相邻连接度=292.6,节点度=6)、β-谷甾醇(β-sitosterol) (相邻连接度=363.8,节点度=6)、香草醛(vanilline) (相邻连接度=111.2,节点度=4)、蒿素C (artemisin C) (相邻连接度=243.5,节点度=4)、丁香酮 (eugenone)(相邻连接度=290.8,节点度=5)、D-柠檬烯(d-limonene) (相邻连接度=196.4,节点度=4)、芳樟醇(linalool)(相邻连接度=143.1,节点度=3)、咖啡酸(caffeic acid) (相邻连接度=138.2,节点度=4)和癸酸(capric acid) (相邻连接度=123.4,节点度=3) 等活性成分比其他成分共享更多的靶点,可能在体内的多靶点生物网络中调控更多的核心生物通路(癌症通路、癌细胞凋亡通路、病毒致癌通路和内部免疫调节通路等),Toll-like receptor/JAkt-STAT/PI3K-Akt/信号通路处于核心节点位置。肝癌靶 标 CASP8、PIK3CA、CTNNB1、AXIN1、TP53 是肝复乐21 味药材共享连接的核心靶点,活性分子若与某些疾病靶点相关,则可能对靶点相关的疾病具有潜在治疗作用[10-12]。C 型肝炎、B 型肝炎、结肠癌和乳腺癌处于疾病网络关键节点,揭示肝复乐极有可能对这些癌症具有潜在的临床治疗作用。肝复乐理气健脾组比清热解毒组、活血化瘀组含有更多数量药材与活性成分,并通过多靶点影响多条生物途径发挥疗效。茵陈(yinchen) (相邻连接度=846.2,节点度=21)、柴胡(chaihu) (相邻连接度=580.8,节点度=14)、黄芪(huangqi)(相邻连接度=361.6,节点度=6)、沉香(chenxiang) (相邻连接度=128.3,节点度=5)、党参(dangshen) (相邻连接度=246.3,节点度=10)、大黄(dahuang) (相邻连接度=132.1,节点度=19)、白术(baishu) (相邻连接度=133.6,节点度=5)这7 味药材网络节点比其它药材网络节点体现更好的拓扑学性质(图2),揭示这7 味药材极有可能组成新的优化精简组方,可对该方的活性成分进行深入研究,提高肝复乐治疗肝癌的临床效果。
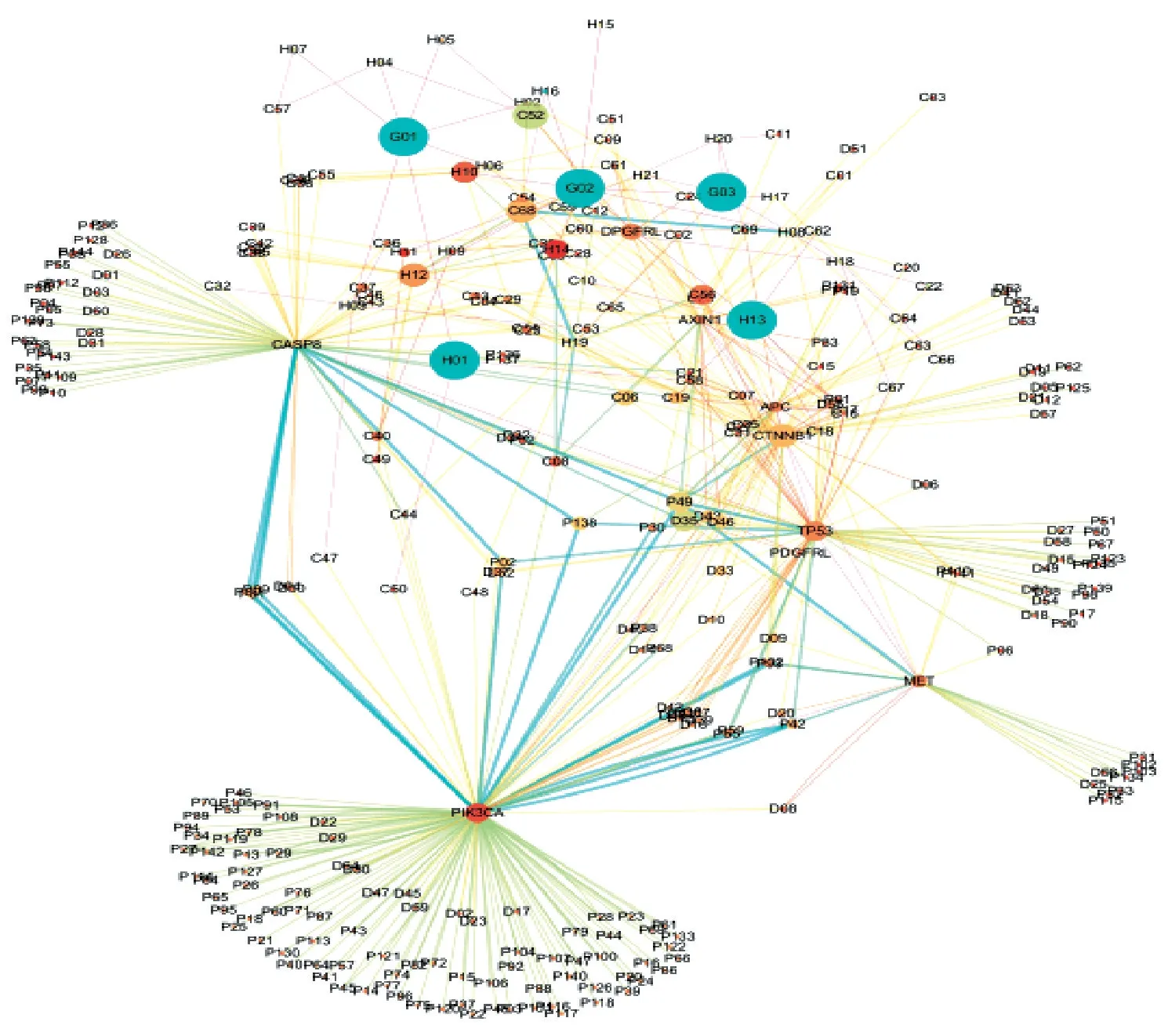
图1 肝复乐功效拆方组-药材-成分-靶点-靶点-生物途径-疾病网络Fig.1 Fuctional group-herbal medicine-ingredients-targetstargets-biological pathways-disease network of GFL

图2 肝复乐功效拆方组-药材-成分-靶点-靶点Fig.2 Fuctional group-herbal medicine-ingredients-targets-targets network of GFL
3.2 人肝癌HepG-2 细胞形态学观察 将2.5、5、10 μg/mL (低、中、高质量浓度组) 的肝复乐4个醇溶部位分别作用于HepG-2 细胞48 h 后,空白对照组细胞形态均发生变化,细胞贴壁能力下降,可见核固缩、核碎裂和核溶解。当药物浓度逐渐升高,细胞形态变化愈加明显,贴壁细胞数目占细胞总数的比例逐渐减小(图3)。
3.3 肝复乐对HepG-2 细胞的增殖影响 如图4 所示,药物处理HepG-2 细胞24、48 h 后,5 μg/mL肝复乐全方组、肝复乐健脾理气组细胞抑制率高于5 μg/mL 肝复乐清热解毒组、肝复乐活血化瘀组(P<0.05);2.5 μg/mL 肝复乐全方组处理HepG-2细胞24 h 细胞增殖抑制率高于2.5 μg/mL 肝复乐功效拆方组(P<0.05),但是处理48 h,肝复乐各浓度组细胞抑制增殖率并无明显差异(P>0.05)。给药48 h 后,10 μg/mL 肝复乐健脾理气组抑制HepG-2 细胞增殖抑制率高于10 μg/mL 其他药物组(P<0.05),由此可见,给药48 h 后,肝复乐全方中、高质量浓度组对HepG-2 细胞抑制比较明显,因此作为后续细胞迁移、侵袭与蛋白表达影响实验作用浓度。

图3 肝复乐醇溶部位作用HepG-2 细胞48 h 对细胞形态的影响(×200)Fig.3 Effects of alcohol soluble fraction of GFL on morphological changes of HepG-2 cells in 48 h (×200)
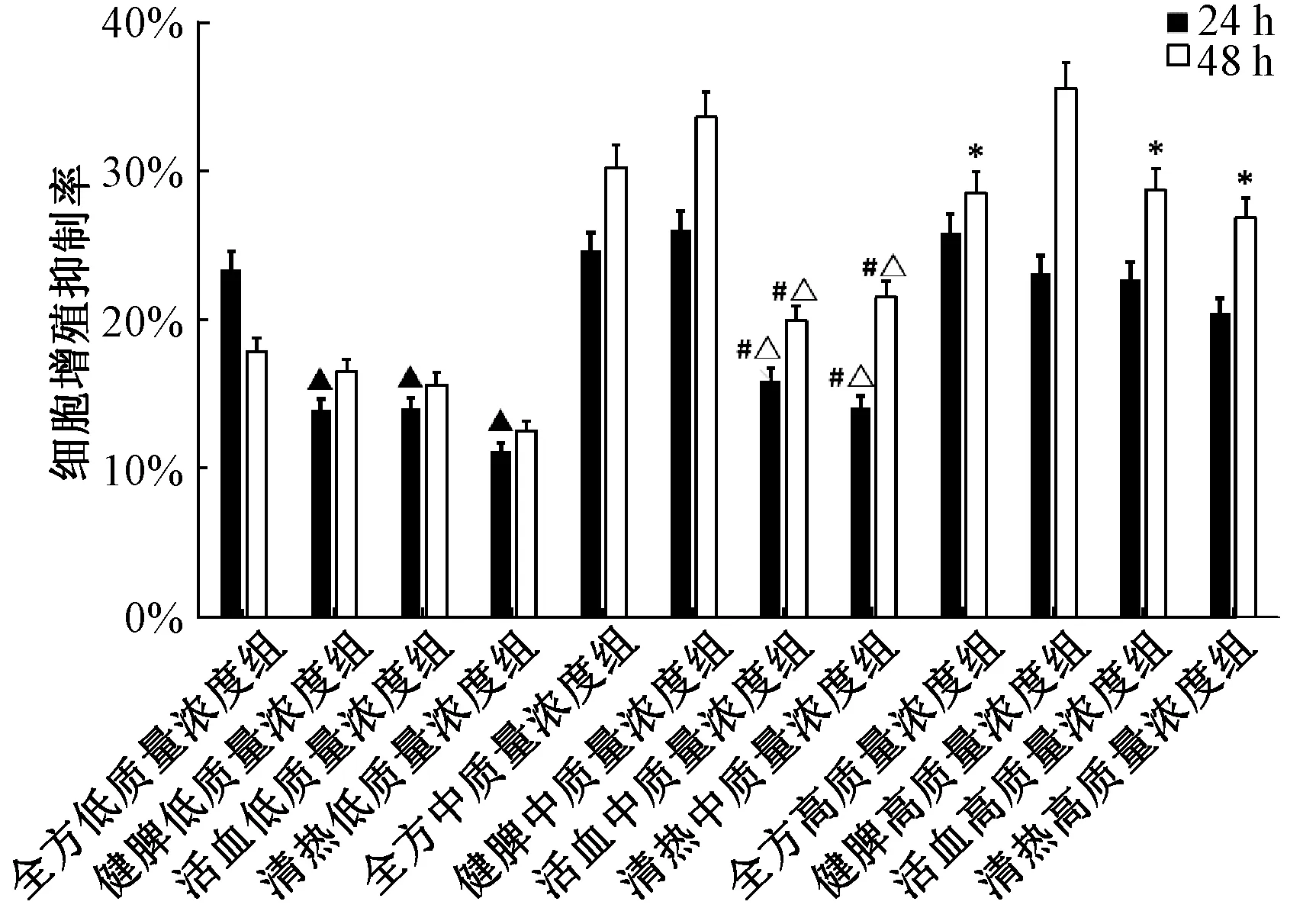
图4 肝复乐醇溶部位对HepG-2 细胞增殖的影响(×200,n=3)Fig.4 Effects of alcohol soluble fraction of GFL on proliferation of HepG-2 cells (×200,n=3)
3.4 肝复乐对HepG-2 细胞的迁移影响 给药48 h后,与空白对照组比较,肝复乐功效拆方组无细胞迁移抑制作用(P>0.05),肝复乐全方组、阿霉素组抑制细胞迁移(P<0.05)。与阿霉素组相比,5、10 μg/mL 肝复乐全方组干预的HepG 细胞视野中不同透膜细胞数目相对略多,细胞间隙略大,叠加生长的细胞数目略多,说明阿霉素组抑制肝癌细胞迁移能力略强于肝复乐全方组,肝复乐全方组细胞迁移率差异无统计学意义(P>0.05);肝复乐3 个功效拆方组细胞迁移率降低(P<0.05)。见表2、图5。
3.5 肝复乐对HepG-2 细胞的侵袭影响 给药处理HepG-2 细胞48 h 后,随着药物浓度的增加,视野中透膜的细胞数目逐渐减少,细胞形态逐渐变为圆形或椭圆形,细胞间隙也逐渐增大。与空白对照组比较,肝复乐全方组、阿霉素组能抑制人肝癌HepG-2 细胞的侵袭(P<0.05)。5 μg/mL 肝复乐3个功效拆方组细胞穿膜数目相对5 μg/mL 肝复乐全方组减少(P<0.05),说明肝复乐全方中浓度组对细胞侵袭能力的抑制作用明显强于肝复乐功效拆方中浓度组。见表3、图6。
表2 肝复乐醇溶部位对HepG-2 细胞迁移能力的影响(,n=3)Tab.2 Effects of alcohol soluble fraction of GFL on migration of HepG-2 cells (,n=3)

表2 肝复乐醇溶部位对HepG-2 细胞迁移能力的影响(,n=3)Tab.2 Effects of alcohol soluble fraction of GFL on migration of HepG-2 cells (,n=3)
注:与空白对照组比较,▲P<0.05;与阿霉素组比较,#P<0.05。
表3 肝复乐醇溶部位对HepG-2 细胞侵袭能力的影响(,n=3)Tab.3 Effects of alcohol soluble fraction of GFL on invasion of HepG-2 cells (,n=3)

表3 肝复乐醇溶部位对HepG-2 细胞侵袭能力的影响(,n=3)Tab.3 Effects of alcohol soluble fraction of GFL on invasion of HepG-2 cells (,n=3)
注:与空白对照组比较,▲P <0.05;与全方中质量浓度组比较,△P<0.05;与阿霉素组比较,#P<0.05。

图5 肝复乐醇溶部位对HepG-2 细胞迁移的影响(×200)Fig.5 Effects of alcohol soluble fraction of GFL on migration of HepG-2 cells (×200)

图6 肝复乐醇溶部位对HepG-2 细胞的侵袭影响(×200,n=3)Fig.6 Effects of alcohol soluble fraction of GFL on invasion of HepG-2 cells (×200,n=3)
3.6 肝复乐对HepG-2 细胞的CASP8、PIK3CA 蛋白表达的影响 与空白对照组比较,肝复乐全方及功效拆方组作用于HepG-2 细胞48 h 后,CASP8、PIK3CA 蛋白表达降低(P<0.05);与阿霉素组比较,10 μg/mL 肝复乐健脾组、全方组CASP8、PIK3CA 蛋白表达下调(P<0.05),但在肝复乐清热组、活血组蛋白表达,差异无统计学意义(P>0.05)。见图7。
4 讨论

图7 肝复乐对HepG-2 细胞的CASP8、PIK3CA 蛋白表达的影响(n=3)Fig.7 Effects of Ganfule on expression of CASP8 and PIK3CA related proteins of HepG-2 cell (n=3)
前期网络药理学实验表明[7],肝复乐是通过多成分、多靶点、多途径来调控疾病病理网络重新恢复机体平衡。挥发油类,比如香草醛、蒿素C、丁香酚、D-柠檬烯、咖啡酸单体化合物可能是抗肝癌活性具有最明显效果的活性组分,需要未来的药理实 验进一 步验证。CASP8、PIK3CA、CTNNB1、AXIN1、TP53 是肝复乐21 味药材共享连接的肝癌核心靶标,这些靶标可作为下一步的测试体外肝癌细胞内验证靶点蛋白的表达水平。核心靶标与PI3K-Akt/mTOR/JAkt-STAT/Wnt 信号传导通路密切相关,肝复乐的抗肝癌作用机理很有可能是能通过CASP8、PIK3CA 核心靶标调节这4 个信号传导通路。文献报道[21-23]这4 个信号通路与常见恶性肿瘤增殖病理机理密切相关,比如肝细胞癌、胰腺癌、非小细胞肺癌、结肠癌与乳腺癌。网络药理学揭示肝复乐可能对胰腺癌、结肠癌、非小细胞肺癌、人类T 淋巴细胞白血病、病毒I 型感染等疾病具有治疗作用,这需要进一步的临床试验加以验证。
肝复乐全方组能明显抑制HepG-2 细胞迁移能力和侵袭能力,几乎等同于阿霉素的干预效果(P>0.05)。肝复乐3 个功效拆方组与全方组相比,对HepG-2 细胞迁移能力及侵袭能力并无明显抑制作用。分别用中质量浓度组(5 μg/mL)、高质量浓度组(10 μg/mL),在相同时间(48 h) 处理HepG-2 细胞,相互比较3 个功效拆方组抑制HepG-2 细胞的迁移与侵袭影响,结果并无统计学差异(P>0.05),推测肝复乐3 个功效组可能对HepG-2 细胞并无明显的迁移与侵袭影响。上述实验表明肝复乐健脾理气组通过提高人体的免疫能力来发挥抗肝癌的功效,可能并不是通过干预癌细胞迁移、侵袭的作用途径,也许是通过抑制癌细胞血管内皮生长因子、诱导癌细胞凋亡等其他机制发挥疗效。本实验的结果具有一定的局限性,这需要开展后续相关实验进行证实。另外推测,肝复乐功效拆方组的药物浓度或者作用时间,可能并未达到具备干预影响效应的临界值,需要提高浓度或者延长作用时间,此初步结论尚需进一步的研究探讨。
观察肝复乐不同浓度的药物组作用于PIK3CA、CASP8 蛋白的表达影响,本实验结果分析,与对照组比较,肝复乐全方组以及3 个功效拆方组均能明显调控PIK3CA、CASP8 蛋白的表达(P<0.05),并且调控水平随浓度增加而增强。与阿霉素组相比,肝复乐全方组、健脾理气组的调控水平差异具有统计学意义(P<0.05),但是,肝复乐清热解毒组、活血化瘀组,均无统计学差异(P>0.05)。此结果揭示,肝复乐全方组可能通过对HepG-2 细胞的增殖、迁移与侵袭相关的致癌关键因子PIK3CA、CASP8 靶点蛋白的影响,来调控PI3K/Akt/JAkt-STAT/Wnt 信号传导通路。并进一步证实了肝复乐全方组的配伍效果以及临床疗效明显优于清热解毒组、活血化瘀组与健脾理气组,这一结论与前期实验结果比较吻合,进一步加强了网络药理学的结论的可靠性与真实性,并与肝复乐的发明人潘敏求教授的实验结果保持一致。
肝复乐全方组调控PIK3CA、CASP8 蛋白的表达,比清热解毒组、活血化瘀组、健脾理气组等3个功效拆方组更具明显差异。肝复乐健脾理气组调控PIK3CA、CASP8 蛋白的表达比清热解毒组、活血化瘀组更加明显。结果揭示肝复乐可能是通过调控PIK3CA、CASP8 蛋白表达,间接干预PI3KAkt/mTOR/JAkt-STAT/Wnt 等信号传导通路。体外细胞株的实验结果并不能完全代替人体肝癌发病机制,本实验在HepG-2 细胞株上的细胞和蛋白的观察情况,是否在人体肝癌中具有相同效应仍不确定。另外PIK3CA、CASP8 靶点蛋白对HepG-2 细胞基因表达谱影响的作用机制尚不明确,需要今后进一步深入研究。
