手性磷酸及其催化的亚胺不对称反应*
2021-01-08李红亮
曹 瑞,李红亮
(天津大学 药物科学与技术学院,天津 300072)
手性在自然界广泛存在,在组成生命系统的生物大分子中,自然界中经常存在对映异构体,例如L-构型氨基酸,D-构型糖和右旋糖蛋白等。对于生物而言,两种对映异构体表现出的生物活性通常是不同的,甚至是完全相反的[1]。20 世纪50 年代的“沙利度胺”也给了人们一个非常严重和重要的警示。让科学家们开始更加重视对于手性分子和手性药物的研究,其中手性有机胺化合物广泛存在于天然产物和体内。特别是由于其通常具有丰富的生物活性,已经成为现代有机合成化学和药物化学中的研究热点。为此,就近年来手性H3PO4催化的亚胺不对称反应类型特别是亚胺加成反应进行综述。
1 手性H3PO4 简介
1.1 手性H3PO4 特点
从开发过程和催化剂类型来看,不对称催化反应可分为以下3 种类型:酶催化,手性金属络合物催化和有机小分子催化。与酶催化和手性金属配合物催化相比,有机小分子催化是一种不需重金属的手性有机小分子的直接方法[2]。由于催化效果等类似酶催化,有机小分子催化剂通常被称为人工酶或酶类似物,催化反应所需催化剂量少,催化效果可观,反应无污染,条件温和。
目前,成熟的催化模式包括:共价键催化模式(烯胺催化,亚胺催化,SOMO 催化)和非共价键催化模式(离子对催化模式和氢键催化模式)。有机催化理论的发展促进了有机催化剂合成的发展。经过十多年的不断发展和突破,它已从复杂分子的最初构建扩展到工业上的实际应用。有机小分子催化已逐渐成熟[3]。
手性H3PO4和手性磷酸盐催化由于其结构特征和出色的对映选择性而成为科学家的重要分支[4]。首先手性H3PO4具有很强的酸性。在二甲亚砜溶剂中,其pKa 值在2~4 之间[5]。分子中的磷原子呈环状结构,通过调节周围的取代基,尤其是手性联萘酚骨架的3,3'-位置,使其无法围绕单键自由旋转,形成某种立体结构类型,如果引入不同的取代基,则可以通过稍微改变催化剂的空间立体结构来控制催化反应的立体选择性。从手性磷酸催化剂的结构来看,连接到磷原子上的羟基可作为Br nsted 酸的酸性位点或可与底物形成氢键,而双键上的氧原子磷原子还可以作为Lewis 碱提供孤对电子,因此手性磷酸酯是一种双功能催化剂。
1.2 手性H3PO4 的开端
2004 年,Akiyama 和合作者(图 1a)[6]报告了 BINOL衍生的手性H3PO4催化的亚胺与甲硅烷基烯酮缩醛的反应,并获得了优异的收率和对应选择性。这是首次报道由无金属手性Br nsted 酸活化的对映选择性的Minnich 反应,这是制备手性β-氨基羰基化合物的有用方法。他们发现,使用芳族溶剂进行反应会得到更高对映选择性,并且仅在少量Br nsted酸(10 mol%)的存在下足以维持良好至高对映选择性。在所有产物中,化学收率都非常好。根据实验结果,他们提出了可能的反应机理。手性H3PO4的P=O双键氧与亚胺羟基氢形成氢键,手性磷酸酯的羟基和亚胺N 形成氢键,功能性催化形成九元环状中间体亚胺盐的过渡态,然后与甲硅烷基醚反应以获得最终目标产物。
在同一时期,Terada 及其同事(图 1b)[7]报告了一种新的手性磷酸Br nsted 酸结构,它可以通过形成氢键来加速Mannich 反应的高对映选择性的形成。他们证明了该催化剂是一个优良的催化剂,亚胺可以在Boc 基团的保护下实现乙酰丙酮加成反应,从而在温和条件下在亚胺上合成α-氨基酮。他们还发现,通过将1-萘基连接到催化剂的3,3'-位可以增加催化的空间位阻,从而使收率高达99%,对映选择性高达95%。通过两位科学家的探索,鼓励我们通过改变催化剂的3,3'-位取代基或结构来提高对映选择性。

图1 手性磷酸催化Mannich 反应Fig.1 Chiral PA-catalyzed mannich reaction
2 手性H3PO4 催化亚胺的不对称加成反应
2.1 由碳原子亲核试剂进攻亚胺不对称反应
在有机化学中,F-C 反应是形成新的碳-碳键的最常用方法。它广泛用于有机合成中,并在很长一段时间内引起了化学家的关注。由于有机小分子催化的许多优点,化学家对手性H3PO4催化的不对称F-C 反应产生了兴趣。对于某些富电子芳环,可以实现对亚胺,醛或酮,α-β-不饱和醛或酮和烯胺具有高对映选择性的不对称F-C 反应。2004年,Terada(图 2a)[8]报告说,呋喃和 N-Boc 亚胺衍生物可实现1,2-氮杂-Friedel-Crafts 反应。作为Br nsted 酸的手性H3PO4具有良好的收率,并且描述了较高的ee 值(产率高达96%,ee 值高达97%),并且在该产品中,该产物可以通过氧化裂解而合成呋喃环成γ-丁烯内酯。
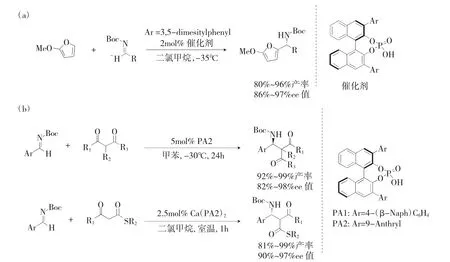
图2 有机催化不对称氮杂-Friedel-Crafts 烷基化Fig.2 Organocatalytic asymmetric aza-friedel-crafts alkylation
2010 年,Ishihara(图 2b)[36][9]推测,具有更强Br nsted 酸的碱金属或碱金属磷酸盐配合物可能比手性H3PO4更有效,从而获得更高对映选择性的1,3-二羰基化合物。在实验过程中,他们发现Terada之前报道的手性H3PO4PA1 在与碱金属络合后并未显示出较高的ee 值,但有趣的是,与钙盐络合的手性磷酸酯具有与用硅胶纯化的手性H3PO4相似的结果。他们发现,具有更高空间要求的催化剂PA2 相比以前的催化剂可获得更好的结果。确定催化剂后,他们着重研究了用HCl 洗涤的无金属手性H3PO4的催化作用,并报告说在无金属存在下,它可以有效催化醛亚胺和各种1,3-二羰基化合物的反应。手性H3PO4或手性Ca3(PO4)2。他设想无论是高纯度的无金属手性H3PO4还是与金属铁络合的手性磷酸盐,都将为我们带来意想不到的惊喜。
当前实现的亚胺加成反应更多地受到碳原子的攻击。 在 2011 年,Terada 及其同事(图 3)[10]报道了使用亚胺的Hosomi-Sakurai 反应可以获得对映选择性优异的产品。文章以烯三甲基硅烷为原料开发了一种新的联合Br nsted 酸体系,另外的Br nsted酸促进了质子向甲硅烷基化手性Br nsted 酸的转移。这是双酚衍生的H3PO4的新发现功能,其反应与以前开发的硅亲核试剂完全不同。总之,他们证明手性Br nsted 酸催化亚胺与烯丙基和丙基三甲基硅烷的高度对映化学反应,这为使用稳定硅试剂在不对称合成中起到了关键作用。

图3 手性Br nsted 催化的对应选择性Hosomi Sakurai 反应Fig.3 Chiral br nsted acid catalysis for enantioselective hosomi sakurai reaction
2.2 由氧原子和硫原子亲核试剂进攻亚胺不对称反应
手性N,O-缩醛存在于许多有趣的天然产物和一些重要的药物结构中,其结构尤其是立体化学在世界上起着重要作用。2008 年,Antilla 的研究小组[11]首次报道,在温和的反应条件下,可以通过简单的方法以高收率和优异的对映体过量进行醇与手性H3PO4加成N-嘧啶的不对称反应,从而制备手性N,O 缩醛。实验表明,无水醇和溶剂对于实现高对映选择性是必不可少的。尽管该反应具有很强的背景反应,但它可以在催化剂存在下主导明显的背景反应,从而为所需产物提供了如此高的对映选择性。(图4)合成手性含硫化合物的方法是手性金属络合物或有机催化剂以共轭添加含硫试剂。3 年后,Antilla 及其同事[12]再次证明手性BINOL H3PO4是一种非常有效的不对称催化剂,能够在极低的存在下与硫醇和N-酰基亚胺形成手性N,S-乙缩醛。催化剂,具有优异的收率和高对映选择性。该响应非常有效,可以提供高度的不对称感应。这是用手性催化剂进行的N,S-缩醛的首次对映选择性合成。该合成方法具有广泛的底物,可以使人们获得新的手性硫化物,并可以用作潜在的具有治疗意义的重要结构单元(图 4)。

图4 亚胺的不对称加成反应:对应选择性合成N,O 缩醛和N,S 缩醛Fig.4 Catalytic asymmetric addition to imines: enantioselective preparation of chiral N,O-aminals and chiral N,S-acetals
2.3 由氮原子亲核试剂进攻亚胺不对称反应
众所周知,氮亲核试剂与亚胺的加成已得到广泛研究,已经通过不对称加成方法获得了许多有效的含氮手性化合物,存在于药物分子和许多生物活性化合物中。尽管对亚胺的加成反应已有很长的历史,但是由于N,N'-乙缩醛的不稳定性和潜在的敏感性,其不对称添加仍在研究中。
长期以来,亲核试剂对亚胺的攻击一直是许多研究小组关注的焦点,Antilla 的研究团队[13]首先报道,在手性VAPOL 衍生的磷酸作为催化剂的情况下,实现了不对称加成氮攻击亚胺形成N,N 氨基化合物的反应。文章提到,在实验开始时发现,许多BINOL 骨架催化剂均不能得到良好的反应结果,只有在尝试了VAPOL 磷酸以实现高收率(高达99%)和高ee 值(高达99%)时才能达到良好的催化效果。结果表明,手性VAPOL 磷酸可以催化BINOL不能完成的一些不对称反应,其结构特征可以在一定条件下提高反应的立体选择性。此外,他们还尝试了底物的适用性,这种不对称反应可以在室温下实现各种磺酰胺攻击的芳族亚胺。

图5 锌-苯酚催化的吲哚及其衍生物的亚胺Fig.5 Addition of indole and derivatives to aldimines catalyzed by Zn-prophenol
尽管手性含N 的烷基化产物本身具有极高的稳定性并广泛存在于合成化学和天然产物中,但它通常存在于环状体系中以增强稳定性。2017 年,Trost及其同事(图5)[14]首次报道,锌-苯酚双核配合物可以在极温和的条件下催化吲哚与亚胺的对映体选择性N- 烷基化,在较高温度下达到高对映体比率。同时,他们也惊讶地发现该方法也适用于吲哚及其衍生物,吡咯和咔唑,对于相应的N-烷基化产物也可以获得类似的结果。吲哚手性N-烷基化产物首次用于进一步的有机转化和药物化学,从而打开了一个新的窗口。
以往的报道中,没有报道向酮亚胺中添加胺亲核试剂可产生无环的N,N'- 乙缩醛。 最近,Duan和他的同事们[15]发表了一种由奎宁衍生的手性尿素催化的酮胺酮芳基胺,其收率很高(78%~99%),对映选择性也很高(76%~96%ee)。通过进一步优化反应条件,仅需要催化剂用量的5 摩尔%,在-30℃的MTBE 中,就可以获得30 多种衍生自芳族胺攻击靛蓝的酮亚胺,在所有情况下都可以获得令人满意的结果。文章提出了使用立体构象的可能过渡态模型。出乎意料的是,他们尝试了克级反应,可以获得良好的收率和良好的ee 值。
3 手性H3PO4 催化亚胺的对映选择性还原
尽管已知对酮和烯烃进行选择性氢化有许多对映选择性,但是亚胺的对映选择性还原以获得手性胺仍然是一个更具挑战性的项目。

图6 酸催化亚胺的不对称氢化反应Fig.6 Enantioselective br nsted acid catalyzed organocatalytic reduction of imines br nsted
2005 年,Rueping 及其同事(图 6)[16]开发了首个对映选择性Br nsted 酸催化的亚胺还原反应。 他们发现,当时研究的最多的质子酸对于这种不对称氢化是不好的,因此,他们决定使用手性H3PO4作为催化剂。在筛选催化剂,反应溶剂和温度后,确定最终的最佳反应条件。使用二氢吡啶类似物作为氢源和BINOL 磷酸作为催化剂还原酮亚胺,可以使用小的有机分子催化亚胺生成光学活性胺成为一种有前途的化学方法。
4 结论
手性H3PO4在发展的过程中实现了很多其他类型催化剂不能实现或不能达到的催化效果,在不对称催化的历史上起到了不能替代的作用,这是由于其特殊的化学结构以及合适的酸度能够很好的控制不对称反应的对应选择性。手性H3PO4催化体系下,实现了对于亚胺的多种反应,亚胺的不对称加成及亚胺的不对称转移氢化反应等。本文概述了手性磷酸催化剂催化亚胺不对称反应的广泛应用,对于亚胺的不对称反应也已经实现了多种反应类型,但目前应用实例还较少,需要后期更加深入的研究作用机理,能够在保证催化效果的同时扩大反应类型。对于手性磷酸催化剂,相信其会在以后的许多反应中都能够得到令人惊喜的成果,发挥出它的巨大优势。
