膀胱内肾源性腺瘤合并双肾重度积水1例报告并文献复习
2021-01-08张文圣
张文圣 陶 韬
江西省九江市第一人民医院泌尿外科,江西九江 332000
肾源性腺瘤(nephrogenic adenoma,NA)是泌尿系统一种罕见的尿路良性肿瘤,其发病机制尚不明确。NA发生很可能是由脱落的肾小管细胞的播种和增殖所导致[1],最常见于膀胱,其次是尿道、输尿管和肾盂[2]。NA 的诱发因素主要是泌尿生殖系统创伤和慢性炎症[3],其发病病因可能与尿路手术史、结核病史、间质性膀胱炎、泌尿系结石、永久性导管和尿道狭窄相关[4]。由于本病发病率低,临床症状缺乏特异性,易与尿路上皮肿瘤混淆,术前诊断相对困难,且在国内外均较少报道。现将九江市第一人民医院2019年12月20日收治的1例膀胱内NA 合并双肾重度积水病例报道如下。
1 病例资料
1.1 一般资料
患者,女,17岁,因“双侧输尿管膀胱再植术后15月伴双侧腰痛1 d”于2019年12月20日入院。既往身体一般,曾因双侧输尿管膀胱连接部狭窄并双肾重度积水于2018年10月在外院行经腹腔双侧输尿管膀胱再植术;于2019年8月在外院行智能臂辅助经腹腔镜左侧肾盂输尿管成行术。入院查体:双侧肾区无隆起,双侧肾区轻度叩击痛,双侧输尿管走行区无压痛,未闻及血管杂音,耻骨上膀胱区无压痛,浊音界阴性,肛门及外生殖器外观正常。辅助检查:血常规、肝肾功能电解质、凝血、肿瘤指标等无异常。心电图、胸片无异常。泌尿系CT:双肾重度积水。静脉泌尿系造影IVU 示:双肾Ⅲ°~Ⅳ°积水;静脉肾盂造影具体过程:经静脉注入造影剂后分别摄片,双肾延迟显影,肾盂肾盏明显扩张,杯口显示不清,呈球状膨大,可见少许造影剂间或通过下行至膀胱内,双侧输尿管显示不清;膀胱充盈尚可、显影淡薄。泌尿系彩超显示双肾积水(中重度),右肾肾盂肾盏分离约46 mm,左肾肾盂肾盏分离约42 mm。肾动态显像+肾小球滤过率测定:左肾肾小球滤过率 (GFR)29.03 mL/min,右肾GFR 54.18 mL/min。
1.2 方法
①气管插管全身麻醉后,取膀胱截石位,常规消毒、铺巾,常规以F8/9.8 输尿管硬镜,找到左侧输尿管口,插入COOK 导丝,沿着导丝插入输尿管镜,术中输尿管镜探查未发现输尿管狭窄,可见陈旧性手术瘢痕,保留超滑导丝,退出输尿管镜,沿超滑导丝置入F-6 双J 管一根;同法检查右侧输尿管,探查未发现输尿管狭窄,保留超滑导丝,退出输尿管镜,沿超滑导丝置入F-6 双J 管一根。②更换F26 OLYMPUS 等离子电切镜,直视下插入电切镜,探查发现膀胱左、右底壁及顶壁多个乳头状新生物,考虑膀胱肿瘤;遂用等离子电切环将全部肿瘤切除达浅肌层,创面及周围黏膜电凝止血,检查创面无活动性出血;EILICK 冲洗膀胱,吸出肿瘤碎片组织,退出电切镜,留置F22 气囊导尿管一根,气囊注水20 mL。术程顺利,术中少量出血。术后病理组织:膀胱黏膜呈乳头增生,部分钉突状,少量腺管形成(图1)。免疫组化:GATA-3(-),PAX-8(+)(图2),PAX-2(+),ER(-),CK20(-),CK7(+),CDX-2(-),CD10(-),P63(-),34βE12(+)(图3),CD34(-),ERG(-),Villin(-)。(膀胱)结合形态及免疫组化符合NA。结合患者病史及辅助检查,诊断为双肾积水合并膀胱内NA,已行双侧输尿管支架置入术及膀胱肿瘤电切术,术后恢复良好出院。
2 讨论
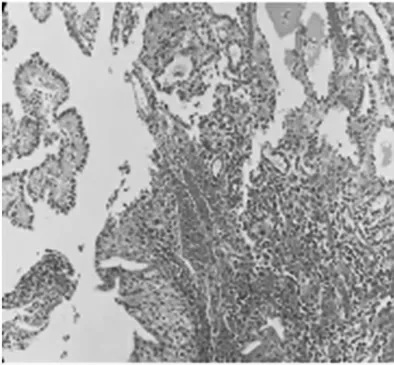
图1 膀胱肿物切除后病理组织(HE 染色,100×)
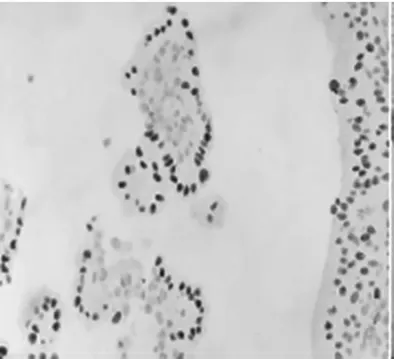
图2 上皮细胞PAX-8(+)(免疫组化染色,100×)
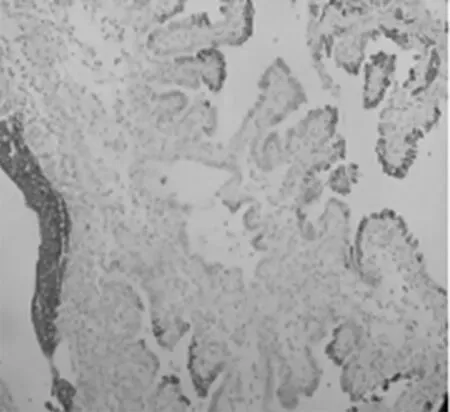
图3 上皮细胞34βE12(+)(免疫组化染色,100×)
NA是泌尿系统一种罕见的良性增生性病变,属于尿路良性肿瘤,其发病机制尚不明确,其发生与泌尿系创伤及慢性炎症相关。“肾源性腺瘤”一词是弗里德曼和库伦贝克[5]在1950年提出的,因为该病灶与肾小管相似,提示其起源于尿路上皮的中胚层潜能。而1949年戴维斯在文献中就报道了第1例,并将其形容为良性瘤状病变[6],这些病变形状大多数为乳头状或息肉状,还有扁平状及肉眼可见的病变[1]。NA 的发病机制主要有3种理论,包括炎症理论、肾小管种植理论和胚胎学理论。炎症理论认为NA是由尿路上皮在长期慢性炎症刺激下发生,是尿路上皮对损伤的一种反应性病变,是一种化生性病变[7]。肾小管种植理论则认为NA是由脱落的肾小管细胞种植导致[8]。胚胎学理论则认为NA 起源于残留的中肾管,是一种发育异常[9]。国外有研究显示,肾小管特异性上皮标志物PAX2、PAX8 在大部分NA 病例中表达阳性[10];国内有学者[11]在个案报道内容中提到PAX2、PAX8 表达接近100%。除了表达上述两者特异性标志物外,部分NA也可表达AMACR(P504S)和34βE12,但不表达P63、PSA[12]。该病可发生在泌尿系统任何部位,多见于成人,儿童仅占一小部分,且儿童复发率很高,儿童已报道约30例NA[13-14]。泌尿系NA 中,约有80%发生于膀胱,尿道占15%,输尿管占5%,肾盂相对少见。膀胱NA是泌尿系统最常见的泌尿系NA,好发于膀胱颈部和邻近输尿管处,在形态学上与膀胱尿路上皮肿瘤很相似,容易混淆,膀胱镜下病变大多数局限,体积较小,直径≤1 cm[15];就流行病学而言,与膀胱尿路上皮肿瘤相比,其发病也很少见。NA 临床症状并无特殊,通常表现血尿(40%),耻骨上痛(15%),胁腹痛(5%)或尿路刺激症状[16],膀胱镜下一般可以发现,其外观形态与膀胱肿瘤很相似,因此很容易误诊为尿路上皮肿瘤,两者需行病理检查分析其组织学形态,同时需结合肾小管特异性上皮标志物予以鉴别。
综上所述,NA 虽然为良性病灶,但可以模拟多种恶性肿瘤,如透明细胞腺癌、前列腺腺癌和尿路上皮癌等[17],有发展为恶性肿瘤的风险。有研究显示既往多次复发的膀胱NA,最后进展成为透明细胞腺癌[18]。因此,NA 仍需积极治疗。膀胱NA 主要治疗方案是经尿道膀胱病损切除术(TUR),对于无效的TUR,很少需要部分或全部膀胱切除术[14]。NA 在长期的随访中复发率很高,预防复发成为治疗NA 的关键。Young 等[19]研究显示,透明质酸钠可有效预防或延迟复发,但其预防复发的作用机制尚不明确,建议行膀胱镜检查用于检测复发。笔者认为该患者双肾积水很可能是由于先天性输尿管狭窄导致,已在外院手术治疗,此次出现腰痛不适,复查后肾积水仍存在,在此次手术中并未发现明显输尿管狭窄,可见手术瘢痕,考虑可能与手术后炎症或缺血性的瘢痕导致局部固定,或膀胱输尿管回流障碍、输尿管周围纤维化导致肾盂输尿管交界处或输尿管的梗阻有关。此次手术发现膀胱NA,考虑与以前行输尿管膀胱再植术及肾盂输尿管成形手术密切相关;考虑脱落的肾小管细胞种植,与大多数其他报告的病例相似,从本病例的病史来看,其更倾向于肾小管种植理论。该患者治疗以手术切除病灶为主,不需要放化疗或者其他辅助治疗,但需要定期复查膀胱镜,用于检测早期肿瘤复发及预防肿瘤恶化、转移。目前国内对于膀胱内NA 报道较少,因此NA在临床上规范治疗存在一定难度,但是对于术后的患者应密切随访。因目前样本例数少,NA 发生机制及治疗仍需进一步探讨与研究。
