六味地黄丸联合树突状细胞对胃癌细胞的抑制作用
2021-01-08孙小艳林黎娟
孙小艳 于 波 林黎娟
1.辽宁省丹东市第一医院消化内科,辽宁丹东 118000;2.辽东学院分子实验室,辽宁丹东 118000
我国是全球胃癌发病率和死亡率最高的国家之一。近年来胃癌的发病率居高不下,并逐年呈年轻化趋势发展[1]。胃癌早期手术效果较好,但大部分胃癌患者就诊时已经是肿瘤的中晚期,失去了手术时机。生物免疫疗法是继手术、放疗、化疗后的第四种疗法,可以增强机体抗肿瘤的免疫杀伤能力[2]。树突状细胞是目前发现的功能最强的抗原呈递细胞,其可以加工处理抗原,并以抗原肽MHC1类分子复合物的形式,将抗原信息提呈给T细胞,有效激活初始T细胞,高效介导特异性抗原的免疫应答。树突状细胞能将肿瘤抗原提呈给各种效应细胞,并促进其增殖,此作用是其他免疫细胞如巨噬细胞或B细胞的数百倍[3-4]。目前,针对黑色素瘤、甲状腺癌、乳腺癌、肾癌、卵巢癌等恶性肿瘤的临床实验显示,树突状细胞在治疗恶性肿瘤上具有一定效果[5-8]。在肿瘤治疗中已显示出广阔的应用前景[9]。但是目前树突状细胞的生物免疫治疗在肿瘤的治疗中只能发挥其辅助作用,原因一方面为树突状细胞具有异质性,体内数量甚微,外周血淋巴细胞中的树突状细胞比例不足1%[10];另一方面为免疫源性较低的问题,难以完成对抗原的有效提呈,影响其杀伤肿瘤的效果。中医学认为“肾藏精,精生髓”,树突状细胞起源于骨髓造干细胞,具有自我复制与多向分化的潜能,补肾中药六味地黄丸,临床主要用于肝肾阴虚等症,研究证实六味地黄丸主要通过增强机体免疫防御系统功能来达到治病强身之功效[11]。前期实验证实,补肾药物具有类似细胞因子的作用[12],可以提高树突状细胞的数量,本课题采用六味地黄丸诱导树突状细胞分化,增加其数量,以解决体内树突状细胞数量不足及免疫原性差的免疫治疗瓶颈。
1 材料与方法
1.1 实验细胞及动物
1.1.1 实验细胞 胃癌细胞系MGC-803,由军事医学科学院提供。
1.1.2 实验动物 SD大鼠[用于制备树突状细胞、四甲基偶氮唑盐(MTT)实验、平板克隆实验]购于中国军事医学科学院,合格证号:SCXK(军)-2017-008,雄性,四周龄,体重200~210g,清洁级(clean animals,CL),饲养于通风、清洁、温暖(20~25℃)环境中,特供饲料喂养。NOD/SCID小鼠(用于荷瘤实验)购于军事医学科学院,合格证号:SCXK(军)-2017-105,SPF级,3~4周龄,置于25~27℃恒温条件,层流超净架内特供饲料饲养。本实验通过动物伦理委员会审核同意批准。
1.2 主要实验药物及试剂
六味地黄丸(北京同仁堂科技发展股份有限公司,国药准字Z43020145),每8丸相当于饮片3 g;白介素-4(IL-4)、粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)(Peprotech 公司,美国);MTT(Sigma 公司,美国);胎牛血清(FBS)(Hyclone 公司,美国);RPMI-1640 培养基(Hyclone 公司,美国)。
1.3 实验分组
选取24只SD大鼠,随机分为四组,每组各6只,即空白对照组(A组)、树突状细胞组(B组)、六味地黄丸组(C组)、含药树突状细胞组(D组)。
1.4 方法
1.4.1 各组干预方法 A组:将大鼠盐水灌胃3 d后取得大鼠血清。B组:大鼠盐水灌胃3 d后,将体外扩增的、完毕的、成熟的树突状细胞回输至大鼠体内,回输细胞数量为1000个/(kg·d),共3 d。C组:按人与鼠体表面积折算鼠的给药剂量,公式为dB=dA×6.25,其中dA代表人每日每公斤体重用药剂量,dB代表鼠每日每公斤体重给药剂量;成人六味地黄丸临床用量为每次8丸,3次/d,相当于生药9g,因此计算出大鼠的给药量为0.94 g/(kg·d),为方便灌胃,按照1 g/(kg·d)给药,连续灌胃3 d后获得含药血清。D组:将大鼠同C组方法连续采用六味地黄丸灌胃3 d后,同B组方式将树突状细胞每日回输体内3 d,共6 d后取得大鼠含药血清。
1.4.2 胃癌抗原的制备 收集处于对数生长期的胃癌MGC-803细胞,首先弃去旧的培养基,用PBS 洗涤2~3次,加入0.25%的胰酶进行消化,适时去掉胰酶,加入少量的新鲜培养基。用吸管反复吹打细胞使其成为分散均匀的细胞悬液。调整细胞浓度为2×107/mL,-80℃冰箱放置10 min后取出细胞,迅速放入37℃的恒温水浴锅中,将其迅速融化,此过程反复重复3次后1300 r/min 离心10 min。收集上清液,经0.22 μm微孔滤膜过滤,放置4℃冰箱保存备用。
1.4.3 骨髓源性树突状细胞的制备 10%水合氯醛麻醉大鼠,无菌条件下取出双侧股骨,生理盐水反复冲洗骨髓腔,直至变成为白色。移入离心管中,加用红细胞裂解液裂解红细胞。收集沉淀后的骨髓细胞,使用培养基进行重悬,调骨髓细胞密度为1×109/L。加入6孔板,每个孔中加入完全培养基4 mL,再加入GM-CSF调至终浓度10 ng/mL,加入IL-4 至终浓度10 ng/mL,于37℃、5% CO2的培养箱中培养48 h后轻轻吹打细胞,连同培养基一同吸去悬浮细胞,仅保留贴壁细胞。加入新鲜的完全培养基及相同浓度的GM-CSF,继续培养至第5天。半量换液,加入完全培养基并补足相同浓度的GM-CSF,在吸取细胞的时候,沿着培养板的边缘,轻轻地吸取,尽量保留悬浮细胞。继续培养至第7 天后,用巴氏吸管轻轻吹打后收集所有悬浮细胞。即为富集的骨髓来源的树突状细胞以台盼蓝染色检查细胞活性,活细胞>95%方可用于实验。培养至第7 天的6孔板内细胞每3 孔分为一组,在其中一组中加入已经制备好的胃癌抗原,继续培养24 h 刺激细胞成熟[13-14]。
1.4.4 MTT法检测肿瘤细胞生长曲线 MTT法是一种检测细胞存活和生长的方法。将培养好的对数生长期的胃癌细胞接种于96孔板,细胞计数,将每组细胞加入长满胃癌细胞的96孔板中,每孔中接种1000个细胞。分别在每组细胞培养的1、2、3、4、5、6、7 d,使用MTT法检测其570 nm 的吸光光度(OD)值。以生长时间为横坐标、OD值作为纵坐标绘制细胞的生长曲线图。
1.4.5 平板克隆形成实验 平板克隆形成实验是检测细胞生长状况的方法之一,可作为检测单个细胞的增殖能力。适用于贴壁生长的细胞,包括肿瘤细胞和正常细胞。将各组细胞用PBS 清洗并离心后,吹打成单细胞悬液,细胞计数板计数,接种于六孔板,接种密度200个/孔。置于37℃、5% CO2孵箱中静止培养10~14 d,至出现肉眼可见的克隆。克隆形成率=克隆形成数/细胞接种数×100%。
1.4.6 体内成瘤抑制实验 收集生长对数期的MGC-803 胃癌细胞,接种于NOD/SCID小鼠,接种密度为5×106/0.2 mL/只,观察肿瘤发生时间及生长情况,每周用游标卡尺测量并记录肿瘤大小。选取24只长出肿瘤的小鼠,将小鼠分为四组,每组各6只,为区别前面实验,此实验分为a、b、c、d组。a组给予注射等量生理盐水;b组给予黄丸采取灌药负荷,灌胃方法为连续灌胃3 d,每天2次,按照1 g/(kg·d)给药;c组给予皮下注射树突状细胞,注射剂量为1×106/0.2 mL/只;d组采用六味地黄丸灌胃同树突状细胞皮下注射联合进行(剂量同上)。每周重复上述实验,观察肿瘤生长情况。4 周后,处死小鼠,取出小鼠体内肿瘤组织。
1.5 统计学方法
采用SPSS 19.0 统计学软件进行数据分析,符合正态分布的计量资料用均数±标准差(±s)表示,多组间比较采用方差分析,两组间比较采用t 检验;不符合正态分布者转换为正态分布后行统计学分析,以P<0.05为差异有统计学意义。
2 结果
2.1 MTT法检测肿瘤细胞生长曲线结果
连续监测1 周各组细胞经MTT 作用后的吸光光度值,检测各组对胃癌细胞的抑制能力。将其OD值作为纵坐标,取其生长时间作为横坐标,绘制生长曲线(图1,封三),结果显示,四组细胞在第3天进入对数生长期。其中A组细胞生长速度最快,而D组生长速度最慢。随着时间的延长,D组对胃癌细胞的抑制效果更明显,差异有统计学意义(P<0.05)。

图1 四组大鼠胃癌细胞生长曲线图
2.2 平板克隆形成实验
平板克隆实验结果见图2,结果显示,A组形成的克隆细胞排列密集且直径较D组大,B组及C组克隆细胞数量相当。计数结果见图3,结果显示,A组的细胞克隆形成率为(0.425±0.012)%,B组为(0.375±0.012)%,C组为(0.350±0.045)%,D组为(0.200±0.016)%;A组与D组比较,差异有统计学意义(P<0.05)。B组与C组比较,差异无统计学意义(P>0.05)。
2.3 体内成瘤抑制试验
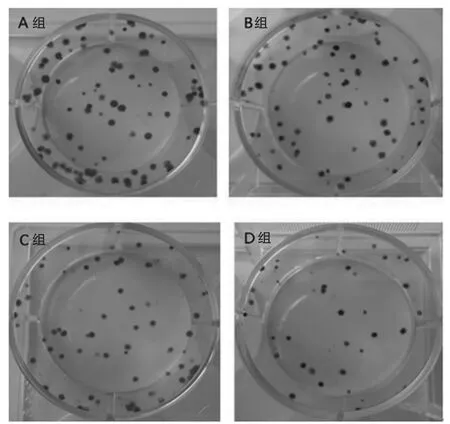
图2 平板克隆形成实验

图3 各组的克隆形成率
实验结果显示,MGC-803 细胞在接种20 d 左右开始出现可触及的皮下结节,瘤体初期生长缓慢,后期生长加快。质地坚硬且与周围组织分界不清。在荷瘤小鼠进行治疗前,游标卡尺测量各组(a、b、c、d组)小鼠的肿瘤大小分别为(0.032±0.015)、(0.031±0.020)、(0.035±0.021)、(0.034±0.019)cm3,各组比较,差异无统计学意义(P>0.05)。各组小鼠经分组干预后,a组小鼠肿瘤持续生长,出现厌食、体型消瘦等症状;b组干预1 周后肿瘤组织生长速度减慢,3 周后肿瘤再度出现快速增长;c组干预1.5 周后肿瘤生长速度减缓,减缓速度较b组慢,但未出现再度的快速增长;d组干预1 周后肿瘤生长速度减缓,减缓速度快于b、c组。处死小鼠后得到肿瘤组织,d组肿瘤体积小于a组,差异有统计学意义(P<0.05);b、c 两组抑瘤效果相当,差异无统计学意义(P>0.05)。选取每个实验组干预效果最好、最具有代表性的荷瘤小鼠及其解剖出的肿瘤组织进行拍照(图4)。

图4 小鼠体内抑瘤情况
3 讨论
树突状细胞起源于骨髓造干细胞,具有自我复制与多向分化的潜能,是体内最强的抗原提呈细胞,在免疫反应中发挥重要作用,是体液免疫和细胞免疫的关键调控者[15]。研究表明,肿瘤患者大多存在免疫抑制,如肿瘤免疫源性较低或肿瘤患者由于长期的放、化疗或肿瘤负荷较重导致的免疫功能受限、MHC分子表达过低、缺乏黏附分子和共刺激分子等,从而产生了抑制性因子[16]。补肾中药六味地黄丸,临床主要用于肝肾阴虚等症,主要通过增强机体免疫防御系统功能达到治病强身之功效。根据中医“肾藏精”“精血同源”理论[17],肿瘤患者免疫力低下与肾虚证密切相关,肾阴虚症者治疗应滋补肾阴,因此从肾论治是对疾病的本质治疗。现代医学研究证实,六味地黄丸中的山茱萸对非特异性免疫功能有增强作用,能促进巨噬细胞的吞噬功能[18];丹皮主要成分丹皮酚有显著抗变态反应的作用[19];茯苓中的茯苓糖对免疫功能有增强作用;能增强巨噬细胞的吞噬功能,其对细胞免疫和体液免疫均有促进作用[20]。
本实验中采用六味地黄丸促进树突状细胞分化与成熟,提高机体对胃癌细胞的杀伤能力,采用MTT法检测胃癌细胞生长曲线,结果显示,各组细胞在检测的第1 和第2 天细胞上属于潜伏生长期,看不出明显差异。随着时间的推移,细胞进入对数生长期后,空白组细胞一直位于曲线的最上方,而含药树突状细胞组曲线位于最下方,证实含药树突状细胞组对胃癌细胞的抑制效果最好。提示六味地黄丸对树突状细胞有显著的增殖作用,因而可进一步抑制胃癌细胞的增长。平板克隆形成实验作为体外检测肿瘤细胞增殖能力的常用办法,得出的结果亦是如此。在体内抑瘤实验中,更从体内实验层面证实了含药树突状细胞疫苗治疗优于单纯树突状细胞疗法。
传统中药具有多用途、多靶点的特点。其对肿瘤的抑制不仅体现在对某个免疫器官或是免疫细胞的单独作用上,更重要的是对整个免疫系统的调节。六味地黄丸是滋阴补肾的基础方剂,使用历史悠久,价格适宜,安全性高,且可多周期,反复应用,有易于药物在体内持续产生作用,甚至作用效果叠加,用此药辅以树突状细胞肿瘤疫苗,具有较高的临床应用价值。
