寒地冬小麦膨胀素基因TaEXPB12同源基因的克隆及功能分析
2021-01-08冯珊珊徐永清赵梓颐李凤兰胡宝忠
冯珊珊,徐永清,赵梓颐,李凤兰,胡宝忠
(东北农业大学 生命科学学院,黑龙江 哈尔滨 150038)
小麦(TriticumaestivumL.)作为重要的谷类作物,其产量对人类的生活具有重大影响。由于严峻的低温环境,冬小麦在东北地区的种植受到严重制约。东农冬麦2号是能在这种严寒条件下生存的冬小麦品种,发达的根系是其能够安全越冬的决定性因素之一,因此,研究其根系生长发育机制对扩大冬小麦在寒地的种植面积具有重要的意义。
膨胀素(Expansin)是一类具有非水解活性的扩展蛋白[1],在植物的整个生长发育过程中均具有重要作用。膨胀素在植物中包括EXPA、EXPB、EXLA和EXLB 4个亚家族[2]。EXPA和EXPB家族的许多基因都已被证实对植物根系的生长发育具有重要影响。Gahoonia等[3]研究发现HvEXPB1在大麦根中特异性表达,并且直接参与大麦根毛的根原基形成与根毛的伸长。He等[4]发现HvEXPB7基因对大麦根毛的生长具有促进作用。Guo等[5]发现在大豆中,GmEXPB2基因与根毛的伸长有关。Cho等[6]发现OsEXPB3基因和OsEXPB2基因对水稻根系的发育具有重要作用。Zou等[7]发现OsEXPB2基因的表达对水稻根毛的形成及发育具有重要的调控作用,而且当OsEXPB2基因沉默时,会影响侧根的生成。Han等[8]发现在氧化胁迫下,过表达TaEXPB23基因的转基因拟南芥表现出比野生型有更高的鲜质量和更长的初生根。Li等[9]也证明过表达TaEXPB23基因可促进根系生长并使根系鲜质量增加。Lü等[10]发现玫瑰膨胀素基因RhEXPA4的过表达会提高转基因拟南芥植株侧根的数量。Lee等[11]发现敲除拟南芥中的AtEXPA17基因后,植株侧根的形成会减少,而拟南芥过表达该基因会促进植株侧根的形成。拟南芥AtEXPA4、AtEXPA7、AtEXPA9、AtEXPA14、AtEXPA17、AtEXPA18和水稻OsEXPA1、OsEXPA2、OsEXPA3、OsEXPA4、OsEXPA8、OsEXPA17基因也都被证实与根系的生长密切相关[8,12-14]。除此之外,上述的膨胀素基因也都被证实参与植物抵御外界非生物胁迫的过程。
现在膨胀素对冬小麦根系生长发育的调控机制尚未明确。本研究以东农冬麦2号为材料,得到TaEXPB12-A/B/D3个同源基因。通过生物信息学分析了解其基本的生物学功能;通过qRT-PCR分析,研究了这3个基因在小麦不同部位及在低温、干旱和激素胁迫下的表达特性及表达差异,以期为进一步研究膨胀素在根系形态建成中的作用提供理论依据。
1 材料和方法
1.1 试验材料
试验材料为冬小麦东农冬麦2号,由东北农业大学植物学研究室提供。RNA提取试剂盒、反转录试剂盒、胶回收试剂盒、质粒提取试剂盒、RT-PCR试剂盒、DNA提取试剂盒均购自北京全式金生物公司;引物在长春库美生物公司合成;测序在哈尔滨擎科生物公司完成;试验所需大肠杆菌DH5α、农杆菌GV3101、ABA、茉莉酸甲酯、水杨酸、聚乙二醇、LB肉汤、LB 营养琼脂、氯仿、甘油等生化试剂均购自凯誉生物科技有限公司。
1.2 试验方法
1.2.1 基因序列克隆 根据本研究室的转录组测序结果,利用引物设计软件Primer Premire 5.0分析,设计克隆TaEXPB12-A/B/D基因的特异引物。以两叶一心期小麦幼苗根为材料,参照说明书使用TransZol Up PlusRNA Kit试剂盒,提取RNA。再以其为模板,获得cDNA,按照说明书使用TransScript®One-step gDNA Removal and cDNA Synthesis SuperMix试剂盒进行反转录试验。根据本研究室转录组测序结果,以cDNA为模板,TaEXPB12-A利用上游引物F:5′-TAGCCCCTTGGTTTTCTGTC-3′,下游引物R:5′-GTTTCCTAGTGATGTCTTCTTCTTG-3′;TaEXPB12-B利用上游引物F:5′-GCCCATTGGCTTTCT GTCT-3′,下游引物R:5′-CCCTAGCTGGCGTAGTT CA-3′;TaEXPB12-D利用上游引物F:5′-GCCCATTG CCTTTCTGTCT-3′,下游引物R:5′-CCCTAGCTGGC GTAGTTCA-3′进行PCR扩增,退火温度均为58.5 ℃。
1.2.2 序列生物信息学分析 同源性分析:DNAMAN软件;染色体定位分析:BioEdit软件;保守结构域分析:NCBI(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi);蛋白质信号肽预测分析:SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/);蛋白质的疏水性及亲水性预测:ExPASy-ProtScale(https://web.expasy.org/protscale/);蛋白三级结构预测:SWISS-MODEL(https://swissmodel.expasy.org/interactive)。
1.2.3TaEXPB12-A/B/D基因启动子元件分析 利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线网站对TaEXPB12-A/B/D3个基因序列的启动子进行功能元件预测分析。
1.2.4 qRT-PCR分析 挑选颗粒饱满的种子,用75%酒精消毒12 min,无菌水冲洗4~5遍,黑暗条件下浸种12 h,25 ℃培养箱黑暗催芽(保持种子湿润即可)12 h。然后将种子平铺于含有双层滤纸的培养皿中,培养室培养至植株长到两叶一心期时,随机选取3株长势一致的幼苗,以水培为对照组,在4 ℃、20%PEG、30%PEG、2 μmol/L脱落酸(ABA)、10 μmol/L茉莉酸甲酯(MeJA)以及10 μmol/L水杨酸(SA)分别处理2,6,12,24,48 h,分别取单株的根部,随即液氮速冻,然后置于-80 ℃超低温冰箱保存备用。以上述处理的冬小麦根cDNA为模板,采用TransStart® Top Green qPCR SuperMix试剂盒(AQ131,北京全式金生物技术有限公司)进行Real-time PCR扩增,扩增体系为20 μL。以分蘖期冬小麦的根、茎、叶、分蘖节的cDNA为模板,用同一试剂盒进行组织表达模式分析。设计的引物具体如下:
荧光引物:上游(TaEXPB12-A-F):5′-GCTCTAG AATGGCTAGTCCAGGC-3′,下游(TaEXPB12-A-R):5′-CGGGATCCCTAACTGGCGTA-3′;上游(TaEXPB12-B-F):5′-GCTCTAGAATGGCTAGTCCAGGC-3′,下游(TaEXPB12-B-R):5′-CGGGATCCCTAGCTGGCGTA-3′;上游(TaEXPB12-D-R):5′-GCTCTAGAATGGCTAG TCCTGGC-3′,下游(TaEXPB12-D-R):5′-CGGGATC CCTAGCTGGCGTA-3′。
内参引物:上游(β-actin-F):5′-TCCAATCTAT GAGGGATACACGC-3′,下游(β-actin-R):5′-TCTT CATTAGATTATCCGTGAGGTC-3′。
1.2.5 TaEXPB12-A、TaEXPB12-B、TaEXPB12-D蛋白亚细胞定位 表达载体YFP上含有PmIⅠ酶切位点,而TaEXPB12-A/B/D基因序列上不含PmIⅠ酶切位点,因此,在目的基因TaEXPB12-A/B/D的起始密码子前和终止密码子后加入PmIⅠ酶切位点序列,并且加上保护碱基TTT,利用Primer Premire 5.0软件设计酶切引物(表1)。以已得到的TaEXPB12-A/B/D序列为模板,进行PCR扩增,退火温度都为58 ℃。用PmIⅠ酶对PCR产物和载体YFP进行单酶切,使用20 μL单酶切体系,37 ℃水浴锅中2 h,添加1 μL小牛肠碱性磷酸酶(CIP),再继续37 ℃水浴1 h,电泳检测,并对切开的质粒进行胶回收。利用T4连接酶,将上述胶回收的TaEXPB12-A/B/D目的片段和YFP载体片段进行连接,使用20 μL连接体系,轻弹混匀,14.5 ℃恒温箱中过夜。将连接产物转化到大肠杆菌中,菌液PCR鉴定和测序后,将重组质粒转入农杆菌GV3101中,然后瞬时侵染洋葱表皮。为了区分融合蛋白在细胞膜和细胞壁的定位,将洋葱表皮细胞用30%蔗糖溶液预处理20 min,使其质壁分离,随后正常观察。

表1 酶切位点添加的引物序列
2 结果与分析
2.1 基因序列克隆与同源性分析
目的基因扩增获得846 bp左右的目的条带,与预期片段大小相似(图1)。胶回收,连接T3载体,转化大肠杆菌,并进行菌液PCR鉴定(图2)。测序结果与本研究室的转录组测序结果进行对比,成功得到TaEXPB12-A/B/D基因。基因序列提交NCBI注册,GenBank登录号分别为MT232926、MT232927、MT232928。
M.2K Marker;1-3.菌落PCR产物。
M.2K Marker;1-3.菌液PCR产物。
2.2 序列生物信息学分析
通过DNAMAN软件进行同源性分析,3条序列的同源性高达98.46%(图3)。通过BioEdit软件对测序获得的3条序列进行染色体定位分析,结果显示序列1、序列2、序列3分别定位在2AL、2BL、2DL染色体上,编码281个氨基酸,其长度均为846 bp,依次命名为:TaEXPB12-A、TaEXPB12-B、TaEXPB12-D。除此之外,通过对比发现TaEXPB12基因序列与大麦中的HvEXPB1基因相似性达95%。
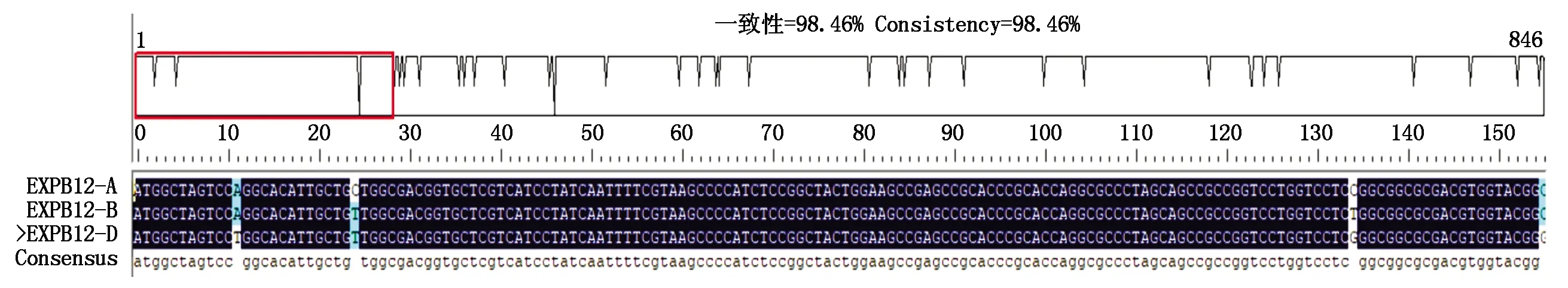
图3 TaEXPB12-A/B/D的氨基酸同源比对
TaEXPB12-A/B/D蛋白质信号肽预测分析显示,该蛋白质的切割点位于氨基酸25-26位,TaEXPB12-A/B/D基因信号肽序列完全相同。除此之外,生物信息学分析结果显示,TaEXPB12-A/B/D蛋白均具备膨胀素基因序列特有的结构域DPBB_1,分别位于142-810 bp,142-834 bp,142-834 bp。TaEXPB12-A蛋白的相对分子质量为29.498 31 ku、等电点为9.17、分子式为C1292H1979N369O388S19;TaEXPB12-B蛋白的相对分子质量为29.494 34 ku、等电点为9.16、分子式为C1296H1987N367O388S18;TaEXPB12-D蛋白的相对分子质量为29.496 37 ku、等电点为9.16、分子式为 C1295H1985N367O387S19,3种蛋白质均为亲水性蛋白。但是蛋白三级结构预测分析显示,3种蛋白具有3处明显差异(图4),因此,预测这3种蛋白可能功能略有差异。
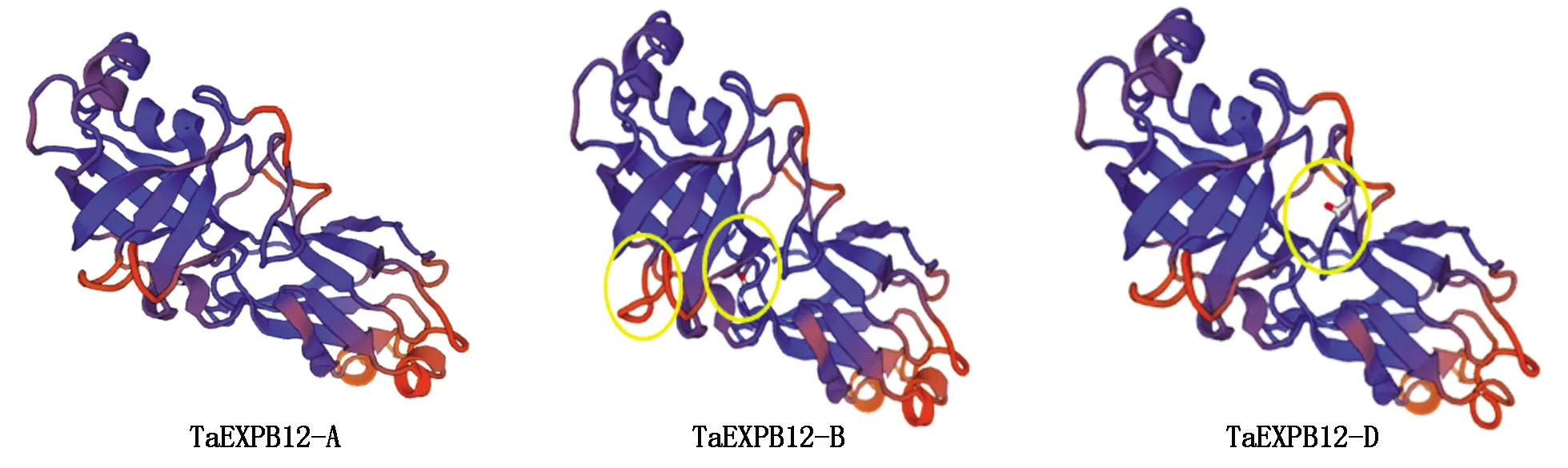
图4 TaEXPB12-A/B/D编码的蛋白质三级结构的预测
2.3 启动子反应元件预测分析
对TaEXPB12-A/B/D基因序列的启动子进行预测分析,结果显示,均含有与CBF冷反应通路相关的CRT/DRE元件、光响应元件(Light responsive element)、脱落酸响应元件(Abscisic acid responsiveness)、茉莉酸甲酯响应元件(MeJA responsiveness)、干旱诱导响应元件(Drought inducibility)、水杨酸响应元件(Salicylic acid responsiveness)、生长素响应元件(Auxin-responsive element)、赤霉素响应元件(Gibberellin-responsive element)、厌氧诱导响应元件(Anaerobic induction)、低温响应元件(Low-temperature responsiveness)以及根特异表达相关元件ROOTMOTIFTAPOX1、OSE1ROOTNODULE、OSE2ROO-TNODULE和RHE等。
2.4 TaEXPB12-A/B/D基因的表达特性分析
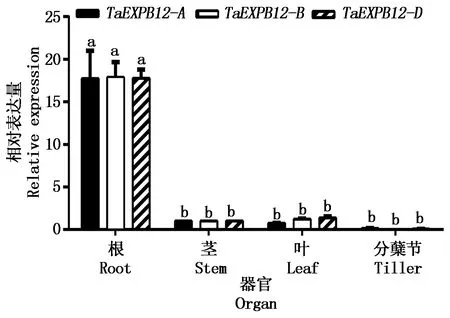
如图5所示,qRT-PCR分析结果显示,TaEXPB12-A/B/D基因均在根中特异性表达。如图6所示,在不同胁迫处理下,TaEXPB12-A/B/D基因表达趋势不同。在4 ℃低温处理的条件下,TaEXPB12-A/B/D的表达量都呈下调趋势,其中6~48 h显著下调(P<0.05),且TaEXPB12-A表达量下降幅度更大。在不同程度的干旱处理后,TaEXPB12-A/B/D的表达量都呈先上升后下降的趋势,但TaEXPB12-A/B/D对30%PEG更敏感,响应更快。在20%PEG的处理条件下,TaEXPB12-A/B/D的表达量在12 h达到峰值,TaEXPB12-A/B/D的表达量均达到0 h表达量的1.65倍以上,差异显著(P<0.05);在30%PEG的处理条件下,TaEXPB12-A/B/D的表达量在6 h表达量最高,约为0 h表达量的3倍,差异显著(P<0.05)。在脱落酸和水杨酸的处理条件下,TaEXPB12-A/B/D的表达量也都呈先上升后下降的趋势,其中TaEXPB12-A/B/D在脱落酸处理条件下3 h时达到峰值,为0 h的2.5倍以上,差异显著(P<0.05),且TaEXPB12-A的表达占据主导地位,其表达量达到了0 h的3.5倍以上,高于TaEXPB12-B和TaEXPB12-D,而水杨酸处理条件下在6 h表达量最高,约为0 h的13.5倍,差异亦显著(P<0.05),说明其对脱落酸的响应更快(峰值提前)而对水杨酸的响应水平更高(增幅更大)。在茉莉酸甲酯的处理下,TaEXPB12-A/B/D的表达量都呈现先下降后上升的趋势,0~6 h略有下降但差异不显著,而在6 h后,TaEXPB12-A/B/D的表达量开始上升并在48 h表达量均达到0 h的5.7倍以上,差异显著(P<0.05)。从根中的基因表达量整体来看,在TaEXPB12-A、TaEXPB12-B和TaEXPB12-D中TaEXPB12-A基因的表达量相对较高。
不同字母表示差异显著(P<0.05)。图6同。

图6 不同胁迫处理下TaEXPB12-A/B/D基因的表达差异
2.5 5TaEXPB12-A、TaEXPB12-B、TaEXPB12-D蛋白亚细胞定位
将含有YFP质粒和重组质粒的农杆菌进行活化,瞬时侵染洋葱表皮,然后在荧光显微镜下观察洋葱表皮。如图7所示,在转化有35S∶∶YFP阳性对照载体的洋葱细胞中,荧光信号在整个细胞中都有分布。与阳性对照相比,无论质壁分离前后,TaEXPB12-A∶∶YFP、TaEXPB12-B∶∶YFP、TaEXPB12-D∶∶YFP融合蛋白荧光信号都定位在细胞壁。结果说明,TaEXPB12-A/B/D主要分布在细胞壁中,TaEXPB12-A/B/D编码的蛋白均为细胞壁蛋白。
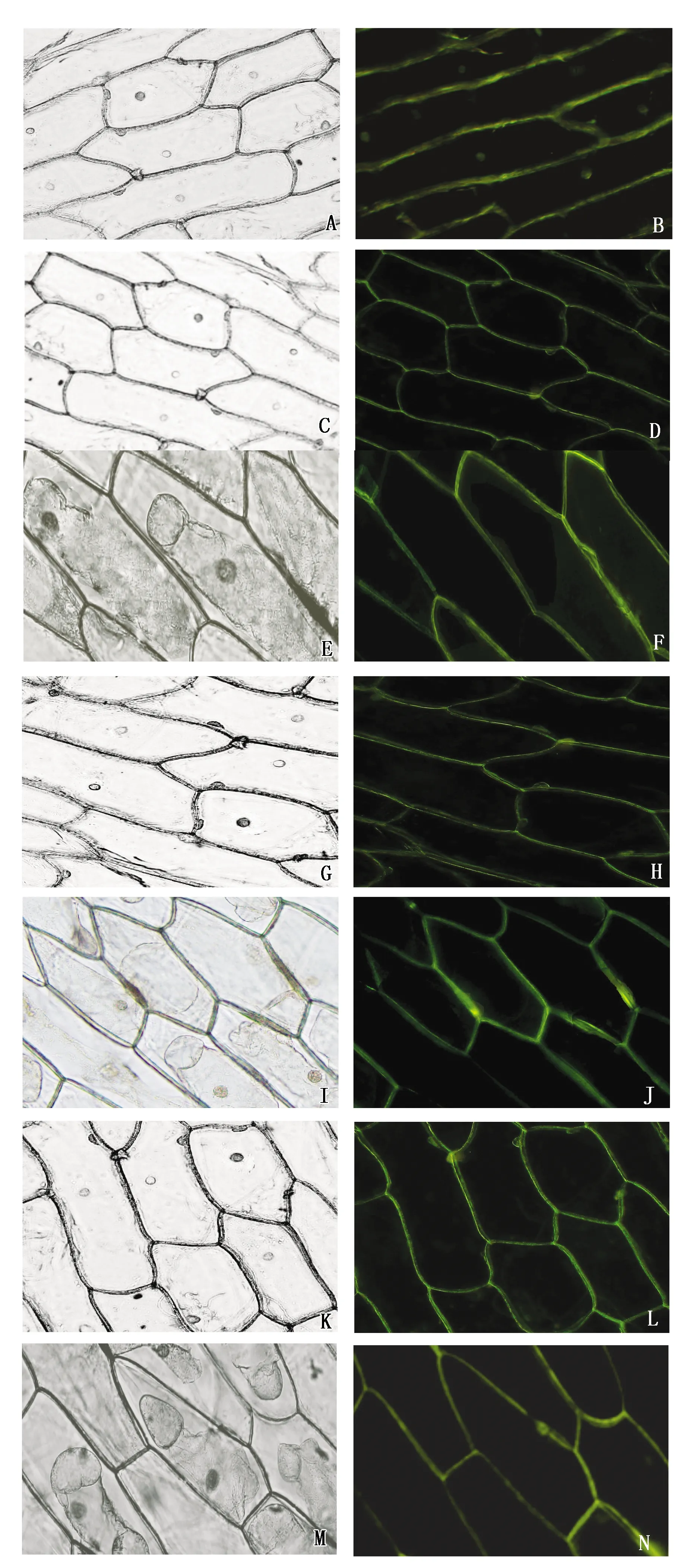
A、B.35S∶∶YFP;C、D.35S∶∶TaEXPB12-A-YFP正常;E、F.35S∶∶TaEXPB12-A-YFP质壁分离;G、H.35S∶∶TaEXPB12-B-YFP正常;I、J.35S∶∶TaEXPB12-B-YFP质壁分离;K、L.35S∶∶TaEXPB12-D-YFP正常;M、N.35S∶∶TaEXPB12-D-YFP质壁分离。
3 讨论与结论
多倍体化是维管植物的重要进化过程[15]。多倍体化使水稻、小麦等农作物产生了更具有竞争力的新表型,从而在优胜劣汰的自然界留存下来。多倍体化是多倍体物种形成和进化的基础[16]。因此,研究小麦膨胀素同源基因的表达差异对了解小麦的异源多倍体进化具有重要意义。本研究发现在冬小麦的基因组中,位于不同染色体上的膨胀素同源基因的序列、立体构象存在差异。Hu等[17]研究发现TaEXPA1-A和TaEXPA1-D基因在幼叶中表达,而TaEXPA1-B在幼叶中沉默。Peng等[18]发现TaEXPA8-A和TaEXPA8-B主要在根中表达,而TaEXPA8-D主要在花中表达。董佳敏等[19]发现在不同的非生物胁迫下,TaEXPA7-A/B/D基因均下调表达,但B染色体组上的TaEXPA7-B基因占主要的表达优势。赵巧芩[20]发现TaEXPA4-A/B/D在抵御不同非生物胁迫的过程中,表达量存在显著差异。在本研究中,TaEXPB12-A、TaEXPB12-B和TaEXPB12-D的同源性很高,在不同非生物胁迫的处理下,3个同源基因的表达趋势也一致,但A染色体组上的TaEXPB12-A基因表达量较高。
本研究发现TaEXPB12-A/B/D基因在根中特异性表达,而且通过对比,发现其基因序列与大麦中的HvEXPB1基因相似性达95%。参考小麦与大麦的进化关系和基因之间的相似程度,推测该基因在功能上基本与HvEXPB1一致。已有研究证实HvEXPB1在大麦根中特异性表达,并且直接参与大麦根毛的根原基形成与根毛的伸长。因此,推测TaEXPB12-A/B/D基因可能参与小麦根毛的根原基形成与根毛的伸长。qRT-PCR分析结果显示,在低温条件下,TaEXPB12-A/B/D基因的表达呈下调趋势,这可能是为了减少根的表面积,从而减少寒胁迫所造成的伤害。在干旱条件下,TaEXPB12-A/B/D基因的表达量会先上升,这可能是植物受到旱胁迫早期为了增强吸水能力而促进根毛生长的缘故。TaEXPB12-A/B/D基因编码的蛋白是细胞壁蛋白,它们可能通过修饰细胞壁来帮助植物抵御外界的非生物胁迫。在启动子分析中,发现了与CBF冷反应通路相关的CRT/DRE元件,这说明TaEXPB12-A/B/D可能在CBF冷反应通路中承担着一定的角色。但TaEXPB12-A/B/D基因在小麦根系生长发育中的具体作用还需要进一步的研究。
分别定位于2AL、2B、2DL染色体上的TaEXPB12-A/B/D同源基因,其CDS序列长度均为846 bp,编码281个氨基酸。TaEXPB12-A/B/D基因高度同源,编码蛋白质理化性质相似,其编码蛋白的三级结构有3处明显差异,这可能使它们的功能有所不同。这3段序列的启动子区域中均含有与根特异表达相关的作用元件,以及大量激素响应元件和非生物胁迫响应元件。TaEXPB12-A/B/D蛋白在冬小麦根的细胞壁中特异性分布,并参与冬小麦抵御干旱、低温、ABA、SA和MeJA的过程。
