三疣梭子蟹JHEH基因的克隆及表达分析
2021-01-08郑宏坤徐东杰朱冬发
郑 亮,谢 熙,郑宏坤,徐东杰,朱冬发
(宁波大学 海洋学院,浙江 宁波 315823)
保幼激素(Juvenile hormone,JH)是无脊椎动物生长发育过程中的一种重要激素,参与调控生长、性腺发育、变态等重要的生理过程[1]。血淋巴JH浓度变化受到其合成通路及降解途径的调控[2]。保幼激素环氧化水解酶(Juvenile hormone epoxide hydrolase,JHEH)和保幼激素酯酶(JH esterases,JHE)是JH降解过程中的重要酶,它们分别水解JH的环氧结构和甲酯结构,最终生成无活性的保幼激素酸二醇(JH acid diol)[3]。
早期昆虫JH降解活性的研究主要以JHE为主[4]。但不同研究也发现,JHEH在JH的降解代谢中同样扮演了重要的角色[5-6]。与JHE相比,JHEH的重要作用表现在两方面:① JHEH是一种非分泌酶,能在各发育阶段的各个组织中降解保幼激素以调节其适宜浓度;② JHEH降解保幼激素生成的保幼激素二醇(JH diol)是一种不可逆的代谢产物,而通过JHE的降解产物保幼激素酸可以被重新利用合成保幼激素[7]。JHEH作用的重要性往往存在物种和时期特异性。例如在黑果蝇(Drosophilavirilis)中,JHE一直是其生命周期中主要的JH降解酶;而在同属的黑腹果蝇(Drosophilamelanogaster)中,其蛹期发育至成体这一过程中的JH降解则需要JHE和JHEH的共同参与,JHEH更是在成体期起着主要的JH降解作用[8]。JHEH基因目前已在家蚕(Bombyxmori)[9]、马铃薯甲虫(Leptinotarsadecemlineata)[10]、意蜂(Apismellifera)[11]等多种昆虫中被克隆得到。JHEH的氨基酸序列均包含一个由天冬氨酸、组氨酸和谷氨酸(或者天冬氨酸)构成的保守催化三联体结构,该结构是环氧化合物水解酶的核心结构域,能够协助酶分子与底物的结合[12]。
近年来,JHEH的同源序列陆续在一些甲壳动物物种中被发掘[13-14]。这些JHEH序列与昆虫JHEH具有较高的一致性,都含有保守的催化三联体结构,表明了其具有催化环氧化物的潜在能力。但有意思的是,甲壳动物体内并没有任何形式的JH,而是利用一种不含环氧结构的甲基法尼酯(Methyl farnesoate,MF)执行类似于JH的功能[15]。JHEH是否参与甲壳动物MF的降解代谢目前还缺乏定论。李真真[13]在日本沼虾(Macrobrachiumnipponens)中扩增得到了JHEH基因的全长cDNA序列,并且组织表达显示其在肝胰腺中表达水平最高。由于肝胰腺是MF降解代谢的主要组织,JHEH基因在肝胰腺的高表达被认为可能和MF降解有关。赵明等[14]在拟穴青蟹(Scyllaparamamosain)中也报道了类似的结果,并发现JHEH基因在卵巢的未发育期到近成熟期表达较低,但在成熟期的肝胰腺和排卵后期的卵巢中则显著升高,因此,认为JHEH可能参与卵巢发育的调控。
为了进一步明确JHEH在甲壳动物中的作用,本研究对三疣梭子蟹(Portunustrituberculatus)的JHEH基因全长cDNA进行了分子克隆,并分析了其在不同组织及卵巢发育和蜕皮过程中的表达水平变化。三疣梭子蟹是我国东南沿海一种重要的经济蟹类。宁波大学甲壳动物发育生物学课题组在之前的研究中已经探明了蜕皮及卵巢发育过程中血淋巴MF的浓度变化[16-18]。通过比较分析JHEH基因表达与MF浓度水平的关系,本研究探讨了JHEH在MF代谢通路中的可能作用,不仅为阐明JHEH的功能奠定了理论基础,也将有助于完善甲壳动物蜕皮及卵巢发育的内分泌调控机制。
1 材料和方法
1.1 试验材料
选取健康的野生三疣梭子蟹,暂养在宁波市海洋与渔业研究院苗场实验基地,每日投喂鲜活的蛏子。参照沈洁等[19]的方法,根据形态学的特征变化,将三疣梭子蟹蜕皮周期划分为蜕皮后期(A、B期)、蜕皮间期(C期)、蜕皮前期(D0、D1、D2、D3和D4亚期)和蜕皮期(E期)共4个阶段,采集蜕皮间期(甲宽13.3~16.7 cm,体质量180~240 g)的雌雄三疣梭子蟹的肝胰腺、卵巢、精巢、Y器、鳃、肌肉、肠、胸神经节、眼柄、脑、大颚器、表皮、心脏用于PtJHEH组织差异表达分析。再采集各蜕皮期三疣梭子蟹(E期除外)(甲宽8~12 cm、体质量42~83 g),取肝胰腺和Y器,用于分析PtJHEH在蜕皮周期中表达水平变化,每个蜕皮期分别取5只螃蟹作为生物学重复,采集的组织暂时转移到RNA保护液(康为世纪)中,在-20 ℃中保存。根据性腺指数(GSI)和卵巢外部特征将三疣梭子蟹第2次卵巢发育划分为4个阶段,分别为Ⅰ、Ⅱ、Ⅲ和Ⅳ期[20],采集各个卵巢发育阶段的三疣梭子蟹(甲宽14.2~17.3 cm;体质量170~350 g)的肝胰腺和Y器组织,用于第2次卵巢发育过程中PtJHEH表达水平的变化,采集的组织暂时转移到RNA保护液中,在-20 ℃中保存。
1.2 试验方法
1.2.1 总RNA的提取及反转录 将上述保存在RNA保护液中的样品组织移到300 μL的TRIzol溶液(上海生工)中,按照TRIzol试剂盒说明书进行总RNA提取。总RNA经DNase Ⅰ(康为)去除基因组DNA后,用1%的琼脂糖凝胶电泳检测其完整性,并用超微量分光光度计Nanodrop 2000C(ThermoFisher)进行纯度分析。用PrimerScript RT reagant Kit 试剂盒(康为)将总RNA进行反转录得到第一链cDNA,保存于-20 ℃。
1.2.2 全长cDNA克隆 根据转录组数据库中JHEH的同源序列,设计特异性引物(表1),总体系为25 μL,扩增条件:94 ℃ 5 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,33个循环;72 ℃再延伸10 min,反应结束。PCR产物进行凝胶电泳后,根据DNA回收试剂盒(生工)说明书进行回收和纯化。纯化的DNA与pMD-18T载体(TaKaRa)连接后转入大肠杆菌DH5α感受态细胞(TaKaRa)中进行扩大培养。利用菌落PCR挑选阳性克隆,送至上海生工生物工程有限公司进行测序。根据测序结果,比对转录组序列,确定序列正确后,设计特异性引物(表1),利用RACE技术对3′和5′端的序列进行扩增。分别取1 μg肝胰腺总RNA,按照SMARTerTMRACE cDNA Amplification Kit试剂盒(Clontech)说明书对3′RACE-cDNA和5′RACE-cDNA进行合成。分别以上述cDNA为模板进行巢式PCR扩增,总体系为25 μL,扩增条件:94 ℃ 5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,33个循环;72 ℃再延伸10 min,反应结束,PCR产物经琼脂糖电泳确定后,按照上述步骤对其进行回收、纯化、连接、转化和测序。
1.2.3 生物信息学分析 测序结果利用Vector NTI 10.0对序列进行拼接,获得三疣梭子蟹JHEH(PtJHEH)的全长cDNA序列,利用NCBI ORF Finder 在线工具确定PtJHEH的开放阅读框ORF序列,并翻译成氨基酸序列。利用ProParam tool分析预测氨基酸基本理化性质;使用Signal 5.0 Server(http://www.cbs.dtu.dk/service/SignalP/)分析蛋白质信号肽;利用在线TMHMM工具预测氨基酸跨膜区域,使用SMART程序分析氨基酸结构。采用在线工具Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)对蛋白质三级结构预测;利用Expasy(http://www.expasy.org/tools/protscale.html)对蛋白质的疏水性/亲水性进行预测;利用NCBI BlastP在线搜索不同物种的同源序列,使用ClustalX软件进行多重序列比对;挑选具有代表性的物种的JHEH氨基酸序列,使用MEGA 5.0 软件的邻近法(Neighbor-Joining)构建系统进化树。
1.2.4 实时荧光定量(RT-qPCR) 根据已经获得PtJHEH基因的cDNA全长序列设计一对特异性引物PtJHEH-q-F和PtJHEH-q-R(表1),以β-actin-F和β-actin-R(表1)作为内参引物利用qPCR对PtJHEH基因进行表达水平分析。扩增条件为:95 ℃ 2 min;95 ℃ 5 s,58 ℃ 20 s,68 ℃ 20 s,共40个循环;95 ℃ 15 s,55 ℃ 15 s,升温25 min,95 ℃ 15 s。各样品中目的基因的相对表达量用2-ΔΔCt法进行计算,以其中一个样品中的表达水平为参照,其他样品中的表达水平则以其倍数表示。

表1 PtJHEH扩增及表达所用引物
1.2.5 数据分析 结果用“均值±标准差”表示,利用Statistical Product and Service Solutions(SPSS)20.0软件对数据的统计学显著性进行分析。结果首先用Kolmogorov-Smirnov and Cochran对其方差齐性进行检验,若方差不齐,则用Mann-Whitney非参数检验法分析;若方差整齐,则用Duncan或t检验法分析。分析结果P<0.05表示显著性差异,用不同字母表示。
2 结果与分析
2.1 三疣梭子蟹JHEH基因的克隆及蛋白的结构分析
使用引物PtJHEH-F和PtJHEH-R得到的产物,经过测序显示该片段长度为1 374 bp(图1-A),用引物PtJHEH-3′F1和PtJHEH-3′F2进行3′-RACE得到的产物,经过测序显示该片段长度为108 bp(图1-B)。用PtJHEH-5′R1和Outer primer引物先进行第1轮PCR扩增,再以该PCR产物为模板,用PtJHEH-5′R2和Inner primer 引物进行第2轮PCR扩增,得到5′-RACE的产物,测序结果显示该片段为321 bp(图1-C)。将测序得到的序列进行拼接,结果得到长度为1 803 bp(图2),该序列GenBank登录号为KU216465,该基因的5′非编码区为321 bp,3′非编码区为108 bp,开放阅读框(ORF)为1 374 bp,编码467个氨基酸。

从左到右的DNA Marker分别是DL2000、DL500和DL1000。

ORF用大写表示;信号肽用下划线标出;保守特征位点用灰色背景标出;起始密码用方框框出;星号表示终止密码。
生物信息学分析显示,PtJHEH分子式为C2367H3624N614O634S13,分子质量为51.24 ku,等电点(pI)为8.58,不稳定系数为35.63,含有负电荷氨基酸残基42个,正电荷氨基酸残基45个。利用SignalP对编码区进行分析,发现三疣梭子蟹JHEH有25个氨基酸残基的信号肽(图3-A),表明三疣梭子蟹JHEH属于分泌蛋白。使用TMHMM工具分析发现该氨基酸序列具有跨膜结构(图3-B),跨膜结构域位于第20-37个氨基酸的位置。预测PtJHEH的三级结构(图3-C)发现,PtJHEH中包括α-螺旋、β-转角、延伸链和无规则卷曲。对PtJHEH氨基酸序列的亲水性/疏水性进行预测(图3-D)发现,PtJHEH氨基酸序列中的亲水性氨基酸占比要高于疏水性氨基酸,故PtJHEH为亲水性蛋白。
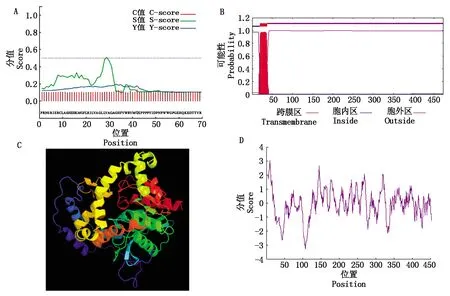
A.蛋白质信号肽预测;B.蛋白质跨膜区预测;C.蛋白质三级结构预测;D.蛋白质亲水性/疏水性预测。
2.2 三疣梭子蟹JHEH氨基酸多序列比对及系统进化树分析
选取拟穴青蟹(SpJHEH)、罗氏沼虾(MrJHEH)和凡纳滨对虾(LvJHEH),还有具有代表性的昆虫中的家蚕(BmJHEH)和黑腹果蝇(DmJHEH)的氨基酸序列与三疣梭子蟹JHEH氨基酸序列进行多重序列比对分析(图4),结果显示,氨基酸序列共同包括N-末端的膜锚定位点“XWG”、催化三联体结构(Asp225、Glu404和His431)、酪氨酸残基(Tyr297和Tyr375)和“HGWP”花样结构,PtJHEH与其他物种的JHEH都具有典型的环氧化酶催化结构域。

划线部分表示信号肽;方框里的是保守特征位点;三角形代表N-末端的膜锚定位点“XWG”。
利用MEGA 5.0软件,将PtJHEH的氨基酸序列与其他物种的JHEH氨基酸序列通过邻近法构建系统进化树(图5),结果显示,三疣梭子蟹JHEH与甲壳动物的拟穴青蟹JHEH最为接近,其同源性为90.83%,其次是与罗氏沼虾的同源性为67.46%,与凡纳滨对虾的同源性为61.39%。三疣梭子蟹JHEH与其他甲壳类动物的JHEH聚为一支,与其传统的分类地位相吻合,说明PtJHEH氨基酸序列在进化上保守性强。

图5 三疣梭子蟹JHEH氨基酸序列系统进化树
2.3 PtJHEH在三疣梭子蟹不同组织中的表达差异
实时荧光定量结果显示,PtJHEH在雌雄各组织中均有不同程度的表达(图6),其中表达量最高的组织是肝胰腺,与其他组织有显著性的差异,其次是Y器。
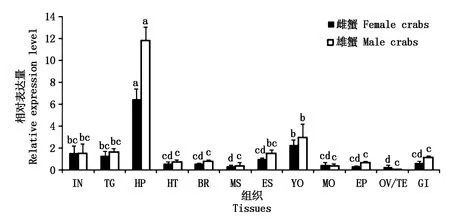
IN.肠;TG.胸神经节;HP.肝胰腺;HT.心脏;BR.脑;MS.肌肉;ES.眼柄;YO.Y器;MO.大颚器;EP.皮;OV.卵巢;TE.精巢;GI.鳃。不同字母表示雌雄组内的不同组织之间的表达水平差异显著(P<0.05)。
2.4 PtJHEH在蜕皮周期中的表达水平变化
鉴于PtJHEH在雌雄蟹肝胰腺和Y器中表达量均是最高,选取三疣梭子蟹肝胰腺和Y器作为试验材料研究PtJHEH在蜕皮周期中的表达变化。结果显示(图7):肝胰腺中PtJHEH在各个时期均有表达,从蜕皮后期(A和B)至蜕皮前期D0亚期,呈现出逐渐下降的趋势,在D0期降到最低,之后从D0期开始逐渐上升,至D2期升至最大,之后迅速回落,保持较低的表达水平;Y器中PtJHEH从蜕皮间期(C)至蜕皮前期D4亚期的相对表达量一直较低,而蜕皮后期中的A期至B期呈现上升趋势,在B期升至最大,并与其他时期相比具有显著性差异。

不同字母表示蜕皮周期各期表达水平有显著性差异(P<0.05)。
2.5 PtJHEH在第2次卵巢发育阶段中的表达水平变化
实时荧光定量结果显示(图8),在三疣梭子蟹第2次卵巢发育过程中,肝胰腺中PtJHEH的表达水平变化在Ⅰ期和Ⅱ期表达量较低,在Ⅱ期有略微下降,至Ⅲ期表达量显著增大(P<0.05),之后Ⅳ期略有下降。Y器中PtJHEH的表达水平变化在Ⅰ期至Ⅲ期呈现出上升趋势,Ⅲ期升至最大,之后Ⅳ期迅速回落。
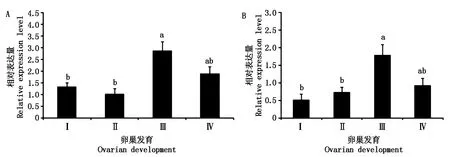
不同字母表示卵巢发育不同发育期之间表达水平有显著性差异(P<0.05)。
3 结论与讨论
本研究克隆得到了PtJHEH的全长cDNA序列,该序列全长1 803 bp,包括1 374 bp的开放阅读框、321 bp的5′端非编码区和108 bp的3′端非编码区,编码467个氨基酸。通过对三疣梭子蟹JHEH氨基酸序列与近源物种同源性的结果分析发现,该序列具有JHEH所有的结构域特征,包括催化三联体(Asp225、Glu404和His431)、构成阴离子的残基(Tyr297和Tyr375)和“HGWP”花样结构。这表明PtJHEH是一个典型的环氧化合物水解酶,具有催化活性。另外,在N末端有高度保守的“XWG”固定位点,在家蚕中被认为是亚细胞定位的膜锚着点。但是在真菌、细菌和原生动物中不存在[21]。进化树分析发现,三疣梭子蟹JHEH与其他甲壳动物的JHEH亲缘关系较近,符合其传统的分类地位。
组织表达结果显示,PtJHEH在肝胰腺中的表达水平最高,与日本沼虾[13]和拟穴青蟹[14]的结果一致。肝胰腺是MF代谢的主要组织,MF酯酶的酶活及基因表达都在肝胰腺中最高[22-23]。然而,JHEH的高表达是否与MF有关还需要进一步证实。事实上,在意蜂(Apismellifera)中,JHEH并无JH降解活性,但是却在脂肪代谢中发挥作用[11]。肝胰腺是甲壳动物物质代谢的主要场所[24],JHEH在肝胰腺中的高表达也可能与其参与其他物质的代谢过程有关。除肝胰腺外,PtJHEH在Y器中也有较高表达。Y器是甲壳动物产生蜕皮激素的主要位点,而蜕皮激素的合成又可能受到MF的调控[25]。由于JHEH是一种非分泌酶,如果JHEH存在对MF的调控作用,其可能在Y器中表达控制细胞中MF的含量,以确保合适的蜕皮激素合成速率。
为了进一步明确JHEH与MF的关系,检测了蜕皮周期及卵巢发育过程肝胰腺和Y器里PtJHEH的表达水平变化。在蜕皮周期中,肝胰腺中PtJHEH的表达变化与之前报道的血淋巴MF浓度及其合成酶基因表达的变化在蜕皮前期存在一定相关性,后两者均在蜕皮前期D1亚期[26],略早于PtJHEH表达的高峰。这说明PtJHEH可能响应MF进行表达,以调控机体正常的MF浓度。但在蜕皮后期(A和B),血淋巴MF浓度及其合成酶基因的表达都处于较低水平,而PtJHEH却保持了稳定的表达,说明PtJHEH可能有MF之外的作用对象。而在Y器中,PtJHEH在A和B期显著高表达,也与此时较低的血淋巴MF浓度[25]和蜕皮激素浓度保持一致[27]。
在卵巢发育过程中,肝胰腺和Y器里PtJHEH的表达水平变化较为一致,均是在前卵黄合成期(Ⅰ期)和卵黄合成早期(Ⅱ期)较低,而在卵黄合成晚期(Ⅲ期)和成熟期(Ⅳ期)显著上升。该变化趋势与拟穴青蟹报道的JHEH在卵巢发育过程中的表达变化相似[14],也和已报道的卵巢发育过程中血淋巴MF浓度[25]和蜕皮激素的浓度[28]保持了一致。这个结果也再一次表明了JHEH可能参与MF浓度的调控。值得注意的是,MF并没有环氧结构,JHEH对MF无法产生直接的催化降解作用,因此,可能还存在其他的调控机制实现JHEH与MF的联系。近年来,在一些甲壳动物物种中发现了昆虫MF的环氧化酶CYP15A1的存在,本课题组近期在研究三疣梭子蟹CYP15A1时也发现其在肝胰腺、卵巢、Y器等组织中均有表达。因此,MF极有可能在这些器官中进一步被环氧化成JH,进而被JHEH催化降解。
总之,本研究对三疣梭子蟹JHEH基因的全长cDNA进行了分子克隆并分析了其在不同组织及卵巢发育和蜕皮过程中的表达水平变化。通过比较分析蜕皮及卵巢发育过程中JHEH基因表达模式与MF浓度变化的关系,本研究探讨了JHEH在MF代谢通路中的可能作用,为今后阐明JHEH的功能奠定了理论基础,也有助于进一步完善甲壳动物蜕皮及卵巢发育的内分泌调控机制。
