子痫前期孕妇孕早期、孕中期血清25(OH)D3水平变化及其意义
2021-01-07朱飞龙陈慧芬张军吴瑛婷刘媛
朱飞龙,陈慧芬,张军,吴瑛婷,刘媛
同济大学附属第一妇婴保健院,上海 200040
子痫前期(PE)是一种多系统疾病,以高血压、蛋白尿、肾脏、肝脏和神经受累为特征[1]。重度子痫前期(SPE)甚至可导致孕妇肝脏、肾脏、大脑和凝血系统出现问题,胎儿存在发育不良、早产、围产期死亡等不良结局的风险,是造成孕产妇及新生儿患病率、病死率升高的主要原因之一[2],终止妊娠是惟一已知的治疗SPE的有效方法。PE临床表现通常出现在妊娠晚期,潜在的致病机制可能更早发生,但由于发病机制和病因学至今尚未阐明,防治存在一定难度。近年来,孕妇维生素D状态在PE病理生理发展中的作用越来越受到关注。维生素D可能促进母体和胎儿对感染的先天反应,同时防止过度炎症反应,这对维持正常妊娠非常重要[3]。维生素D也被认为可能有助于胎儿的免疫,并减少早期生命中的过敏反应[4]。流行病学研究显示,PE与母体维生素D降低有关,孕中期维生素D水平低的孕妇患PE风险更大[5-6]。25(OH)D3在血清中高度稳定,半衰期约为3周,因此被认为是指示人体维生素D水平状况的准确血清生物标志物[7]。本研究观察了PE孕妇不同孕期血清25-羟基维生素D[25(OH)D3]水平变化,并探讨其意义。
1 资料与方法
1.1 临床资料 选取2018年1月—2019年6月上海市第一妇婴保健院建卡产检并住院分娩的孕妇962例。纳入标准:①无流产史,自然受孕的单胎初产妇;②均进行血清25(OH)D3水平检测;③均在我院定期产检及分娩;④有完整的临床资料;⑤无吸烟、酗酒等不良嗜好。排除标准:慢性高血压、糖尿病、肾病、肾炎、狼疮等妊娠合并症。入选对象中PE孕妇462例,诊断标准:根据美国妇产科医师学会(ACOG)《妊娠期高血压和子痫前期指南2019版》:①血压:孕前血压正常,孕20周后出现收缩压≥140 mmHg或舒张压≥90 mmHg,2次测量血压至少间隔4 h;收缩压≥160 mmHg或舒张压≥110 mmHg。②尿蛋白:24 h尿蛋白>300 mg;蛋白/肌酐≥0.3;尿常规蛋白++及以上。③尿蛋白阴性情况下符合以下新发的表现:a.血小板减少:血小板计数<100×109/L;b.肾功能不全:血清肌酐>97 μmol/L或高于正常上限2倍,排除其他肾脏疾病;c.肝功能受损:转氨酶高于正常上限2倍;d.肺水肿;e.新发头痛,普通药物治疗不缓解,排除其他原因或视物模糊[8]。PE中SPE孕妇335例(重度组),年龄18~34(28.5±2.5)岁,BMI[9]<18.5 kg/m228例、18.5~24.9 kg/m2241例、>24.9 kg/m266例;非重度子痫前期孕妇127例(非重度组),年龄23~43(31.5±2.5)岁,BMI<18.5 kg/m217例、18.5~24.9 kg/m283例、>24.9 kg/m227例。同期健康体检孕妇500例(对照组),年龄19~43(29.5±1.5)岁,BMI<18.5 kg/m248例、18.5~24.9 kg/m2365例、>24.9 kg/m287例。
1.2 血清25(OH)D3检测方法 孕早期(14周)、孕中期(28周)非空腹静脉取血各2~3 mL,静置1 h,以3 500 r/min的速度离心10 min,取上清液(血清),移入EP管中,-80 ℃冰箱冻存备用。采用25(OH)D3测定试剂盒(ARCHITECT)在美国ARCHITECT i2000化学发光免疫分析仪上进行检测,质控采用RANDOX免疫质控品。25(OH)D3正常值参考范围23.75~138.75 nmol/L,是ARCHITECT公司根据临床和实验室标准研究所(CLSI)的方案C28-A320进行的。根据美国制定的维生素D缺乏判断标准,25(OH)D3<50 nmol/L为维生素D缺乏[10]。
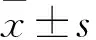
2 结果
2.1 各组不同孕期25(OH)D3水平比较 不同孕期25(OH)D3水平比较见表1。

表1 各组不同孕期25(OH)D3水平比较
2.2 各组不同孕期维生素D缺乏情况比较 重度组、非重度组、对照组孕早期25(OH)D3缺乏分别为205例(61.2%)、68例(53.5%)、225例(45%),孕中期25(OH)D3缺乏分别为208例(62.1%)、79例(62.2%)、193例(38.6%),重度组、非重度组分别与对照组比较,P均<0.05。
3 讨论
SPE会导致围生儿病死率高,NICU入住率高,并伴有较多的并发症,严重威胁母婴健康和生命[11]。Arun估计PE的发病率在全世界所有妊娠中高达8%,是孕产妇和围产期发病率和病死率的主要原因[12]。一项Meta分析指出,怀孕期间缺乏维生素D会增加病理性怀孕的风险,包括增加PE(2.09)、早产(1.58)和低出生体质量(1.52)的风险[13]。研究显示,妊娠23~28周的孕妇维生素D缺乏与SPE有关,维生素D缺乏孕妇患SPE几率增加3倍以上[14]。临床上将血压和24 h尿蛋白定量作为PE的金标准,然而24 h尿蛋白定量检测繁琐、耗时长、准确性欠佳、患者依从性差等诸多缺点,血压测量影响因素也过多,所以寻找有效、稳定、实用的预测指标显得尤为重要。
维生素D是一种促性腺激素,已知在许多生理过程中起重要作用,如调节细胞增殖和分化过程、免疫调节、血管生物学和胎盘代谢和功能[15]。本研究显示,重度组孕早期血清25(OH)D3水平低于对照组,重度组和非重度组孕中期血清25(OH)D3水平均低于对照组,由此可见,25(OH)D3的降低在孕早期可作为SPE的独立危险因素,在孕中期可作为PE的独立危险因素。本研究还显示,与同组孕早期比较,重度组孕中期25(OH)D3水平升高,非重度组孕中期25(OH)D3水平降低,提示孕早期(14周)和孕中期(28周)测得的25羟基维生素D水平对于PE发病都有独立意义,所以建议孕早期开始及时检测25(OH)D3。本文结果显示,与对照组比较,重度组和非重度组孕早期、孕中期25(OH)D3缺乏率高,提示孕妇孕期维生素D降低可能与PE的风险增加有关,PE妇女血清25(OH)D3水平降低在PE发病机制中存在一定作用。
虽然维生素D导致PE的具体发病机制仍需要进一步研究来确认,但是临床可对维生素D缺乏进行早期筛查与发现,及时通过改善孕妇生活方式及饮食进行预防[16]。一项Meta分析表明,补充维生素D可以降低PE的风险[17],怀孕期间补充维生素D有助于提高孕妇体内维生素D的水平,但是关于降低PE风险的剂量的证据有限[18],而且到目前为止还没有关于单独服用维生素D与PE风险的随机对照试验的文章发表,所以在孕期补充维生素D的方式跟剂量还有待进一步研究。
总之,孕妇血清25(OH)D3水平降低与PE发病具有密切联系,一定程度上可作为PE发生的预测指标,在孕早期和孕中期检测血清25(OH)D3水平可能对于SPE都有一定预测作用;在孕中期甚至对非重度子痫前期也具有一定预测作用。
