PDCA循环在药物临床试验质量管理中的应用
2021-01-06宋纪伟
宋纪伟
吉林省吉林市人民医院药学部,吉林吉林 132000
药物临床试验是新药研发过程中必不可少的重要环节,是在受试者身上开展的针对新药药理、药效、代谢、排泄以及不良反应等各方面的系统性研究,从而评估新药的有效性及安全性[1-2]。药物临床试验的质量与药物上市后临床用药的安全性有直接关系,影响受试者的身体健康[3]。药物临床试验的质量管理是遵循《药物临床试验质量管理规范》对药物临床试验中各个环节采用措施进行质量控制的过程[4]。药物临床试验的质量涉及各种不同环节的工作,其中任何一个环节存在不规范操作,都可能会对临床试验质量造成不良影响[5]。因此,加强药物临床试验质量管理,提升管理质量对于保障药物临床试验的效果和受试者的安全有积极的意义。PDCA循环也被称为“戴明环”,是用于质量管理的标准化、科学化循环体系。PDCA循环通过计划(plan,P)、执行(do,D)、检查(check,C)、处理(action,A)四个环节的不断循环实施,周而复始,循环上升,从而实现质量的持续改进[6]。1954年,美国质量管理专家戴明将PDCA循环应用于质量管理的过程中,取得了良好的应用效果。近年来,PDCA循环也被应用于药物临床试验研究的质量管理,提升药物临床试验过程中的药物管理、数据处理等环节的质量控制水平[7]。吉林省吉林市人民医院自2019年1月起在药物临床试验质量管理中尝试应用PDCA循环理论,寻求其中问题并进行不断改进,现将具体内容汇报如下。
1 资料与方法
1.1 一般资料
选取2019年1月吉林省吉林市人民医院药物临床试验质量管理中应用PDCA循环理论进行质量管理前后的药物临床试验研究的相关原始研究资料。其中2018年1~12月吉林省吉林市人民医院进行了药物临床试验8项,共有试验病例295例,其中男160例,女135例;平均年龄(46.3±6.4)岁。2019年1~12月吉林省吉林市人民医院进行了药物临床试验9项,共有试验病例326例,其中男178例,女148例;平均年龄(47.2±6.9)岁。两组的一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究已获医院医学伦理委员会审核批准。
1.2 方法
吉林省吉林市人民医院自2019年1月起在药物临床试验质量管理中尝试应用PDCA循环理论,具体实施步骤如下。
1.2.1 计划阶段(P)召集药物临床试验的研究者及相关工作人员进行头脑风暴,对2018年1~12月吉林省吉林市人民医院药物临床试验质量控制情况进行调研,对于药物临床试验实施过程中的质量管理相关问题进行分析,并总结其发生原因,发现吉林省吉林市人民医院既往药物临床试验中存在以下问题。①病例报告记录不规范:病例报告表(CRF)中存在记录不规范、漏写、错写以及填写不及时的问题;②方案偏离:受试者依从性不佳,研究操作执行不规范,有漏做的实验室检查;③不良事件上报问题:不良事件记录不够完整、漏记,不良事件上报不及时或者没有上报;④试验药品的管理问题:试验药物在保管、领用、使用、回收时存在记录不全、记录不准确或不及时的问题;⑤知情同意问题:受试者签署知情同意书时存在他人代签、印章代替签字、填写不规范的问题。采用鱼骨图,主要从研究者、申办方以及制度流程等不同方面探讨分析临床药物试验质量不合格的原因,找出主要的影响因素。确立药物临床试验质量控制作为质量持续改进的内容,针对发现的问题和相关原因制订相应的改进计划。
1.2.2 执行阶段(D)①健全完善相关制度,统一质量控制的检查标准:参照GCP、《中华人民药品管理法实施条例》等相关法规,制订药物临床试验质量控制的标准操作规程(SOP),将药物临床试验每个环节的操作进行细化,明确研究人员的职责分工,并制订不同阶段的统一质量控制评价表以及各个环节相关的质控检查表,包括在研项目质控检查表、试验文件资料管理检查表以及试验药品管理检查表。②增强项目的培训计划,提升研究者的GCP 意识:研究者的依从性是保障药物临床试验质量的关键所在。定期组织进行院内、院外GCP、SOP 相关知识的培训,必须严格按照GCP 要求进行操作,提升研究者的GCP 意识。在项目启动会上,要对研究者进行临床试验方案的统一培训,包括方案的实施、病例筛选、体征量化标准、临床疗效评价、不良反应的识别、不良事件上报以及CRF、《知情同意书》、管理检查表等相关文件填写要求等内容,提高研究者的依从性。③做好受试者的宣教,提升其研究依从性:在项目开展前,做好受试者的宣教,充分讲解研究的目的、风险等内容,并详细解释其疑问,严格执行知情同意,提升受试者的依从性,配合研究并提供第一手资料。④引入临床研究协调员(CRC),协助事务性工作:通过聘请或培养的方式引入CRC,尽量为每个项目配备CRC。在药物临床试验过程中,CRC 要协助研究者完成事务性的工作,例如试验资料的记录管理工作,以改善减少研究者因为临床工作繁忙,导致文件数据记录不及时、不准确的问题。⑤发挥监察员的作用,落实质控工作:充分发挥监察员的作用,加强访视和机构的质控,并对每个环节的质量控制情况进行定期抽查,检查实验方案的遵从情况和质量控制情况,发现问题并及时干预。
1.2.3 检查阶段(C)通过质控员、机构质控小组定期检查确认药物临床试验质量管理控制计划的具体实施情况,以保证每个环节的实施均符合相关要求,并定期评估药物临床试验的效果和质量控制计划的实施效果,观察其是否偏离研究目标。
1.2.4 处理阶段(A)针对检查阶段中出现的问题进行反馈分析,并进行对应处理,最后归纳总结经验,完善和调整质量管理计划,为提升下一个循环的药物临床试验质量管理水准提供参考依据。
1.3 观察指标
对于PDCA循环理论实施后的质量改进效果进行分析,比较PDCA循环理论实施前(2018年)、实施后(2019年)的药物临床试验过程中的病例报告记录不规范、方案偏离、不良事件上报问题、试验药品管理问题及知情同意问题等相关问题的发生情况。
1.4 统计学方法
采用SPSS 19.0 统计学软件进行数据分析和处理。计数资料采用频数和百分率(%)表示;采用χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2019年PDCA循环理论实施后,病例报告记录不规范、方案偏离、不良事件上报问题、试验药品的管理问题以及知情同意问题等问题总发生率为1.84%,低于2018年的10.17%,差异有统计学意义(P<0.05)(表1)。
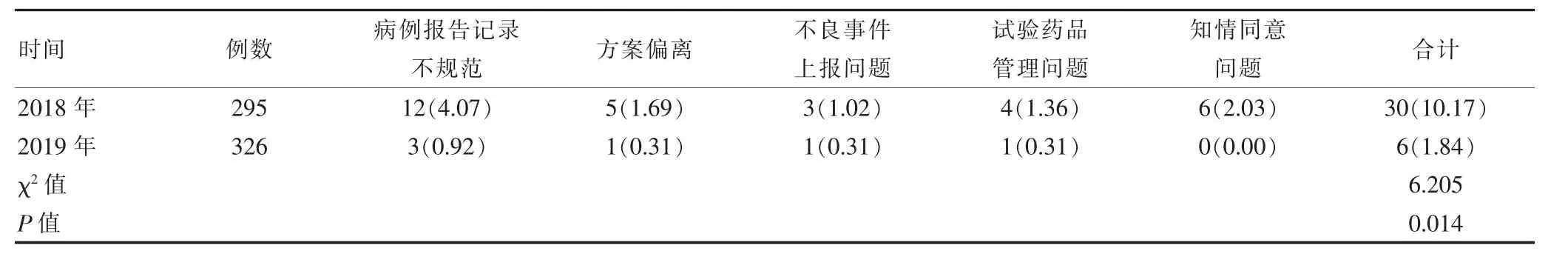
表1 PDCA循环理论实施后药物临床试验质量问题发生情况的比较[n(%)]
3 讨论
随着临床新药研发的不断进展,药物临床试验项目不断增加,社会对于药物临床试验的规范性和安全性的要求也越来越高[8]。药物临床试验是新药研发过程中极为重要的一个阶段,是保障新药安全性和有效性的必要手段和关键环节,因此近年来药物临床试验质量管理工作的重要性也日益突出[9]。药物临床试验质量管理工作贯穿药物临床试验项目的承接、申办、实施的全过程,寻求有效的药物临床试验质量管理方法成为临床关注的热点。PDCA循环是管理学中的一个通用模型,最早由美国质量管理专家休哈特博士提出的概念,戴明采纳并将其应用于质量管理的实践,继而获得普及[10]。PDCA循环就是质量计划的制订和组织实现的全部过程,按照计划、执行、检查和处理四个环节环环相扣,不断循环进行质量管理。每循环1次,就解决一部分问题,因此PDCA循环是一个不断解决问题、逐步螺旋上升的过程。PDCA循环早期主要广泛用于企业管理工作的改善,效果显著,后期逐渐被应用于临床各个科室工作的质量管理[11]。本研究将其应用于药物临床试验的质量管理,首先对于过去1年中我院药物临床试验实施过程中的管理相关问题进行调查和总结,主要包括病例报告记录不规范、方案偏离、不良事件上报问题、试验药品的管理问题以及知情同意问题等问题,这与关灵等[12]研究中的药物临床试验实施过程中的管理相关问题调研结果基本相符;继而通过鱼骨图和头脑风暴分析其质量问题发生原因,并制订相关质量控制计划和改进措施,通过健全完善相关制度,制订统一质量控制的检查标准,增强项目的培训计划,提升研究者的GCP 意识,做好受试者的宣教,提升受试者研究依从性,减少培训不到位,研究者不理解、操作执行不规范以及受试者依从性不高造成的相关质量问题;引入CRC 协助研究人员完成事务性工作,减少文件数据记录不及时、不准确的问题,并充分发挥监察员的作用,落实质控工作,发现问题并及时干预,从研究者、申办者以及机构、流程等各个方面进行干预质量管理问题的相关因素;另外,通过检查和处理阶段对于质量控制计划实施结果进行评估,对于各个环节存在的问题进行指出和完善改进,并将存在的问题进入下一个PDCA循环圈,不断完善药物临床试验质量管理的管理模式,从而持续性提升药物临床试验质量管理的质量[13-14]。本研究结果显示,2019年PDCA循环理论实施后,病例报告记录不规范、方案偏离、不良事件上报问题、试验药品的管理问题以及知情同意问题等问题的发生率明显降低,这与李立红等[15]的研究一致,提示在药物临床试验质量管理中应用PDCA循环有助于提升药物临床试验管理质量。
综上所述,在药物临床试验质量管理中应用PDCA循环能健全完善质量管理模式,有助于提升药物临床试验管理质量。
